Força de Ligação: Ligações Covalentes
Existem moléculas estáveis porque as ligações covalentes mantêm os átomos juntos. Medimos a força de uma ligação covalente pela energia necessária para a quebrar, ou seja, a energia necessária para separar os átomos ligados. A separação de qualquer par de átomos ligados requer energia; quanto mais forte for uma ligação, maior é a energia necessária para quebrá-la. A energia necessária para quebrar uma ligação covalente específica em uma molécula gasosa é chamada de energia de ligação ou energia de dissociação da ligação. A energia de ligação para uma molécula diatômica, D_X-Y, é definida como a mudança de entalpia padrão para a reação endotérmica:
>
Por exemplo, a energia de ligação da ligação pura covalente H-H, {\Delta_{H-H}}, é 436 kJ por molécula de ligação H-H quebrada:
Quebrar uma ligação requer sempre energia para ser adicionada à molécula. De forma correspondente, fazer uma ligação sempre libera energia.
Moléculas com três ou mais átomos têm duas ou mais ligações. A soma de todas as energias de ligação em tal molécula é igual à mudança de entalpia padrão para a reação endotérmica que quebra todas as ligações na molécula. Por exemplo, a soma das quatro energias de ligação C-H em CH4, 1660 kJ, é igual à mudança de entalpia padrão da reação:
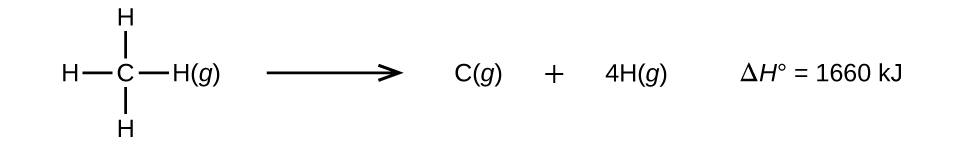
A energia média de ligação C-H, \(D_{C-H}\), é 1660/4 = 415 kJ/mol porque há quatro moles de ligação C-H quebrados por molha da reação. Embora as quatro ligações C-H sejam equivalentes na molécula original, cada uma delas não requer a mesma energia para se quebrar; uma vez quebrada a primeira ligação (que requer 439 kJ/mol), as ligações restantes são mais fáceis de quebrar. O valor de 415 kJ/mol é a média, não o valor exacto necessário para quebrar qualquer ligação.
A força de uma ligação entre dois átomos aumenta à medida que o número de pares de electrões na ligação aumenta. Geralmente, à medida que a resistência da ligação aumenta, o comprimento da ligação diminui. Assim, descobrimos que as ligações triplas são mais fortes e mais curtas que as ligações duplas entre os mesmos dois átomos; da mesma forma, as ligações duplas são mais fortes e mais curtas que as ligações simples entre os mesmos dois átomos. As energias médias das ligações para algumas ligações comuns aparecem na Tabela 2, e uma comparação dos comprimentos e das forças de ligação para algumas ligações comuns aparece na Tabela 2. Quando um átomo se liga a vários átomos de um grupo, a força de ligação normalmente diminui à medida que nos movemos para baixo no grupo. Por exemplo, C-F é 439 kJ/mol, C-Cl é 330 kJ/mol, e C-Br é 275 kJ/mol.
| Bond Energy | Bond Energy | Bond Energy | Bond Energy | Bond Energy | Bond Energy | ||
|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | ||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | ||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | ||
| H-O | 464 | C-I | 240 | Si-P | 215 | ||
| H-F | 569 | N-N | 160 | Si-S | 225 | ||
| H-Si | 395 | \(\mathrm{N=N}\) | 418 | Si-Cl | 359 | ||
| H-P | (\mathrm{N≡N}\) | 946 | Si-Br | 290 | |||
| H-S | 340 | N-O | 200 | Si-I | 215 | ||
| H-Cl | 432 | N-F | 270 | P-P | 215 | ||
| H-Br | 370 | N-P | 2106> | P-S | 230 | ||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | ||
| C-C | 345 | N-Br | 245 | P-Br | 270 | ||
| (\mathrm{C=C}\) | 611 | O-O | 140 | P-I | 215 | ||
| (\mathrm{C≡C}\) | 837 | (\mathrm{O=O}) | 498 | S-S | 215 | ||
| C-N | 290 | O-F | 160 | S-Cl | 250 | ||
| \(\mathrm{C=N}\) | 615 | O-Si | 370 | S-Br | 215 | ||
| (\mathrm{C≡N}\) | 891 | O-P | Cl-Cl | 243 | |||
| C-O | O-Cl | 205 | Cl-Br | 220 | 220 | ||
| (\mathrm{C=O}\) | 741 | O-I | 200 | Cl-I | 210 | ||
| \(\mathrm{C≡O}\) | 1080 | F-F | 160 | Br-Br | 190 | ||
| C-F | 439 | F-Si | 540 | Br-I | 180 | ||
| C-Si | F-P | 489 | I-I | 150 | |||
| C-P | 265 | F-S | 285 |
| Bond | Comprimento das obrigações (Å) | Bond Energy (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C-O | 1.43 | |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
Podemos usar as energias de ligação para calcular as alterações de entalpia aproximadas para as reacções onde as entalpias de formação não estão disponíveis. Cálculos deste tipo também nos dirão se uma reação é exotérmica ou endotérmica.
- Uma reação exotérmica (ΔH negativo, calor produzido) resulta quando as ligações nos produtos são mais fortes que as ligações nos reatantes.
- Uma reação endotérmica (ΔH positivo, calor absorvido) resulta quando as ligações nos produtos são mais fracas que as ligações nos reatantes.
A mudança de entalpia, ΔH, para uma reação química é aproximadamente igual à soma da energia necessária para quebrar todas as ligações nos reatantes (energia “in”, sinal positivo) mais a energia liberada quando todas as ligações são formadas nos produtos (energia “out”, sinal negativo). Isto pode ser expresso matematicamente da seguinte forma:
Nesta expressão, o símbolo \(\Sigma\) significa “a soma de” e D representa a energia de ligação em kilojoules por mole, que é sempre um número positivo. A energia da ligação é obtida a partir de uma tabela e dependerá se a ligação em particular é uma ligação simples, dupla ou tripla. Assim, ao calcular as entalpias desta forma, é importante que consideremos a ligação em todos os reagentes e produtos. Como os valores D são tipicamente médias para um tipo de ligação em muitas moléculas diferentes, este cálculo fornece uma estimativa aproximada, não um valor exato, para a entalpia da reação.
Considerar a seguinte reação:
ou
\
Para formar dois moles de HCl, um molar de ligações H-H e um molar de ligações Cl-Cl deve ser quebrado. A energia necessária para quebrar estas ligações é a soma da energia da ligação H-H (436 kJ/mol) e da ligação Cl-Cl (243 kJ/mol). Durante a reação, dois moles de ligações H-Cl são formados (energia da ligação = 432 kJ/mol), liberando 2 × 432 kJ; ou 864 kJ. Como as ligações nos produtos são mais fortes que as dos reagentes, a reacção liberta mais energia do que consome:
\-2D_{H-Cl}}
&=\mathrm{-2(432)=-185\:kJ}
>
Este excesso de energia é libertado como calor, pelo que a reacção é exotérmica. A tabela T2 dá um valor para a entalpia molar padrão de formação de HCl(g), \(ΔH^^^circ_ce f\), de -92.307 kJ/mol. Duas vezes esse valor é -184,6 kJ, o que concorda bem com a resposta obtida anteriormente para a formação de dois moles de HCl.
Exemplo \\(\PageIndex{1}}): Usando Energias de Ligação para Alterações Aproximadas de Entalpia
Metanol, CH3OH, pode ser um excelente combustível alternativo. A reação a alta temperatura do vapor e do carbono produz uma mistura dos gases monóxido de carbono, CO e hidrogênio, H2, a partir dos quais o metanol pode ser produzido. Usando as energias de ligação da Tabela \\PageIndex{2}, calcule a mudança de entalpia aproximada, ΔH, para a reação aqui:
Solução
Primeiro, precisamos escrever as estruturas de Lewis dos reagentes e os produtos:
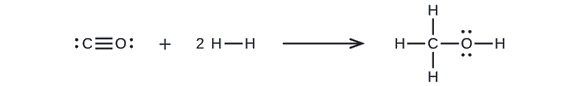
A partir daí, vemos que ΔH para esta reação envolve a energia necessária para quebrar uma ligação C-O tripla e duas ligações H-H simples, bem como a energia produzida pela formação de três ligações C-H simples, uma ligação C-O simples, e uma ligação O-H simples. Podemos expressar isto da seguinte forma (via Equação \ref{EQ3}):
\-}
>
>
Usando os valores da energia da ligação na Tabela \(\PageIndex{2}), obtemos:
&==ce{-107}:kJ}
Podemos comparar este valor com o valor calculado com base nos dados do Anexo G:
&==-
Note que existe uma lacuna bastante significativa entre os valores calculados usando os dois métodos diferentes. Isto ocorre porque os valores D são a média das diferentes forças de ligação; portanto, muitas vezes eles dão apenas uma concordância aproximada com outros dados.
Exercício \(\PageIndex{1}\)
Álcool etílico, CH3CH2OH, foi um dos primeiros produtos químicos orgânicos deliberadamente sintetizados por humanos. Ele tem muitos usos na indústria, e é o álcool contido nas bebidas alcoólicas. Pode ser obtido pela fermentação de açúcar ou sintetizado pela hidratação do etileno na seguinte reação:

Usando as energias de ligação na Tabela \PageIndex{2}}, calcule uma mudança de entalpia aproximada, ΔH, para esta reação.
Sumário
Vídeo \(\PageIndex{2}\PageIndex{2}): Uma revisão da ligação atómica.
A ligação covalente forma-se quando os electrões são partilhados entre átomos e são atraídos pelos núcleos de ambos os átomos. Em ligações covalentes puras, os elétrons são compartilhados igualmente. Em ligações polares covalentes, os elétrons são compartilhados de forma desigual, já que um átomo exerce uma força de atração mais forte sobre os elétrons que o outro.
A força de uma ligação covalente é medida pela sua energia de dissociação da ligação, ou seja, a quantidade de energia necessária para quebrar essa ligação particular em uma molécula. Ligações múltiplas são mais fortes que ligações simples entre os mesmos átomos. A entalpia de uma reacção pode ser estimada com base na energia necessária para quebrar ligações e na energia libertada quando novas ligações são formadas.
Equações-chave
- Energia de ligação para uma molécula diatómica: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩDbonds quebrado – ƩDbonds formado
Footnotes
- Esta pergunta é retirada do Exame de Colocação Avançada de Química e é usada com a permissão do Serviço de Testes Educacionais.
Glossary
energia de ligação (também, energia de dissociação de ligação) energia necessária para quebrar uma ligação covalente numa substância gasosa
Contribuintes
-
Flores de Paul (Universidade da Carolina do Norte – Pembroke), Klaus Theopold (Universidade de Delaware) e Richard Langley (Stephen F. Austin State University) com autores contribuintes. O conteúdo do livro didático produzido pelo OpenStax College é licenciado sob uma licença Creative Commons Attribution License 4.0. Faça o download grátis em http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource, gratuitamente, sob uma Licença Creative Commons: Attribution-NonCommercial CC BY-NC (Ver Escritura de Licença: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry: Crash Course é uma divisão do Complexly e os vídeos são gratuitos para fins educacionais.
Feedback
Dê feedback para dar sobre este texto? Clique aqui.
Found a typo and want extra credit? Clique aqui.