Introdução
Infecção pelo vírus da hepatite B (HBV) é a causa mais comum de cirrose hepática e carcinoma hepatocelular na maioria das partes da Ásia.1,2 A patogênese da hepatite crônica é mediada pela interação da reação imune do hospedeiro e dos hepatócitos que apresentam antígenos do VHB.3,4 Estudos anteriores demonstraram que a expressão dos antígenos do VHB pelos hepatócitos está relacionada de forma importante ao estágio e à atividade da doença hepática crônica. Na fase de tolerância imunológica, os antígenos do núcleo da hepatite B (HBcAg) são encontrados principalmente no núcleo e se correlacionam com a replicação do HBV enquanto, na fase de depuração imunológica subsequente, ocorre uma mudança intra-hepática do HBcAg do núcleo para o citoplasma e está associada com as atividades histológicas da hepatite crônica.5,6 Em casos de expressão intra-hepática do antígeno de superfície da hepatite B (HBsAg), foram relatados três padrões-tipo homogêneo, hepatócito de vidro moído tipo I (GGH), e GGH tipo II. Padrões homogêneos em apresentações agrupadas, discretas ou fracas foram observados em pacientes com viremia alta ou hepatite ativa. Os GGH do tipo I são tipicamente dispersos individualmente em lóbulos hepáticos com expressão homogênea densa, enquanto os GGH do tipo II expressam antígenos superficiais na periferia dos hepatócitos, que se agrupam em grupos e estão geralmente presentes durante a fase de baixa replicação, tornando-se prevalentes desde hepatite ativa até cirrose hepática e carcinoma hepatocelular.7-10 Assim, tanto as expressões intra-hepáticas HBcAg como HBsAg estão intimamente ligadas ao curso natural da infecção e da replicação do HBV.
Durante as fases da hepatite B crônica, a fase de imunodepuração ou nomeada como HBeAg-positivo da hepatite B freqüentemente ocorreu em populações mais jovens, exibiu atividades histológicas menos severas e abrigou menos taxas de mutação pré-natal A1896 e de mutação do núcleo basal (BCP) T1762/A1764 do que as mutações do HBeAg-negativo da hepatite crônica B.11-14 O curso da hepatite B crônica é dinâmico que resultou da interação da replicação viral e do sistema imunológico do hospedeiro. Consequentemente, a diversidade de características clínicas ou atividades histológicas é comumente observada em pacientes positivos ao HBeAg. Por exemplo, 34 a 55% dos pacientes exibem fibrose ou cirrose em ponte na histologia hepática, enquanto os pacientes restantes exibem fibrose leve.15,16 O acúmulo de HBsAg em hepatócitos tem se mostrado associado a mutações virais específicas e relacionado a atividades da doença.8,9 É interessante investigar as características da expressão intra-hepática do HBsAg em pacientes com diferentes severidades da histologia hepática.
Mutações virais geralmente evoluíram sob pressão de vigilância imunológica do hospedeiro. Entre os mutantes naturais do HBV, as mutações do BCP T1762/A1764 tornaram-se prevalentes com a progressão da doença e têm sido frequentemente associadas a doença hepática avançada e carcinoma hepatocelular.17,18 Os padrões de expressão intra-hepática do HBsAg também mudaram durante o curso natural da hepatite B crônica. A associação das mutações do BCP T1762/A1764 e a expressão intra-hepática do HBsAg ainda é desconhecida e ficou por estudar.
Por isso, o objetivo deste estudo foi avaliar as características da expressão intra-hepática do HBsAg e analisar a associação com histologia hepática, marcadores de replicação viral e mutantes do HBV no HBeAg positivo para hepatite crônica B.
Material e MétodosPatientes
Um total de 181 pacientes com hepatite B e antígeno (HBeAg) positivo que preencheram os critérios de inclusão foram cadastrados retrospectivamente neste estudo. Os critérios de inclusão foram uma idade superior a 18 anos e inferior a 70 anos, HBsAg positivo por mais de 6 meses e nível sérico de DNA do VHB ≥ 100.000 cópias/mL, nível sérico anormal de alanina aminotransferase, nenhuma outra etiologia explicável da hepatite crônica, incluindo álcool, hepatite auto-imune ou marcadores do vírus da hepatite C, vírus da hepatite D ou infecção pelo vírus da imunodeficiência humana, e a falta de um histórico de tratamento anti-VHB e de amostras de biopsia hepática disponíveis para avaliação histológica. A biópsia sérica e hepática de todos os pacientes foi feita antes dos tratamentos antivirais e as amostras foram armazenadas a -70 oC até o teste. Este estudo foi aprovado pelo Institutional Review Board do National Cheng Kung University Hospital (No: ER-99-398). O consentimento informado foi obtido, de acordo com a Declaração de Helsinki.
ensaios virológicos do HBV
A genotipagem do HBV foi realizada pela reação em cadeia da polimerase múltipla, como descrito em outra parte.19 O nível sérico de DNA do HBV foi medido usando o teste COBAS Amplicor HBV Monitor (ensaio COBAS-AM, Roche Diagnostics, Branchburg, NJ). O nível sérico de HBsAg foi quantificado pelo Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, França) com um intervalo dinâmico de 0,05-250,0 IU/mL. Amostras com níveis de HBsAg > 250 UI/mL foram testadas novamente em diluições de 1:20 e 1:1000.
Reacção em cadeia da polimerase e sequenciação das regiões de pré-núcleo e BCP
HBV ADN foi extraído de 50 μL de soro usando o Mini Kit Genómico de Sangue e Tecido (VIOGENE, Taipei, Taiwan). A PCR da primeira fase foi realizada sob as seguintes condições: 96 oC durante 2 min, 94 oC durante 1 min, 54 oC durante 1 min e 72 oC durante 2 min com iniciadores 5′-ACCTCTGCACGTAGCATGG (para a frente) e 3′-GGATTAAAGAGAGGTACAGTAGAAG (para trás). A segunda PCR redonda foi realizada nas mesmas condições com os iniciadores 5′-ATGTCAACGACCGACCTTGA (à frente) e 3′-TTTCCCACCTTATGAGTCCAAG (reverso). Os produtos de PCR purificados foram então sequenciados diretamente usando um seqüenciador automático de DNA ABI 310 e o ABI PRISM Big Dye Terminator Cycle Reaction Requencing Kit (Applied Biosystems) com o primer forward que foi utilizado durante o segundo ciclo de PCR.
Liver histology
Liver histology foi avaliada por um único patologista que desconhecia os antecedentes dos pacientes. Necroinflamação e fibrose foram avaliadas com base no grau de necroinflamação de Knodell (variando de 0 a 18)20 e no estágio de fibrose de Ishak (variando de 0 a 6),21 respectivamente.
A coloração imunohistoquímica foi realizada conforme descrito em outra parte.22 Em resumo, deparaffinizada 5 μm – seções espessas foram incubadas com anti-HBsAg monoclonal de rato (Clone 3E7, Dako Corp., Carpinteria,USA) e anti-HBcAg (Novocastra Laboratories, Newcastle, UK) durante a noite a 4°C. A diluição ótima do anti-HBsAg ou anti-HBcAg foi determinada usando tecido hepático do portador do HBV como controle positivo. O StrAviGen Super Sensitive MultiLink Kit (BioGenex) foi usado para detectar o complexo imunológico resultante. A atividade peroxidase foi visualizada por um kit de substrato de aminoethyl carbazole (Zymed Laboratory, Inc, San Francisco, CA). Finalmente, as secções foram contra-manchadas com hematoxilina. Como controlo negativo, a imunoglobulina não imune do rato foi substituída por anticorpos primários na incubação. Padrões de expressão do HBcAg pelo núcleo, citoplasma, ou ambos, foram registrados. Padrões de expressão do HBsAg foram classificados como homogêneos, tipo I GGH, tipo II GGH.22 Hepatócitos com coloração homogênea foram identificados como hepatócitos com coloração citoplasmática homogênea moderada a forte; GGHs tipo I foram identificados como hepatócitos com coloração globular densa ou “tipo inclusão”, e GGHs tipo II foram identificados como hepatócitos com coloração de antígeno superficial nas margens celulares ou periferia.6,22 Os GGHs tipo I se dispersam individualmente ou se aglomeram nos lóbulos hepáticos enquanto os GGHs tipo II se aglomeram consistentemente em nódulos. Os níveis de expressão do HBcAg e HBsAg foram pontuados semi-quantitativamente de acordo com a proporção de células imunolabeladas, em uma escala de 0 a 4+, correspondendo à positividade em 0, 1-10, 11-25, 25-50% e mais de 50% dos hepatócitos examinados.
Análises estatísticas
Os dados foram expressos como média ± desvio padrão. As variáveis contínuas foram comparadas utilizando o teste Mann-Whitney U ou Kruskal-Wallis ANOVA para análise univariada. As variáveis categóricas foram analisadas usando o teste χ2 ou o teste exato de Fisher. Os fatores independentes associados aos níveis de expressão intra-hepática do HBsAg foram realizados utilizando a análise de regressão logística multivariada. O manuseio dos dados e análises estatísticas foram realizados utilizando o software SPSS para Windows, versão 17.0 (SPSS Inc., Chicago, IL).
ResultadosCaracterística dos pacientes inscritos
Tabela 1 lista as características demográficas dos 181 pacientes inscritos. A maioria dos pacientes era do sexo masculino (69,1%) e 63,0% deles apresentavam o genótipo C do VHB. A mutação pré-natal A1896 foi detectada em 20 pacientes (11,0%) e a mutação BCP T1762/A1764 foi detectada em 38 pacientes (21,0%). Dos 181 pacientes, a coloração positiva do HB-sAg foi detectada em 105 pacientes (58,0%). Os pacientes com coloração HBsAg exibiram um HBsAg sérico significativamente maior (P
Características clínicas, virológicas e histológicas dos 181 pacientes.
| Características | Valor | |||
|---|---|---|---|---|
| Expressão HBsAg | Valor P | |||
| Todos os pacientes (n = 181) | Negativo (n = 76) | Positivo (n = 105) | ||
| Age (yr) ± SD | 36.4 ± 10.5 | 34,2 ± 9,2 | 38,0 ± 11,2 | 0,009 |
| Género (masculino/feminino) | 125/56 | 50/26 | 75/30 | 0.418 |
| Mean AST level (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0,634 |
| Nível ALT médio (U/L) ± SD | 116,3 ± 124,2 | 120,2 ± 100,8 | 113,5 ± 139.1 | 0,282 |
| Genótipo HBV (B/C) | 114/67 | 66/10 | 48/57 | |
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutante/selvagem | 38/143 | 12/64 | 26/79 | 0,144 |
| HBV ADN (cópias de log/mL) | 8,4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| HBsAg nível ((log IU/mL) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 |
| Mean Knodell grau de necroinflamação ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 |
| Estágio de fibrose Ishak do delírio ± SD | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 |
Mutant, T1762 e A1764; wild, A1762 e T1764. χ2 teste foi usado para variáveis de gênero, genótipo HBV, pré-núcleo e mutações promotoras basais, enquanto o teste Mann-Whitney U foi usado para outras variáveis. AST: aspartato aminotransferase. ALT: alanina-aminotransferase. BCP: promotor do núcleo basal. VHB: vírus da hepatite B.
Padrões de distribuição da expressão do HBsAg
No que diz respeito aos 105 pacientes que exibiram expressão do HBsAg, o padrão homogêneo (Figura 1A) foi detectado em 34 (32.4%) pacientes, GGH tipo I (Figura 1B) foi detectado no de 50 (47,6%), GGH tipo II (Figura 1C) foi detectado no de sete (6,7%) e um padrão misto no de 14 (13,3%). Como indicado na tabela 2, uma maior prevalência de mutações de BCP T1762/A1764 foi observada no GGH tipo II (P =0,001), em comparação com outros padrões. Houve uma relação recíproca entre a expressão do HBsAg e os marcadores de replicação viral sérica. Na figura 1D mostra que pacientes com expressão de GGH tipo II apresentaram níveis menores de DNA do HBV e títulos de HBsAg, mas níveis maiores de expressão intra-hepática do HBsAg (Figura 1D). Além disso, a histologia hepática mostrou GGH tipo II exibindo atividades de necroinflamação e fibrose hepática significativamente mais graves, e um maior nível de expressão intra-hepática do HBsAg (Figura 1E).
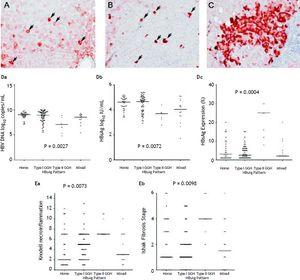
Padrão de coloração do HBsAg. A. Alguns citoplasmas homogêneos moderados a fortes HBsAg (setas) em um fundo de hepatócitos com coloração fraca. O núcleo de cada hepatócito homogeneamente corado estava localizado no centro da célula. B. Hepatócitos de vidro moído tipo I (GGH) com coloração globular densa ou “inclusiva” HBsAg (setas) foi dispersa no parênquima hepático. C. Um aglomerado de GGHs do tipo II mostrou coloração de HBsAg na margem ou periferia da célula. Correlações dos padrões de expressão do HBsAg e nível sérico de DNA do HBV (Da), nível sérico do HBsAg (Db), e nível de expressão intra-hepática do HBsAg (Dc). A associação de padrões de expressão de HBsAg e grau de necroinflamação de Knodell (Ea) e estágio de fibrose por Ishake (Eb). Comparações entre grupos foram analisadas por Kruskal-Wallis ANOVA.
Características demográficas por padrões de distribuição da expressão do HBsAg.
| HBsAg Padrão (n = 105) | |||||
|---|---|---|---|---|---|
| Misturado (n = 14) | Homogéneo | Tipo I GGH | Tipo II GGH | Valor P | |
| (n = 34) | (n = 50) | (n = 7) | |||
| Age (yr) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 |
| Gênero (masculino/feminino) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 |
| Mean AST nível (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 |
| Nível ALT médio (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 |
| Genótipo HBV (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 |
| BCP:* mutante/selvagem | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 |
| HBV ADN (cópias de registo/mL) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 |
| HBsAg nível ((log IU/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | |
| Knodell necroinflammation grade ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 |
| Ishak estágio de fibrose ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 e A1764; wild, A1762 e T1764. χ2 teste foi usado para variáveis de gênero, genótipo HBV, pré-núcleo e mutações promotoras do núcleo basal, enquanto o teste Mann-Whitney U foi usado para outras variáveis. AST: aspartato aminotransferase. ALT: alanina-aminotransferase. BCP: promotor do núcleo basal. VHB: vírus da hepatite B.
HBsAg nível de expressão
Figure 2A a 2D mostra a ilustração da medição semiquantitativa da expressão do HBsAg. Não houve nenhum paciente com escala 4+ da expressão do HBsAg neste estudo. Foi observada relação recíproca entre a replicação viral e a histologia hepática. Os pacientes com escalas 2+/3+ de expressão do HBsAg tinham níveis mais baixos de títulos de HBsAg e níveis de DNA do HBV, mas significativamente grau de necroinflamação grave e estágio de fibrose do que os pacientes com escala 1+ de expressão do HBsAg e coloração negativa do HBsAg (Figura 2E). Esses pacientes exibiram grau de necroinflamação Knodell ≥ 5 escore ou estágio de fibrose Ishake ≥ 1 teve porcentagens significativamente mais altas de expressão de HBsAg (Figura 3).
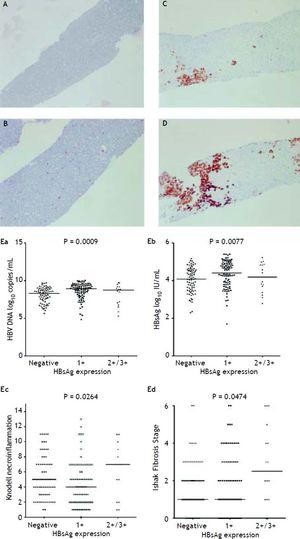
HBsAg expressão medida semi-quantitativamente de acordo com a proporção de células imunolabeladas, em uma escala de 0 a 3+, correspondente à positividade em (A) 0% (0), (B) 1-10% (C) 11-25% (2+), e (D) 25-50% (3+) de hepatócitos examinados. Correlações do nível de expressão do HBsAg e do DNA sérico do HBV (Ea) e do HBsAg (Eb), e grau de necroinflamação de Knodell (Ec) e estágio de fibrose de Ishak (Ed). Comparações entre os grupos foram analisadas por Kruskal-Wallis ANOVA.

Correlação da expressão do HBsAg intra-hepático com grau de necroinflamação de Knodell (A) e estágio de fibrose Ishak (B). Comparações entre os grupos foram analisadas pelo teste Mann-Whitney U.
>Características clínicas da expressão do HBsAg
Primeiro, examinamos a associação de fatores virais e a expressão do HBcAg/HBsAg. A expressão HBsAg, não a expressão HBcAg, mostrou um nível significativamente menor na presença de mutação pré-core (P = 0,001). Pacientes com genótipo C apresentaram maior estágio de fibrose hepática (P = 0,004). Em pacientes com mutações BCP T1762/A1764, houve um grau significativamente maior de necroinflamação e estágio de fibrose e menor expressão de HBcAg tanto no citoplasma quanto no núcleo. Todas estas observações indicaram uma lesão hepática ativa. Além disso, pacientes com mutações de BCP T1762/A1764 apresentaram maior expressão intra-hepática do HBsAg (9,3 ± 8,0% vs. 4,3 ± 5,0%, P = 0,008) (Tabela 3). Além disso, examinamos fatores que podem estar associados aos níveis de expressão do HBsAg. Na tabela 4, houve 16 pacientes com 2+/3+ escalas de expressão do HBsAg e 1+ escalas na escala de 89 pacientes. Uma análise univariada mostrou 2+/3+ escalas de expressão do HBsAg foi associada a mutações do BCP T1762/A1764, e necroinflamação e fibrose hepática mais graves. Uma análise de regressão multivariada revelou que as mutações BCP T1762/A1764 foram o fator independente que foi associado com 2+/3+ escalas de expressão intra-hepática do HBsAg.
Características clínicas, virológicas e histológicas de pacientes com ou sem mutantes virais.
| Precore mutation | Valor de p | Mutações PCP | Valor de p | ||||
|---|---|---|---|---|---|---|---|
| Não (n = 98) | Sim (n = 7) | Não (n = 79) | Sim (n = 26) | ||||
| Age (yr) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36,0 ± 10,6 | 43,8 ±11,1 | 0,005 | |
| Género (masculino/feminino) | 70/28 | 5/2 | 1.000 | 54/25 | 21/5 | 0.318 | |
| Mean AST nível (U/L) ± SD | 60,0 ± 58,3 | 71,3 ± 30,5 | 0,072 | 51,5 ± 32,1 | 87,3 ± 95.6 | 0,007 | |
| Nível ALT médio (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0.080 | |
| Genótipo HBV (B/C) | 45/53 | 3/4 | 1.000 | 44/35 | 4/22 | ||
| Precore: G1896/A1896 | 6/73 | 1/25 | 0.678 | ||||
| BCP:* mutante/selvagem | 25/73 | 1/6 | 0.678 | ||||
| ADN HBV (cópias log/mL) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | ||
| HBsAg nível ((log IU/mL) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | ||
| Knodell necroinflammation grade ± SD | 4,6 ± 3,0 | 6>6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | ||
| Ishak estágio de fibrose ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0.286 | 1,3 ± 1,4 | 3,4 ± 1,6 | ||
| HBcAg expressão citoplasmática (%) | 53,6 ± 25,8 | 44,3 ± 30,5 | 0,402 | 56,3 ± 25.4 | 42,7 ± 25,8 | 0,018 | |
| HBcAg expressão nuclear (%) | 13,5 ± 17,3 | 17,6 ± 31,6 | 0,800 | 17,6 ± 20,0 | 2,3 ±4.1 | ||
| HBsAg expressão (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0.003 | |
Mutant, T1762 e A1764; wild, A1762 e T1764. χ2 teste foi usado para variáveis de gênero, genótipo HBV, pré-núcleo e mutações promotoras do núcleo basal, enquanto o teste Mann-Whitney U foi usado para outras variáveis. AST: aspartato aminotransferase. ALT: alanina-aminotransferase. BCP: promotor do núcleo basal. VHB: vírus da hepatite B.
Associação de características demográficas e graus de expressão do HBsAg.
| Univariada | Multivariada | |||||
|---|---|---|---|---|---|---|
| Expressão HBsAg, escala | 1+ (n = 89) | 2+/3+ (n = 16) | valor de P | Relação de Odds (95% CI) | valor de P | |
| Idade | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0,963 (0,903-1,026) | 0,242 | |
| Gênero (masculino/feminino) | 63/26 | 12/4 | 1.000 | |||
| Nível anterior (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0.991∼1.063) | 0.142 | |
| Nível de TALT (U/L) | 103.3 ± 84.4 | 170.1 ± 297.2 | 0.386 | 0.991 (0.978∼1.005) | 0.216 | |
| Genótipo HBV (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994 | |
| Precore A1896 mutação (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 | |
| BCP:*mutant/Wild | 17/72 | 9/7 | 0,003 | 6,356 (1.204∼33.356) | 0.029 | |
| HBsAg nível (log10IU/mL) | 4,3 ± 0,7 | 4,2 ± 0,8 | 0,180 | 2,096 (0.598∼7.349) | 0.247 | |
| Serum DNA HBV (log10 cópias/mL) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0.386∼1.383) | 0.335 | |
| Knodell necroinflammation grading | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | |||
| Ishak fibrosis stage | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | |||
| HBcAg expressão citoplasmática (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | |||
| HBcAg expressão nuclear (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | |||
Mutante, T1762 e A1764; selvagem, A1762 e T1764. Análise univariada: χ2 teste foi usado para variáveis de gênero, genótipo HBV, pré-núcleo e mutações promotoras basais, enquanto o teste Mann-Whitney U foi usado para outras variáveis. Análise multivariada: Análise de regressão logística expressa como Odds ratio com intervalo de confiança de 95% e valores de P. AST: aspartato aminotransferase. ALT: alanina-aminotransferase. BCP: promotor do núcleo basal. VHB: vírus da hepatite B.
Discussões
Expressão intra-hepática do HBsAg está associada a diferentes estágios reprodutivos e evolução da doença durante o curso natural da hepatite crônica B.7,10,23 O GGH tipo I apresentou-se predominantemente no estágio ativo da hepatite, enquanto o GGH tipo II apresentou-se principalmente no estágio inativo ou cirrose.8 Neste estudo, demonstramos que o GGH tipo II se mostrou associado a histologia hepática mais grave, acompanhada de níveis séricos significativamente menores de DNA do VHB e títulos de HBsAg, e níveis relativamente maiores de expressão intra-hepática do HBsAg. Esta relação recíproca entre histologia hepática e replicação do HBV indicou que a ocorrência de GGH tipo II pode ser um marcador de doença hepática avançada durante a evolução da doença no HBeAg hepatite crônica B positiva. Padrões de expressão do HB-sAg têm sido relatados como relacionados com mutações virais distintas que têm impacto na regulação da replicação do HBV e defeito de secreção de antígeno superficial dos hepatócitos.9,24 O GGH tipo II abrigou consistentemente mutações de deleção pré-S2 que diminuíram a síntese de proteínas de superfície média e depois resultaram em acúmulo de proteínas de superfície grande em hepatócitos e defeito de secreção do HBsAg.25 Neste estudo, realizamos correlação do DNA sérico do HBsAg e do HBV entre pacientes com ou sem GGH tipo II. A correlação moderada entre os dois indicadores de replicação do HBV exibidos em pacientes sem o GGH tipo II (r = 0,686, P 26,27 A deleção pré-S poderia levar a estresse ER e ativar a transdução de sinal relacionado ao estresse. Lesão oxidativa do DNA hepatocitário e, em seguida, mecanismos estimulados de reparação do DNA podem resultar em instabilidade genômica que piora o dano hepático e é predisposta à carcinogênese.28
Além dos padrões de expressão do HBsAg, descobrimos que níveis de expressão mais elevados acompanhados de atividades histológicas hepáticas mais severas e maior taxa de mutações do BCP T1762/A1764. As mutações de BCP T1762/A1764 estão fortemente associadas com atividades histológicas graves do fígado e câncer de fígado.29,30 Ao nosso conhecimento, existe uma forte ligação entre o genótipo C e a presença de mutações de BCP T1762/A1764.30 Neste estudo, o genótipo C parece não ter nenhum papel no nível de expressão do HBsAg. Em contraste, as mutações BCP T1762/A1764 mostraram uma forte relação com a expressão do HBsAg. Com relação à mutação viral, as mutações BCP T1762/A1764 podem fornecer bases para outras mutações do HBV, incluindo deleções pré-S e mutantes complexos frequentemente encontrados na presença de mutações BCP T1762/A1764. Mutações complexas do HBV mostraram defeitos parciais ou completos na expressão e, núcleo e secreção da proteína superficial.31 A redução da secreção do antígeno superficial da hepatite B correlacionou-se com a localização aberrante das proteínas superficiais em ER e resultou em alta expressão do HBsAg. Além disso, a mutação do BCP T1762/A1764 é considerada como uma consequência da aptidão viral devido à pressão de seleção da vigilância imunológica do hospedeiro. Da mesma forma, as mutações pré-S2, que abrigam o GGH tipo II, coincidem com os epitopos T e B de células B restritos ao antígeno humano.32 Normalmente não há necrose celular ou infiltração de linfócitos T ao redor dos GGHs tipo II, sugerindo que o HBV com o surgimento da mutação de deleção pré-S2 também é um mutante de escape possivelmente novo.33 Entretanto, o acúmulo de antígeno de superfície em hepatócitos poderia acontecer sem carregar nenhuma das mutações virais conhecidas nos genomas pré-S ou S ou em promotores de superfície.31,34 Portanto, a expressão do HBsAg poderia ser uma seqüência em associação com ou sem mutações virais.
Este estudo teve várias limitações potenciais. As observações neste estudo foram baseadas em um desenho transversal retrospectivo, mas nenhum seguimento longitudinal foi realizado. O nível de expressão do HBsAg em hepatócitos e a gravidade histológica podem variar entre várias partes do fígado em um único paciente; a biópsia hepática per se não pode representar exatamente nenhum tecido hepático, exceto o núcleo da biópsia.
Em resumo, pacientes com padrão GGH tipo II ou níveis mais altos de expressão intra-hepática do HBsAg exibiram a relação recíproca entre atividades histológicas hepáticas mais severas e menor capacidade de replicação do HBV. A forte associação entre a expressão intra-hepática do HBsAg e as mutações do BCP T1762/A1764 indicou que a expressão do HBsAg poderia ser considerada como a manifestação histológica durante a evolução genômica do HBV sob pressão imune do hospedeiro.
A abreviações
- –
BCP: promotor do núcleo basal.
- –
GGH: hepatócito de vidro moído.
- –
HBcAg: antígeno do núcleo da hepatite B.
- –
HBeAg: antígeno da hepatite B e.
- –
HBsAg: antígeno de superfície da hepatite B.
- –
HBV: vírus da hepatite B.
Conflitos de interesse
T.-T. C. recebeu financiamento para pesquisa da Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation e Pfizer Inc. Não há conflito de interesses para os autores restantes.