Todos os elétrons de um átomo podem ser identificados exclusivamente por um conjunto de quatro números quânticos.

Embora sua descoberta exigisse matemática avançada, todos eles são números convencionais: três deles podem tomar apenas valores inteiros simples; o quarto é uma fração simples.
Os três primeiros números quânticos surgem da função de onda, Ψ, obtida pela solução da equação de Schrödinger.
O quarto número quântico, spin de electrões, surge da descoberta de que os electrões têm duas orientações possíveis.
Os números e suas definições são os seguintes:
Os números quânticos
| Número quântico | Nome | Valores possíveis | Informação |
|---|---|---|---|
| n | Número quântico principal | 1, 2, 3,…., n | Define o escudo energético ocupado pelo electrão. As conchas mais próximas do núcleo têm o menor valor de n e a menor energia potencial.n é o primeiro número escrito em configurações de elétrons como a do magnésio: 1s2 2s2 2p6 3s2 |
| l | orbital número quântico angular de impulso (também chamado de número quântico azimutal) |
0, 1, 2,…., (n-1) | Define a subesfera energética – em sistemas com mais de um electrão, as subesferas têm energias diferentes. l define a letra da subesfera em configurações de electrões. Por exemplo: 1s2 2s2 2p6 3s2 l = 0 dá uma subesquema. l = 1 dá uma subesquema p. l = 2 dá uma subesquema d, etc. |
| ml | número quântico magnético | -l, (l+1), …, 0,… , (l+1), l | Define a orientação da subesfera orbital. A subesfera p, com l = 1, tem três valores de ml: -1, 0, 1.Estes indicam que existem três orbitais p.i.e. os orbitais px, py, e pz. A subesquema d, com l = 2, tem cinco valores de ml: -2, -1, 0, 1, 2. Estes indicam que existem cinco orbitais d. |
| ms | número quântico de spin de electrões | -½ ou +½ | Electrões têm duas orientações possíveis de spin. |
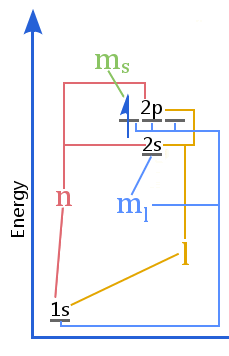
O diagrama de nível de energia mostra a relação entre números quânticos versus as conchas, sub-conchas, orbitais e spin de elétrons em um átomo.
Nenhum elétron em um átomo compartilha os quatro números quânticos.Cada elétron pode ser unicamente identificado pelo seu número quântico – ver princípio de exclusão Pauli.
As formas dos orbitais não são dadas pelos números quânticos, mas são densidades de probabilidade – mapas tridimensionais do espaço ao redor do núcleo onde um elétron será encontrado 99 por cento do tempo.As formas orbitais são obtidas a partir do quadrado da função de onda, Ψ2. A localização precisa e o momento de qualquer elétron nunca pode ser conhecido – ver princípio de incerteza de Heisenberg.
