Introdução
As bactérias Gram-positivas dos gêneros Bacillus e Clostridium podem se diferenciar para formar um endosporo (esporo), uma célula metabolicamente quiescente produzida em resposta a condições que não permitem o crescimento celular (McKenney et al., 2012). Uma vez libertado no ambiente, o esporo sobrevive no seu estado dormente por períodos extremamente longos, resistindo a uma vasta gama de tensões, tais como altas temperaturas, desidratação, ausência de nutrientes e a presença de químicos tóxicos (McKenney et al., 2012). Entretanto, o esporo quiescente é capaz de monitorar continuamente o ambiente e responder à presença de água e nutrientes, germinando e originando uma célula vegetativa capaz de crescer e esporular (McKenney et al., 2012). A resistência a condições não fisiológicas deve-se, em parte, às estruturas superficiais dos esporos. Em Bacillus subtilis, o sistema modelo para formadores de esporos, a superfície dos esporos é organizada em uma camada de várias camadas e em uma crosta, uma camada recentemente descoberta que envolve a camada de esporos (McKenney et al., 2012). B. subtilis spores are negatively charged (Huang et al., 2010; Pesce et al., 2014) and have a relative hydrophobicity that is in part due to the glycosylation of some spore surface proteins (Cangiano et al., 2014; Rusciano et al., 2014). Em várias espécies de Bacillus e Clostridium, incluindo B. cereus, B. anthracis, B. megaterium, e C. difficile, a estrutura mais externa dos esporos é o exosporium, uma camada morfologicamente distinta composta de proteínas e glicoproteínas que envolve a pelagem (Díaz-González et al., 2015; Manetsberger et al, 2015b; Stewart, 2015).
O esporo bacteriano foi proposto como uma plataforma para exibir proteínas heterólogas, com aplicações potenciais que vão desde o desenvolvimento de vacinas de mucosas a biocatalisadores reutilizáveis, ferramentas de diagnóstico e dispositivos de biorremediação (Knecht et al., 2011; Isticato e Ricca, 2014; Ricca et al., 2014). A notável e bem documentada resistência do esporo (McKenney et al., 2012), a amenidade de várias espécies formadoras de esporos à manipulação genética (Harwood e Cutting, 1990) e o registro de segurança de várias espécies (Cutting, 2011; Baccigalupi et al., 2015) apóiam o uso do esporo como um sistema de exibição e entrega. Duas estratégias foram desenvolvidas para exibir proteínas heterólogas na superfície do esporo. Uma estratégia recombinante, baseada na construção de fusões de genes entre a codificação do DNA para uma proteína selecionada da superfície do esporo e a codificação do DNA para a proteína a ser exibida, tem sido usada ao longo dos anos para exibir uma variedade de proteínas heterólogas (Isticato e Ricca, 2014). Uma abordagem não recombinante, baseada na adsorção espontânea entre esporos purificados e proteínas purificadas, também tem sido usada para exibir várias enzimas e antígenos (Ricca et al., 2014). Os detalhes moleculares que controlam a adsorção de esporos não foram completamente elucidados. Sabe-se que a adsorção é mais eficiente quando o pH do tampão de ligação é ácido (pH 4) (Huang et al., 2010; Sirec et al., 2012) e que uma combinação de interações eletrostáticas e hidrofóbicas está provavelmente envolvida na interação (Huang et al., 2010; Sirec et al., 2012). Sabe-se também que esporos mutantes com superfícies de esporos gravemente alterados interagem de forma mais eficiente do que esporos do tipo selvagem isogênico com proteínas modelo (Sirec et al., 2012; Donadio et al.., 2016).
Aqui, usamos uma proteína fluorescente, a forma monomérica da Proteína Fluorescente Vermelha (mRFP) do Coral Discosoma sp. (Campbell et al., 2002), para avaliar se esporos de B. megaterium são capazes de interagir e adsorver uma proteína heteróloga modelo. B. megaterium compreende um número de cepas morfologicamente distintas que compartilham as grandes dimensões incomuns de ambas as células (comprimento até 4 μm e diâmetro de 1,5 μm) e esporos (comprimento até 3 μm e diâmetro de 1 μm) (Di Luccia et al., 2016). Esporos de algumas cepas de B. megaterium são cercados por um exosporium, e como até agora apenas esporos de espécies que não possuem um exosporium foram considerados como plataformas de adsorção, não há dados disponíveis sobre o impacto do exosporium na interação com proteínas heterólogas.
A cepa QM B1551 é a mais bem caracterizada cepa de B. megaterium. Esta linhagem carrega cerca de 11% do seu genoma em sete plasmídeos indígenas (Rosso e Vary, 2005; Vary et al., 2007; Eppinger et al., 2011), dois dos quais – pBM500 e pBM600 – foram identificados como portadores de genes essenciais para a formação do distinto exosporium “em forma de noz” desta linhagem (Manetsberger et al., 2015a). A composição proteica do QM B1551 exosporium é ainda pouco caracterizada, com apenas alguns poucos genes codificando ortologs de proteína exosporium reconhecidos em esporos de outras espécies sendo identificados por análises genômicas. Estes incluem genes que codificam as proteínas BclA nap, que formam uma sesta localizada em esporos de B. megaterium QM B1551, mais um ortograma da proteína BxpB que forma a camada basal do exosporium em esporos da família B. cereus. Este último parece cumprir um papel diferente nos esporos de B. megaterium QM B1551, uma vez que uma cepa mutante nula reteve um exosporium aparentemente normal (Manetsberger et al.., 2015a).
Neste trabalho, apresentamos dados que demonstram que esporos de B. megaterium QM B1551 podem adsorver eficientemente o mRFP, e fornecem evidências de que moléculas de proteína são capazes de atravessar a barreira de permeabilidade apresentada pelo exosporium para se localizar no espaço entre camadas.
Materiais e Métodos
Estirpes bacterianas, esporos e produção de RFP
As cepas de B. megaterium empregadas neste estudo são QM B1551 e sua derivada sem plasmídeo PV361 (Rosso e Vary, 2005). A cepa B. subtilis utilizada neste estudo foi PY79 (Youngman et al., 1984). A esporulação de todas as cepas de Bacillus foi induzida pelo método de exaustão (Cutting e Vander Horn, 1990). Após 30 h de crescimento em meio Difco Sporulation (DS) a 37°C com esporos vigorosos de agitação foram coletados e purificados como descrito por Nicholson e Setlow (1990) usando incubação noturna em H2O a 4°C para lise das células esporângeas residuais. O número de esporos purificados obtidos foi medido por contagem direta com uma câmara Bürker sob um microscópio óptico (Olympus BH-2 com lente 40×).
Para produção de mRFP, as células da Escherichia coli cepa RH161 (Donadio et al.., 2016), portadoras do vector de expressão pRSET-A, portadoras de uma fusão no final da região de codificação rfp 5′ a seis códones de histidina sob o controlo transcripcional de um promotor T7, foram cultivadas durante 18 h a 37°C em 100 ml de meio de auto-indução para expressar a proteína heteróloga (Isticato et al., 2010). A proteína RFP His6-tagged foi purificada sob condições nativas usando uma coluna His-Trap, como recomendado pelo fabricante (GE Healthcare Life Science). A proteína purificada foi dessalgada usando uma coluna PD10 (GE Healthcare Life Science) para remover altas concentrações de NaCl e imidazol.
Reação de adsorção
Sem outra especificação 5 μg de mRFP recombinante purificado foi adicionado a uma suspensão de esporos (5 × 108) em 50 mM Citrato de sódio pH 4,0 a 25°C em um volume final de 200 μl. Após 1 h de incubação, a mistura de ligação foi centrifugada (10 min a 13.000 g) para fracionar os esporos ligados mRFP no sedimento a partir de mRFP livre no sobrenadante.
Análise ocidental e Dot-Blot
Os esporos das reações de adsorção foram ressuspensos em 40 μl de tampão de extração de esporos (Nicholson e Setlow, 1990; Giglio et al, 2011), incubados a 68°C durante 1 h para solubilizar as proteínas do revestimento do esporo e carregados num gel de SDS-PAGE a 12%. As proteínas foram então eletrotransferidas para filtros de nitrocelulose (Amersham Pharmacia Biotech) e utilizadas para análise de Western blot como previamente relatado (Isticato et al., 2008) utilizando o anticorpo monoclonal mRFP-reconhecendo o seu anticorpo (Sigma). Uma determinação quantitativa da quantidade de mRFP foi obtida por experimentos com ponto blot comparando diluições em série de mRFP purificado e sobrenadante do ensaio de ligação. Os filtros foram então visualizados pelo método ECL-prime (Amersham Pharmacia Biotech) e submetidos a análise densitométrica pelo Software de Análise Quantity One 1-D (Bio-Rad). As análises densitométricas de pontos e relativas foram realizadas três vezes para verificar a significância dos resultados.
Microscopia de Fluorescência e Imunofluorescência
Esporos de pósadsorção foram ressuspendidos em 50 μl de 1x PBS pH 4,0 e 5 μl da suspensão colocada em lâminas de microscópio e coberta com uma lamela previamente tratada durante 30 s com poli-L-lisina (Sigma). A imunofluorescência foi realizada como descrito por Isticato et al. (2013), com as seguintes modificações: 2,0 × 106 esporos de RFP-adsorção de QM B1551 e PV361 B. As cepas de megatério foram pré-tratadas com 1% de albumina de soro bovino (BSA) – 1x PBS pH 4,0 por 30 min antes de 2 h de incubação a 4°C com os anticorpos antipoliHistidina (rato; Sigma) diluídos 1:20 em 1x PBS pH 4,0-1% BSA. Como controle da especificidade desta técnica, os esporos não-adsorventes foram tratados diretamente com os anticorpos anti-Histidina. Após três lavagens, as amostras foram incubadas com um anticorpo secundário anti-rato diluído 64 vezes conjugado com isotiocianato de fluoresceína, FITC (Santa Cruz Biotechnology, Inc.) e lavadas quatro vezes com 1x PBS pH 4,0. As amostras lavadas foram ressuspendidas em 20 μl de 1x PBS pH 4,0 e 10 μl foram analisadas. Todas as amostras foram observadas com um microscópio de fluorescência Olympus BX51 equipado com uma objectiva de óleo 100× UPlan F1; foram utilizados filtros cubos U-MNG ou U-MWIBBP para detectar a emissão de fluorescência vermelha de mRFP ou a emissão verde de anticorpos conjugados com FITC, respectivamente. Os tempos de exposição situaram-se entre os 200 e 3000 ms. As imagens foram capturadas utilizando uma câmara digital Olympus DP70 e processadas com o Software de Análise de Imagens (Olympus) para pequenos ajustes de brilho, contraste e equilíbrio de cores (McCloy et al., 2014). O ImageJ (v1.48, NIH) foi utilizado para desenhar um contorno em torno de 80 esporos para cada estirpe e foram registados valores mínimos, máximos e médios de fluorescência por pixel para cada esporo. Os valores de intensidade de fluorescência foram exibidos posteriormente como box-plots com intervalos de confiança de 5-95% (McCloy et al., 2014).
Análise estatística
Resultados da análise por microscopia de pontos e fluorescência são as médias de três experimentos independentes. A significância estatística foi determinada pelo teste t de Student, e o nível de significância foi estabelecido em P < 0.05.
Resultados
mRFP de Discosoma sp. é Adsorbed por B. megaterium Spores
Para verificar se os esporos de B. megaterium QM B1551 foram capazes de adsorver mRFP, 5 μg da proteína purificada (Materiais e Métodos) foram incubados com 5,0 × 108 esporos purificados. A reação de adsorção foi realizada em citrato de sódio 50 mM a pH 4,0, como descrito anteriormente (Sirec et al., 2012). Após a reação, os esporos foram amplamente lavados com 1x PBS pH 4,0, as proteínas da superfície dos esporos foram extraídas como descrito em Materiais e Métodos e analisadas por mancha ocidental com anticorpo antipoliHistidina-Peroxidase (Sigma), que reconhece o terminal N de histidina-tagged N do mRFP. Como mostrado na Figura 1A, o mRFP foi extraído de esporos, indicando que ele foi absorvido durante a reação e depois liberado pelo tratamento de extração. Para avaliar a eficiência da adsorção, analisamos a quantidade de mRFP deixada sem restrições, ou seja, os esporos pós-adsorção foram coletados por centrifugação e o sobrenadante diluído em série e analisado por ponto blotting (Figura 1B). Uma análise densitométrica do ponto blot (Tabela Complementar 1) mostrou que quando 5 μg do mRFP foi usado na reação de adsorção menos de 1% foi deixado sem restrições, indicando que cerca de 99% da proteína heteróloga foi adsorvida a esporos de B. megaterium.

FIGURA 1. Bacillus megaterium QM B1551 esporos adsorb mRFP. 5 × 108 esporos foram incubados com 5 μg de mRFP purificado e, em seguida, as amostras sujeitas a centrifugação. (A) As proteínas da superfície dos esporos foram extraídas da fração pellet pelo tratamento SDS-DTT, fracionadas em SDS-PAGE e analisadas por Western blot. O mRFP purificado (20 μg) foi utilizado como marcador. (B) O sobrenadante, contendo o mRFP não ligado, foi diluído em série e analisado por ponto blot (QM B1551). Diluições em série de mRFP purificado (mRFP) foram utilizadas como padrão. (C) Os esporos adsorvidos com mRFP foram lavados duas vezes (W1 e W2) com tampão PBS a pH 3,0 ou pH 7,0, ou com uma solução de NaCl 1M, 0,1% de Triton X-100. Foram utilizadas como padrão diluições em série de mRFP purificado e mRFP não ligado (UN-mRFP). Imuno-reações em todos os painéis foram realizadas com mRFP-reconhecendo o anticorpo anti-His conjugado com peroxidase de rábano silvestre.
Para analisar se as moléculas de mRFP adsorvidas estavam firmemente ligadas à superfície do esporo, esporos de reação pós-adsorção foram lavados duas vezes com tampão PBS a pH 3,0 ou pH 7,0, ou com uma solução de NaCl 1M, 0,1% de Triton X-100, como descrito anteriormente (Donadio et al., 2016). Como mostrado na Figura 1C, e apoiado pela análise densitométrica do ponto blot (Tabela Complementar 2), as lavagens a pH 3,0 não causaram nenhuma liberação da mRFP adsorvida, enquanto as lavagens a pH 7,0 ou com NaCl 1M, 0,1% de Triton X-100 causaram uma liberação mínima, inferior a 1%, de moléculas de mRFP. Portanto, os resultados apresentados na Figura 1 sugerem que a mRFP foi adsorvida eficientemente e fortemente ligada a esporos de B. megaterium. Para avaliar se as moléculas de mRFP esporadicamente adsorvidas mantiveram suas propriedades fluorescentes, realizamos uma análise microscópica de fluorescência. Como mostrado na Figura 2, esporos de reação pós-adsorção foram associados a um forte sinal de fluorescência visível em toda a superfície do esporo.
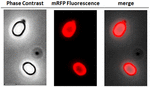
FIGURA 2. Análise microscópica de fluorescência de esporos de B. megaterium QM B1551-mRFP. Os esporos de QM B1551 incubados com mRFP (5 μg), e posteriormente lavados, foram analisados por microscopia de fluorescência. O mesmo campo microscópico foi observado por contraste de fase e microscopia de fluorescência. Barra de escala 1 μm. O painel de fusão é relatado. O tempo de exposição foi de 200 ms.
O Exosporium tem um Papel Essencial na adsorção mRFP
Estirpe QM B1551 de B. megaterium contém sete plasmídeos indígenas (Rosso e Vary, 2005; Eppinger et al., 2011) e genes codificados com plasmídeos são essenciais para a formação do exosporium (Manetsberger et al., 2015a). PV361 é uma estirpe QM B1551-cured sem todos os sete plasmídeos e, como consequência, totalmente sem o exosporium (Manetsberger et al., 2015a). Usamos esporos da estirpe PV361 para analisar o papel do exosporio na adsorção de mRFP. Em paralelo, também utilizamos esporos de B. subtilis PY79 que num estudo anterior foram mostrados para adsorver mRFP (Donadio et al., 2016). Para comparar a eficiência de adsorção dos esporos das cepas B. subtilis PY79 e B. megaterium QM B1551 e PV361, adsorvemos 5 μg de mRFP purificado com 5,0 × 108 esporos de cada uma das três cepas. Após as reações de adsorção, os esporos foram coletados por centrifugação, proteínas extraídas pelo tratamento SDS-DTT e analisadas por mancha ocidental com mRFP-reconhecendo o seu anticorpo anti-His. Como mostrado na Figura 3A, o mRFP foi aparentemente extraído em maiores quantidades de esporos de QM B1551 do que de esporos das outras duas cepas. Em uma tentativa de quantificar essas diferenças aparentes, o mRFP não ligado das reações de adsorção foi diluído em série e analisado por meio de ponto blotting (Figura 3B). Uma análise densitométrica do ponto blot da Figura 3B (Tabela Complementar 3) indicou que os esporos PY79 e PV361 adsorveram cerca de 90% do total de mRFP enquanto os esporos QM B1551 adsorveram quase todos (mais de 99%) mRFP purificados.
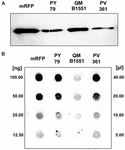
FIGURA 3. Monomeric Red Fluorescent Protein adsorption to spores of B. megaterium QM B1551 and PV361 and B. subtilis PY79. 5 × 108 esporos de cada estirpe foram incubados com 5 μg de mRFP purificado e, em seguida, as amostras sujeitas a centrifugação. Os esporos nas frações de pelotas foram utilizados para extrair proteínas de superfície que foram posteriormente analisadas por Western blot (A), enquanto os sobrenadantes foram diluídos em série e analisados por ponto blot (B). Diluições seriadas de mRFP purificado foram usadas como padrões. Imuno-reações em ambos os painéis foram realizadas com anticorpos anti-His conjugados com peroxidase de rábano silvestre.
A eficiência de adsorção dos esporos das três cepas também foi analisada por microscopia de fluorescência (Figura 4A e Figura Suplementar S1). As imagens microscópicas foram analisadas pelo software ImageJ (v1.48, NIH) para realizar a análise quantitativa das imagens fluorescentes e a fluorescência dos esporos foi calculada conforme descrito em Materiais e Métodos. A análise de 80 esporos de cada estirpe indicou um valor médio de fluorescência por pixel de 52,43 (± 5,94), 20,81 (± 2,71), e 32,33 (± 2).97; unidades arbitrárias) para QM B1551, PV361 e PY79, respectivamente (Figura 4B), conferindo mais evidências de que os esporos de QM B1551 adsorveram mais mRFP do que os esporos das outras duas cepas.
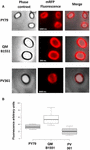
FIGURA 4. Eficiência de adsorção do mRFP para esporos de B. megaterium QM B1551 e PV361 e B. subtilis PY79. (A) Imagens de microscopia de fluorescência de esporos de PY79, QM B1551 e PV361 após adsorção e lavagem do mRFP. Os tempos de exposição são indicados. São mostradas as sobreposições de fase de contraste e fluorescência vermelha (painel de fusão). Barras de escala 1 μm. (B) Lotes de caixas exibindo a intensidade de fluorescência de oitenta esporos diferentes de cada estirpe. Os limites de cada caixa representam o primeiro e o terceiro quartil (25 e 75%) e os valores fora das caixas representam os valores máximo e mínimo. A linha que divide a caixa indica o valor da mediana para cada estirpe. O valor de P é inferior a 0,0001,
Baseado nos resultados das Figuras 3 e 4, concluímos que o exosporium, presente na QM B1551 e ausente na PV361 tem um papel relevante na adsorção do mRFP.
Avaliação quantitativa da adsorção de mRFP para esporos QM B1551
Experimentos com mRFP puro (Figura 3B) indicou que quando 5 μg de mRFP purificado foi usado em reações de adsorção com 5,0 × 108 esporos da cepa QM B1551 quase todas as proteínas heterólogas foram ligadas ao esporo. A fim de definir a quantidade máxima de mRFP que pode ser adsorvida aos esporos QM B1551, repetimos as reações com concentrações crescentes de mRFP purificado, ou seja, 5,0 × 108 QM B1551 esporos foram reagidos com 5, 10, 20, 40, 80, e 160 μg de mRFP purificado. Após as reações os esporos foram coletados por centrifugação e os sobrenadantes contendo mRFP não ligado foram diluídos em série e analisados por ponto blotting (Figura 5A). A Figura 5B mostra os resultados de uma análise densitométrica do ponto blot (???), que indica que quando 5-80 μg de mRFP foi reagido com 5 × 108 esporos, a percentagem de proteína ligada a esporos era superior a 90%. Uma diminuição do mRFP ligado foi observada quando 160 μg de proteína purificada foram utilizados na reação. No entanto, mesmo quando 160 μg de mRFP purificado foi utilizado mais de 60% da proteína foi absorvida, indicando que 5,0 × 108 esporos de QM B1551 podem adsorver cerca de 100 μg de mRFP.
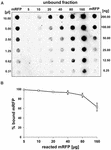
FIGURA 5. Avaliação quantitativa da adsorção de mRFP para esporos de B. megaterium QM B1551. 5 × 108 esporos foram incubados com 5, 10, 20, 40, 80, e 160 μg de mRFP purificado. As misturas de reação foram posteriormente submetidas à centrifugação e os sobrenadantes foram diluídos em série e analisados por ponto blot (A). Diluições seriadas de mRFP purificado foram utilizadas como padrão. Imuno-reações em ambos os painéis foram realizadas com anticorpos anti-His conjugados com peroxidase de rábano silvestre. (B) Porcentagem de mRFP adsorvida a esporos após reação com quantidades definidas de mRFP endógena. As barras de erro mostram os erros padrão da média de três experimentos e o valor de P nunca acima de 0,0025.
mRFP Localiza-se para o Espaço Inter-Coat em B. megaterium QM B1551 Esporos
Uma abordagem de microscopia de imunofluorescência foi empregada para avaliar se as moléculas mRFP adsorvidas foram expostas na superfície de esporos de B. megaterium QM B1551. Os esporos de QM B1551 adsorvidos com várias quantidades de mRFP foram reagidos com anticorpo monoclonal anti-His reconhecendo o mRFP recombinante, depois com anticorpo secundário anti-rato fluorescente (Santa Cruz Biotechnology, Inc.) e observados sob o microscópio de fluorescência (Figura 6). Com a menor quantidade de mRFP utilizada neste experimento (2 μg) o sinal de fluorescência mRFP (vermelho) foi observado ao redor do esporo enquanto o sinal de imunofluorescência (verde) foi fraco e concentrado principalmente nos pólos do esporo, sugerindo que somente nesses pontos o mRFP foi exposto na superfície do esporo. Aumentando a quantidade de mRFP utilizada na reação o número de pontos verdes aumentou (5 e 10 μg) e com a maior quantidade de mRFP utilizada na reação (20 μg) um anel verde quase completo foi observado ao redor dos esporos. Com base nos resultados apresentados na Figura 6, nós supomos que moléculas de mRFP se infiltram através do exosporio e se localizam no espaço entre a camada externa e o exosporio, ou seja, quando uma baixa quantidade de mRFP é usada quase todas as moléculas proteicas são internas ao exosporio e estão disponíveis para o anticorpo em apenas alguns locais. Quantidades crescentes de mRFP em reações de adsorção resultam no espaço entre camadas “enchendo-se”, até que mais moléculas de mRFP estejam disponíveis para o anticorpo na superfície do esporo. Esta hipótese implica que se o exosporio estiver faltando, então todo o mRFP deve estar disponível para o anticorpo. Para testar isso, nós comparamos por microscopia de imunofluorescência números iguais de esporos de QM B1551 (com exosporium) e de PV361 (sem exosporium) incubados com a mesma quantidade de mRFP (5 μg). Quando o exosporium estava presente (QM B1551) o mRFP estava apenas parcialmente disponível para os anticorpos e foram observadas manchas verdes (Figura 7 e Figura Suplementar S2). Quando o exosporium não estava presente (PV361) adsorvido mRFP estava disponível para o anticorpo ao redor do esporo e um anel verde completo foi formado, suportando a hipótese de que o mRFP é interno ao exosporium em esporos QM B1551.
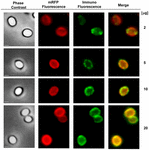
FIGURA 6. Análise de imunofluorescência de esporos mRFP-adsorvados B. megaterium QM B1551. Alíquotas de 5 × 108 esporos QM B1551 foram incubadas com concentrações variáveis de mRFP e foram posteriormente analisadas por contraste de fase, fluorescência e microscopia de imunofluorescência, conforme descrito nos Materiais e Métodos. O mesmo campo de microscopia para cada reação é relatado em conjunto com o painel de fusão. O tempo de exposição foi de 200 ms para todas as imagens. Barra de escala, 1 μm.
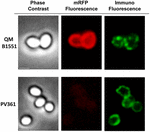
FIGURA 7. Imunofluorescência de mRFP adsorvida a esporos B. megaterium QM B1551 e PV361. 5 × 108 esporos QM B1551 e PV361 foram incubados com 5 μg mRFP e depois analisados por microscopia de imunofluorescência, conforme descrito nos Materiais e Métodos. Para cada fase de campo são mostrados contraste e microscopia de imunofluorescência. O tempo de exposição foi de 200 ms para todas as imagens. Barra de escala, 1 μm.
Apesar que os esporos QM B1551 usados nos experimentos da Figura 7 mostraram um anel fluorescente vermelho completo como na Figura 2, os esporos PV361 mostraram um sinal fluorescente vermelho muito fraco. Com esporos de PV361 um sinal vermelho só foi observado usando longos tempos de exposição no microscópio de fluorescência (Figura 4). Como o mRFP está presente em torno dos esporos do PV361 (Figuras 3 e 7), concluímos que a fluorescência do mRFP é enfraquecida quando a proteína é adsorvida aos esporos do PV361. Outras experiências serão necessárias para abordar completamente este ponto.
Discussão
Os principais achados deste relatório são que esporos de B. megaterium são extremamente eficientes na adsorção da proteína mRFP modelo heterólogo, que o exosporium tem um papel importante neste processo, e que moléculas mRFP se infiltram através do exosporium localizando-se entre a camada externa e o exosporium. Estes resultados expandem o trabalho anterior realizado em esporos de B. subtilis e demonstram que esporos de uma espécie diferente também podem ser usados para fornecer proteínas heterólogas através do método de adsorção. A alta eficiência de adsorção observada com esporos de B. megaterium deve-se em parte ao grande tamanho do seu esporo em comparação com o de B. subtilis. De fato, a superfície do esporo de B. megaterium é cerca de 2,5 vezes maior que o esporo de B. subtilis, com uma superfície de 5,33 μm2 (h: 1,60 ± 0,16 w: 0,84 ± 0,07) vs. 1,98 μm2 (h: 1,07 ± 0,09 w: 0,48 ± 0,03). As grandes dimensões permitem a adsorção de até 100 μg de mRFP quando 160 μg de proteína reagem com esporos.
A observação de que o mRFP cruza o exosporio indica que ele é permeável ao mRFP, uma proteína de 27 kDa. A permeabilidade do exosporium não é totalmente surpreendente já que os germinantes presentes no ambiente têm que cruzar as camadas externas do esporo para alcançar seus receptores, embora os germinantes sejam tipicamente pequenas moléculas com massas moleculares tipicamente <200 Da. Além disso, os dados do mRFP estão amplamente de acordo com os resultados de estudos anteriores realizados com dextrans rotulados e moléculas relacionadas (Koshikawa et al., 1984; Nishihara et al., 1989). Nesses estudos, o B. megaterium QM B1551 exosporium foi sugerido para representar uma barreira de permeabilidade a moléculas com pesos moleculares superiores a 100 KDa, enquanto influenciando a passagem de moléculas com massas entre 2 e 40 kDa (Koshikawa et al, 1984; Nishihara et al., 1989).
Um desafio interessante para o trabalho futuro será estabelecer o mecanismo ou rota de infiltração que o mRFP, e por inferência outras proteínas heterólogas de interesse, leva a entrar no espaço entre camadas. O exame por microscopia eletrônica de transmissão dos esporos de B. megaterium QM B1551 seccionados indica que o exosporio compreende duas “conchas” idênticas (Manetsberger et al., 2015a), e pode ser que a interface entre cada uma dessas estruturas (descrita como “aberturas apicais” nos primeiros trabalhos) permita a entrada de moléculas relativamente grandes. Discernindo a base para a perda aparente da fluorescência mRFP na adsorção aos esporos PV361, e se as moléculas mRFP são capazes de se infiltrar nas camadas externas do revestimento, como observado para B. subtilis spores (Donadio et al., 2016), também será de interesse.
No estudo atual, nós supomos que as moléculas mRFP cruzam preferencialmente o exosporium e se acumulam no espaço entre o revestimento externo e o exosporium. Neste modelo, as moléculas mRFP só são adsorvidas e exibidas na superfície do esporo uma vez que os locais de adsorção (ou capacidade volumétrica?) no espaço entre camadas estejam suficientemente ocupados. Isso implica que a abordagem de adsorção para exibição de superfície pode ser usada com esporos de B. megaterium QM B1551, embora o sistema seja dependente da relação esporo/proteína utilizada nas reações de adsorção. Desde que várias cepas de B. megaterium têm sido utilizadas industrialmente para a produção de enzimas como amilases e desidrogenases, vitaminas e moléculas antimicrobianas (Vary et al, 2007), os nossos dados sugerem uma nova aplicação biotecnológica para o esporo de B. megaterium como veículo de ligação e fornecimento de proteínas heterólogas.
Contribuições dos autores
ML e GD – realizaram a maioria dos experimentos; RA e AS – contribuíram para a interpretação dos dados para o trabalho; GiC, LB e GrC – contribuíram para a redação do trabalho e revisão crítica do mesmo; ER – contribuíram para discussões e sugestões durante o trabalho e contribuíram para a redação do manuscrito; RI – lideraram o trabalho e contribuíram para a redação do manuscrito. Todos os autores leram e aprovaram o manuscrito final.
Funding
Este trabalho foi apoiado por um subsídio (STAR Linea1- 2014) da Universidade Federico II de Nápoles e Compagnia di San Paolo, Itália para o RI.
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesses.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/article/10.3389/fmicb.2016.01752/full#supplementary-material
FIGURA S1 | Imagens de campo inteiras de análise por microscopia de fluorescência relatadas na Figura 4. O mesmo campo de microscopia foi observado por contraste de fase e microscopia de fluorescência. Barra de escalas 5 μm. O painel de fusão é relatado. O tempo de exposição é indicado.
FIGURA S2 | Imagens de campo inteiro de análise de imunofluorescência relatadas na Figura 7. O mesmo campo de microscopia foi observado por contraste de fase e microscopia de fluorescência. Barra de escalas 5 μm. O tempo de exposição foi de 200 ms para todas as imagens.
TABLE S1 | Análise densitométrica de experimentos de ponto blot com os sobrenadantes da reação de adsorção com esporos QM B1551 (Figura 1B).
TABLE S2 | Análise densitométrica de experimentos de ponto blot com os sobrenadantes de várias lavagens após a reação de adsorção (Figura 1C).
TABLE S3 | Análise densitométrica de experimentos de ponto blot com os sobrenadantes da reação de adsorção realizada com esporos de cepas PY79, QM B1551, e PV361 (Figura 3B).
TABLE S4 | Análise densitométrica de experimentos com os sobrenadantes da reação de adsorção realizada com diferentes quantidades de mRFP.
Baccigalupi, L., Ricca, E., e Ghelardi, E. (2015). “Probióticos não-LAB: Formadores de esporos”, em Probióticos e Prebióticos: Current Research and Future Trends, eds K. Venema e A. P. do Carmo (Norfolk, VA: Caister Academic Press), 93-103. doi: 10.21775/9781910190098.06
CrossRef Full Text | Google Scholar
Campbell, R. E., Tour, O., Palmer, A. E., Steinbach, P. A., Baird, G. S., Zacharias, D. A., et al. (2002). Uma proteína vermelha fluorescente monomérica. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882. doi: 10.1073/pnas.082243699
PubMed Abstract | CrossRef Full Text | Google Scholar
Cangiano, G., Sirec, T., Panarella, C., Isticato, R., Baccigalupi, L., De Felice, M., et al. (2014). Os produtos do gene sps afetam a germinação, a hidrofobicidade e a adsorção proteica dos esporos de Bacillus subtilis. Aplic. Ambiente. O Microbiol. 80, 7293-7302. doi: 10.1128/AEM.02893-14
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S. M. (2011). Bacillus probiotics. Microbiol alimentar. 28, 214-220. doi: 10.1016/j.fm.2010.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S., e Vander Horn, P. B. (1990). “Genetic Analysis”, em Molecular Biological Methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 27-74.
Google Scholar
Díaz-González, F.., Milano, M., Olguin-Araneda, V., Pizarro-Cerda, J., Castro-Córdova, P., Tzeng, S. C., et al. (2015). Composição proteica da camada exosporiana mais externa de Clostridium difficile 630 esporos. J. Proteom. 123, 1-13. doi: 10.1016/j.jprot.2015.03.035
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Luccia, B., D’Apuzzo, E., Varriale, F., Baccigalupi, L., Ricca, E., e Pollice, A. (2016). Bacillus megaterium SF185 induz vias de estresse e afeta a distribuição do ciclo celular das células epiteliais do intestino humano. Benefício. Microb. 7, 609-620. doi: 10.3920/BM2016.0020
PubMed Abstract | CrossRef Full Text | Google Scholar
Donadio, G., Lanzilli, M., Sirec, T., Ricca, E., e Isticato, R. (2016) Adsorção de proteínas e localização em esporos de Bacillus subtilis do tipo selvagem e mutantes. Microb. Fato Celular. 15:153. doi: 10.1186/s12934-016-0551-2
PubMed Abstract | CrossRef Full Text
Eppinger, M., Bunk, B., Johns, M. A., Edirisinghe, J. N., Kutumbaka, K. K., Koenig, S. S., et al. (2011). Seqüências genômicas das cepas biotecnologicamente importantes do Bacillus megaterium QM B1551 e DSM319. J. Bacteriol. 193, 4199-4213. doi: 10.1128/JB.00449-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Giglio, R., Fani, R., Isticato, R., De Felice, M., Ricca, E., e Baccigalupi, L. (2011). Organização e evolução dos genes cotG e cotH do Bacillus subtilis. J. Bacteriol. 193, 6664-6673. doi: 10.1128/jb.06121-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Harwood, C. R., and Cutting, S. M. (1990). Métodos Biológicos Moleculares para Bacillus. Chichester: John Wiley and Sons.
Google Scholar
Huang, J. M., Hong, H. A., Van Tong, H., Hoang, T. H., Brisson, A., and Cutting, S. M. (2010). Entrega Mucosal de antígenos usando adsorção a esporos bacterianos. Vacina 28, 1021-1030. doi: 10.1016/j.vaccine.2009.10.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., De Felice, M., e Ricca, E. (2010). CotE liga-se a CotC e CotU e medeia a sua interacção durante a formação de esporos em Bacillus subtilis. J. Bacteriol. 192, 949-954. doi: 10.1128/JB.01408-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., Zilhão, R., Baccigalupi, L., Henriques, A. O., De Felice, M., et al. (2008). Heterodimerização CotC-CotU durante a montagem do revestimento do Bacillus subtilis spore coat. J. Bacteriol. 190, 1267-1275. doi: 10.1128/JB.01425-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., and Ricca, E. (2014). Apresentação da superfície dos esporos. Microbiol. Spectr. 2, 351-366. doi: 10.1128/microbiolspec.TBS-0011-2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Sirec, T., Treppiccione, L., Maurano, F., De Felice, M., Rossi, M., et al. (2013). Exibição não-recombinante da subunidade B da toxina labial do calor da Escherichia coli em esporos de Bacillus subtilis do tipo selvagem e mutante. Microb. Fato Celular. 12:98. doi: 10.1186/1475-2859-12-98
PubMed Abstract | CrossRef Full Text | Google Scholar
Knecht, L. D., Pasini, P., e Daunert, S. (2011). Esporos bacterianos como plataformas para aplicações bioanalíticas e biomédicas. Anal. Bioanal. Química. 400, 977-989. doi: 10.1007/s00216-011-4835-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Koshikawa, T., Beaman, T. C., Pankratz, H. S., Nakashio, S., Corner, T. R., e Gerhardt, P. (1984). Resistência, germinação e permeabilidade correlatas de esporos de Bacillus megaterium despojados sucessivamente de camadas de tegumento. J. Bacteriol. 159, 624-632.
PubMed Abstract | Google Scholar
Manetsberger, J., Hall, E. A. H., e Christie, G. (2015a). Os genes codificados por plasmídeos influenciam a montagem e morfologia do exosporio no Bacillus megaterium QM B1551 esporos. FEMS Microbiol. Lett. 362:fnv147. doi: 10.1093/femsle/fnv147
PubMed Abstract | CrossRef Full Text | Google Scholar
Manetsberger, J., Manton, J. D., Erdelyi, M. J., Lin, H., Rees, D., Christie, G., et al. (2015b). A microscopia de localização de elipsóides infere o tamanho e a ordem das camadas de proteínas nas camadas de esporos de Bacillus. Biofísicos. J. 109, 2058-2066. doi: 10.1016/j.bpj.2015.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
McCloy, R., Rogers, S., Caldon, E., Lorca, T., Castro, A., e Burgess, A. (2014). A inibição parcial do Cdk1 na fase G2 substitui o SAC e desacopla eventos mitóticos. Cell Cycle 13, 1400-1412. doi: 10.4161/cc.28401
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenney, P. T., Driks, A., e Eichemberger, P. (2012). O Bacillus subtilis endospore: montagem e funções do revestimento multicamadas. Nat. Rev. Microbiol. 11, 33-44. doi: 10.1038/nrmicro2921
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicholson, W. L., e Setlow, P. (1990). “Sporulation, germination and out-growth,” em Molecular biological methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 391-450.
Google Scholar
Nishihara, T., Takubo, Y., Kawamata, E., Koshikawa, T., Ogaki, J., e Kondo, M. (1989). Papel do revestimento externo na resistência do esporo de Bacillus megaterium. J. Biochem. 106, 270-273.
PubMed Abstract | Google Scholar
Pesce, G., Rusciano, G., Sirec, T., Isticato, R., Sasso, A., e Ricca, E. (2014). Medições de carga superficial e coeficiente hidrodinâmico do esporão de Bacillus subtilis por pinças ópticas. Colóides Surf. B Biointerfaces 116C, 568-575. doi: 10.1016/j.colsurfb.2014.01.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., e Isticato, R. (2014). Entrega da vacina Mucosal por esporos não recombinantes de Bacillus subtilis. Microb. Fato Celular. 13, 115. doi: 10.1186/s12934-014-0115-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosso, M. L., e Vary, P. S. (2005). Distribuição de Bacillus megaterium QM B1551 plasmídeos entre outras linhagens de B. megaterium e espécies de Bacillus. Plasmid 53, 205-217. doi: 10.1016/j.plasmid.2004.10.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rusciano, G. Zito, G., Isticato, R., Sirec, T., Ricca, E., Bailo, E., e Sasso, A. (2014). Imagens químicas em nanoescala de esporos de Bacillus subtilis, combinando a dispersão Raman com ponta aprimorada e ferramentas estatísticas avançadas. ACS Nano 8, 12300-12309. doi: 10.1021/nn504595k
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirec, T., Strazzulli, A., Isticato, R., De Felice, M., Moracci, M., e Ricca, E. (2012). Adsorção de beta-galactosidase de Alicyclobacillus acidocaldarius em esporos do tipo selvagem e mutantes de Bacillus subtilis. Microb. Fato Celular. 11:100. doi: 10.1186/1475-2859-11-100
PubMed Abstract | CrossRef Full Text | Google Scholar
Stewart, G. C. (2015). A camada Exosporium de esporos bacterianos: uma conexão com o ambiente e o hospedeiro infectado. Microbiol. Mol. Biol. Rev. 79, 437-457. doi: 10.1128/MMBR.00050-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Vary, P. S., Biedendieck, R., Fuerch, T., Meinhardt, F., Rohde, M., Deckwer, W. -D., et al. (2007). Bacillus megaterium – de simples bactéria do solo a hospedeiro de produção de proteína industrial. Aplic. Microbiol. Biotecnol. 76, 957-967 doi: 10.1007/s00253-007-1089-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Youngman, P., Perkins, J. B., and Losick, R. (1984). Um novo método para a clonagem rápida em Escherichia coli de Bacillus subtilis ADN cromossómico adjacente à inserção de Tn917. Mol. Gen. Genet. 195, 424-433. doi: 10.1007/BF00341443
CrossRef Full Text | Google Scholar