Introdução
Meningiomas são a neoplasia mais comum do sistema nervoso central (SNC) e representam mais de 37% de todos os tumores cerebrais primários (1). As opções de tratamento dos meningiomas incluem observação, cirurgia e radioterapia (2, 3). Enquanto uma minoria de meningiomas é agressiva, incluindo os graus II e III da Organização Mundial de Saúde (OMS), mais de 80% são de grau I da OMS, e freqüentemente chamados de “benignos” (4). No entanto, mesmo os meningiomas de grau I da OMS podem ser recorrentes, com estudos anteriores destacando uma taxa de recorrência de até 47% com acompanhamento a longo prazo (4, 5). A recidiva do meningioma freqüentemente necessita de tratamento com cirurgia adicional ou radioterapia de resgate, levando à morbidade potencial (6, 7). Como resultado, a capacidade de prever a recorrência é um componente crucial do manejo do meningioma grau I da OMS para fazer recomendações sobre a freqüência de imagens de vigilância ou o uso de radioterapia adjuvante.
Além do grau Simpson alcançado na ressecção, várias características tumorais foram avaliadas como possíveis preditores de recorrência, com foco nos achados histopatológicos (8). Estes incluem o índice MIB-1 (um marcador de proliferação celular), invasão cerebral e a presença de características histológicas atípicas, incluindo aumento da celularidade, lençóis, focos de necrose espontânea e atipia nuclear (9-13). De fato, as classificações de 2016 da OMS usam exclusivamente achados patológicos para determinar o grau de tumor com grau II definido pela invasão cerebral e aumento da mitose em 4/10 de campo de alta potência (HPF) (4). Além disso, três características atípicas juntas resultam em um aumento do grau do tumor (4). Olhando para o futuro, as características moleculares do meningioma foram recentemente associadas ao risco de recorrência, e provavelmente serão usadas no futuro na classificação do meningioma (14-16).
Embora as classificações da OMS sintetizem a literatura disponível para criar delineadores claros entre os graus tumorais, a literatura em torno da recorrência do meningioma grau I da OMS permanece mista. Por exemplo, enquanto a invasão cerebral sozinha pode resultar em um aumento do grau de tumor de grau I-II da OMS, vários estudos subsequentes não encontraram uma relação entre invasão cerebral e recidiva, destacando a necessidade de pesquisas adicionais sobre preditores de recidiva (10, 17, 18). A utilidade do índice MIB-1 na predição de recorrência de meningioma também é controversa; um estudo nos meningiomas grau I da OMS apenas sugeriu um maior risco de recorrência com um índice MIB-1 de >3%, mas outra literatura, incluindo todos os graus da OMS, demonstrou uma maior incidência de recorrência de >5% ou >10% (9-11). Estudos anteriores também propuseram um corte na MIB-1 de >3% apenas em pacientes com ressecção Simpson II ou III, demonstrando ainda mais a variedade de cortes na MIB-1 e seu uso (13). Em comparação, um número limitado de estudos investigou o impacto de características atípicas na recorrência do meningioma grau I da OMS; embora tenham sugerido um maior risco de recorrência em tumores grau I da OMS com características atípicas na análise patológica (9).
Pelas razões expostas, o objetivo deste estudo foi investigar preditores clínicos, radiográficos e patológicos de recorrência em meningiomas grau I da OMS. Dada a falta de consenso sobre o uso da MIB-1 nos meningiomas de grau I da OMS, também utilizamos a análise de partição recursiva para identificar um corte clinicamente relevante para o índice MIB-1. Identificamos então os preditores de recorrência precoce e pós-mediana em tumores de grau I da OMS.
Métodos
População Paciente
Patientes que se submeteram a tratamento para um meningioma de grau I da OMS de 2007 a 2017 foram identificados retrospectivamente usando um banco de dados institucional. Este estudo foi formalmente aprovado pela University of California, San Francisco Institutional Review Board (IRB#13-12587). Foram excluídos pacientes sem valores do índice MIB-1 disponíveis no prontuário eletrônico. No início do período do estudo, o MIB-1 foi obtido a critério do neuropatologista assistente, mas, com o passar do tempo, o MIB-1 foi obtido em todos os pacientes com meningioma grau I da OMS.
Dados clínicos
Dados demográficos, características clínicas e de tratamento da paciente, dados histopatológicos e resultados clínicos foram revistos e coletados retrospectivamente. Os dados clínicos coletados incluíram idade do paciente, sexo, estado de desempenho de Karnofsky (KPS) no tratamento, apresentação clínica e história prévia de tratamento do meningioma. Os dados histopatológicos incluíram índice MIB-1, folha/perda de arquitetura, aumento da celularidade, necrose, atipia nuclear e a presença de invasão óssea. Os resultados da coloração dos receptores de progesterona (PR), antígeno epitelial da membrana (EMA), CD34, S100, fibrilária glial e proteína ácida (GFAP) foram coletados quando disponíveis. Os dados patológicos foram extraídos do relatório de patologia gerado no momento da intervenção cirúrgica. A localização do tumor, tamanho e presença de edema peritumoral pré-operatório foram determinados por meio de ressonância magnética pré-operatória. Diâmetros ântero-posterior (PA), superior-inferior (SI) e transverso (TV) foram coletados. O volume tumoral pré-operatório foi calculado utilizando a equação para o volume tumoral não esférico. O tipo de tratamento foi coletado de forma semelhante. O grau Simpson foi determinado através do laudo operatório. O total bruto (GTR) e a ressecção subtotal (STR) foram determinados usando ressonância magnética (RM) pós-operatória.
Os resultados primários de interesse foram recidiva tumoral e tempo para recidiva. A recidiva foi determinada na radiografia pós-operatória como recidiva local ou progressão do tumor residual. O tempo para recidiva foi determinado a partir da data de tratamento do paciente. O tempo de seguimento foi calculado desde a data do tratamento até a última consulta com a clínica de neurocirurgia. Os resultados secundários incluíram a recidiva precoce e pós-medicina. A recidiva precoce foi definida como dentro de 2 anos após o tratamento inicial (19). A recidiva pós-mediana foi definida como ocorrendo >2 anos após o tratamento inicial.
Análise estatística
Teste t de Student e Qui-quadrado foram utilizados para a comparação de variáveis categóricas e contínuas, respectivamente. Um modelo de regressão de Cox de probabilidade multivariada para recidiva foi construído usando variáveis com p < 0,200 na análise univariada. Da mesma forma, modelos de logística binária multivariada de probabilidade para trás foram construídos para prever a recorrência precoce e pós-mediana usando variáveis com p < 0,200 na análise univariada. A análise de partição recursiva (RPA) foi utilizada para identificar os principais fatores de risco de recorrência de meningioma global, precoce e pós-mediana. Um p < 0,050 foi usado como um limiar de significância estatística. Todas as análises estatísticas foram realizadas com SPSS 26,
Resultados
Demografia e resultados clínicos de todos os pacientes
Demografia, características histopatológicas e resultados clínicos de todos os pacientes podem ser vistos na Tabela 1. No total, 239 pacientes com meningiomas de grau I da OMS foram incluídos no estudo. A média de idade foi de 60,0 anos, sendo 69,5% dos pacientes do sexo feminino. O sintoma mais comum foi dor de cabeça (30,5%), seguido por um déficit neurológico focal (27,6%). A maioria dos pacientes foi submetida à cirurgia isoladamente (98,3%), com 2 pacientes cada um recebendo tratamento com radioterapia adjuvante (0,8%) ou faca gama (0,8%). O edema peritumoral esteve presente na RM pré-operatória de 38,1% dos pacientes. O volume tumoral médio calculado foi de 30,6 cm3 (variação = 0,23-215,73 cm3), e a maior dimensão tumoral média foi de 3,8 cm (variação = 0,6-11,3 cm). No total, 91 (38,1%) tumores estavam localizados na base do crânio, 57 (23,8%) eram tumores de convexidade, 43 (18,0%) tinham uma localização falx/parasagital e 55 (23,0%) tinham outra localização. A maioria dos pacientes recebeu uma ressecção total bruta (63,6%). A incidência das ressecções Simpson I, II, III e IV foi de 31,4, 29,7, 2,5 e 35,6%, respectivamente. Os traços atípicos mais comuns foram a invasão óssea (18,0%) e a perda de arquitetura (8,4%). O seguimento médio foi de 41,1 meses (variação: 0-147 meses).
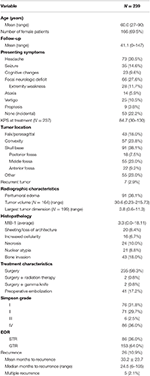
Tábua 1. Características dos pacientes, características histopatológicas, radiografia e resultados.
Preditores de Meningioma de Grau I da OMS Recorrência
Um total de 26 pacientes recorreram com tempo médio de recidiva de 24,5 meses (Tabela 1). Uma comparação entre os pacientes com recidiva e os sem recidiva pode ser encontrada na Tabela 2. Não houve diferença na idade (60,2 vs. 58,8, p = 0,582) ou sexo feminino (61,5 vs. 70,4%, p = 0,353) entre pacientes com tumores que recidivaram e pacientes não recidivantes. As características de tratamento foram semelhantes entre os grupos, com a maioria dos pacientes de cada grupo recebendo apenas cirurgia (100,0 vs. 98,1%, p = 1.000). Entretanto, os pacientes com tumores recorrentes apresentaram maior incidência de STR (61,5 vs. 32,7%, p = 0,004) e menor incidência de ressecção Simpson grau I (11,5 vs. 34,1%, p = 0,019). A incidência de edema peritumoral, tamanho do tumor e volume tumoral foram semelhantes entre os grupos. Na análise histopatológica, os pacientes com recorrência apresentaram tendência a aumento da atipia nuclear (19,2 vs. 7,5%, p = 0,061). Os pacientes com recidiva também tiveram um seguimento médio maior (68,9 vs. 37,7 meses, p = 0,001).
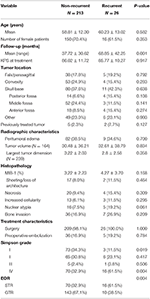
Tábua 2. Comparação de pacientes com meningiomas recorrentes vs. meningiomas não recorrentes.
Uma análise subseqüente de probabilidade retroativa de cox-regressão destacou uma relação independente entre recidiva e localização do tumor da fossa posterior (FC = 5.25, IC 1,71-16,17, p = 0,004), índice MIB-1 (FC = 1,18, IC 1,05-1,34, p = 0,008), atipia nuclear (FC = 5,24, IC 1,73-15,92, p = 0,003) e STR (FC = 5,66, IC 1,30-13,92, p < 0,001; Tabela 3). As curvas de Kaplan-Meier destacando sobrevida livre de recorrência para localização da fossa posterior (p = 0,007), atipias nucleares (p = 0,137), extensão da ressecção (p = 0,001) e MIB-1 >4,5% (p = 0,001) são mostradas nas Figuras 1A-D.
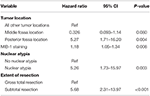
Tabela 3. Análise de regressão de Cox para recorrência.

Figura 1. Curvas de Kaplan Meier dos fatores de risco para recorrência de meningioma de grau I da OMS. (A) Atipia nuclear (linha azul) vs. sem atipia nuclear (linha vermelha) (X2 = 2,21, p = 0,137). (B) Localização do tumor pós-fossa (linha azul) vs. outros locais (linha vermelha) (X2 = 10,36, p = 0,001). (C) Índice MIB-1 >4,5% (linha azul) vs. ≤4,5% (linha vermelha) (X2 = 6,17, p = 0,013). (D) STR (linha azul) vs. GTR (linha vermelha) (X2 = 10,46, p = 0,001).
Preditores de Meningioma Precoce vs. Pós-médico OMS Grau I Recorrência
Uma comparação entre pacientes não recorrentes e pacientes com tumores que recidivaram precocemente ou pós-médico é apresentada na Tabela 4. Os pacientes com recidiva precoce tiveram maior incidência de ressecção subtotal (76,9 vs. 32,7%, p = 0,001). Eles também tinham tendência a uma maior incidência de atipias nucleares (23,1 vs. 7,5%, p = 0,084) em histopatologia (Tabela 4). Os pacientes com recorrência pós-mediana tenderam a uma maior incidência de localização do tumor da fossa posterior (23,1 vs. 6,6%, p = 0,063) e uma maior incidência de invasão óssea (38,5 vs. 16,9%, p = 0,064), bem como um maior índice de MIB-1 (5,55 vs. 3,22%, p = 0,098). Não houve diferença significativa entre as taxas de Simpson ou GTR em pacientes com recorrência pós-mediana vs. pacientes não recorrentes (Tabela 4).
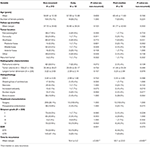
Tábulo 4. Recidiva precoce vs. recidiva pós-mediana.
Dois modelos logísticos binários de probabilidade retroativa multivariada foram usados para identificar preditores de recidiva precoce vs. recidiva pós-mediana (Tabela 5). Os preditores independentes de recidiva precoce do tumor incluíram atipias nucleares em histopatologia (OR = 6,45, IC 1,34-31,07, p = 0,020) e STR (OR = 8,92, IC 2,18-36,46, p = 0,002). O único preditor independente de recorrência pós-mediana foi o índice MIB-1 (OR = 1,24, IC 1,05-1,45, p = 0,010), embora a localização da fossa posterior tenha se aproximado da significância (OR = 4,42, IC 0,954-20,49, p = 0,058; Tabela 5).

Tabela 5. Modelo logístico binário para recidiva pós-mediana e precoce de tumor.
Análise de Partição Recursiva de Recidiva
RPA foi realizada para identificar os principais fatores de risco de recidiva de meningioma (Figura 2). Consistente com a análise de cox-regressão, a STR foi a primeira partição ao prever a recorrência global: 18,6% dos pacientes com ressecção de STR recorreram em comparação a 6,5% com GTR. O próximo nó de decisão dentro de apenas pacientes com GTR envolveu um corte da MIB-1 de 4,5%, já que 18,8% dos pacientes com MIB-1 >4,5% recorreram contra 3,3% dos pacientes com MIB-1 ≤4,5% (Figura 2A). No que se refere especificamente à recidiva pós-mediana, a RPA identificou o primeiro nó de decisão como um corte de 5,83% para a MIB-1: 22,2% dos pacientes com MIB-1 >5,83% recorreram vs. 3,3% dos pacientes com MIB-1 ≤5,83%. O nó de decisão subsequente utilizou uma localização posterior do tumor da fossa: 13,3% dos pacientes com recidiva de tumor de fossa posterior vs. 2,5% de outras localizações tumorais (Figura 2B). A RPA para recidiva precoce identificou a extensão da ressecção como o nó de decisão primário: 11,6% dos pacientes com recidiva de STR vs. 2,0% dos pacientes com GTR. O nó de decisão seguinte utilizou localização falx ou parasagital: 36,4% dos tumores falx ou parasagitais recorreram vs. 8,1% de outras localizações tumorais (Figura 2C).
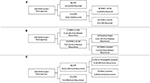
Figura 2. Análise de partição recursiva destacando fatores-chave de risco para (A) recidiva geral, (B) recidiva pós-mediana e (C) recidiva precoce.
Discussão
Resultados Chaves
Recidiva do meningioma grau I da OMS está independentemente associada ao índice MIB-1, localização do tumor da fossa posterior, presença de atipia nuclear e STR. Mais especificamente, um índice de MIB-1 de 4,5% foi identificado como um corte clinicamente relevante nos pacientes com meningioma de grau I da OMS que seguem o GTR. Pacientes com índice MIB-1 >4,5% e GTR do meningioma grau I da OMS tiveram um risco de recidiva semelhante ao dos pacientes com uma RST. Análise adicional destacou a MIB-1 como fator crítico associado à recorrência pós-mediana, enquanto a extensão da ressecção foi o principal fator de recorrência precoce.
Preditores de Meningioma Grau I da OMS Recorrência
Estudos anteriores avaliaram de forma semelhante a relação entre características histopatológicas, características clínicas e recorrência em todos os meningiomas Grau I da OMS. Em um estudo com 901 pacientes (716 WHO Grau I, 174 Grau II e 11 Grau III), Gousias et al. demonstram maior risco de recorrência em meningiomas com índice MIB-1 de >10%, maior grau OMS, tamanho do tumor >6 cm, localização petroclival ou do seio cavernoso, e multiplicidade (11). Entretanto, Gousias et al. não avaliaram a relação entre a presença de características atípicas na histologia e a recidiva tumoral. No meningioma grau I especificamente da OMS, Marciscano et al. utilizaram uma coorte de 148 pacientes com meningioma grau I da OMS com análise patológica completa para identificar variáveis associadas à recorrência, com foco no impacto de características patológicas atípicas no risco de recorrência (9). Curiosamente, identificam a presença de características atípicas como fator de risco independente, além do índice MIB-1 >3% e da ressecção Simpson. Nosso estudo também destaca o GTR cirúrgico e a atipia nuclear, uma característica atípica, como preditores independentes de recorrência (Tabela 3), embora tenhamos avaliado cada característica atípica de forma independente. Também consideramos a localização do tumor em nosso modelo de cox-regressão, identificando ainda a localização da fossa posterior do tumor como um fator de risco independente de recidiva. Enquanto Marciscano et al. não incluíram a localização do tumor em sua análise dos preditores de progressão, Gousias et al. igualmente demonstram a localização do tumor petroclival como fator de risco de recidiva, embora ao considerar todos os graus de meningioma da OMS (9, 11). O maior risco de recidiva associado à localização da fossa posterior pode ser devido ao aumento da prevalência de mutações NF2 na fossa posterior (14, 15, 20), embora sejamos incapazes de explorá-lo completamente, pois não realizamos rotineiramente testes genéticos de meningioma em nossa instituição. Independentemente disso, estudos adicionais com maiores coortes de pacientes com meningioma grau I da OMS são necessários para investigar essa relação.
MIB-1 Index and WHO Grade I Meningioma Recurrence
Simples aos estudos anteriores (9, 11, 13, 21), então também avaliamos a relação entre o índice MIB-1 de um tumor e seu risco de recidiva. Primeiro avaliamos o índice MIB-1 em um modelo de cox-regressão para recidiva global, como discutido anteriormente. Em concordância com estudos anteriores, constatamos que um índice de MIB-1 mais alto estava independentemente associado a um aumento global do risco de recidiva. Dadas as discrepâncias nos valores de corte para a MIB-1 entre a literatura e a variabilidade interlaboratorial, inicialmente avaliamos a MIB-1 como uma variável contínua. Em seguida, procuramos determinar o corte para o índice de MIB-1 em nossa população de pacientes, utilizando a RPA para modelar a recorrência global, que identificou um valor de corte da MIB-1 de 4,5% em pacientes com GTR (Figura 2A). Curiosamente, esses pacientes apresentavam risco de recorrência semelhante ao dos pacientes com RTR, demonstrando a utilidade da MIB-1 em pacientes que seguem RTR. Perry et al. identificam, de forma semelhante, um índice de MIB-1 de 4,2% como associado à recorrência após a TRG em análise univariada, embora considerando todos os graus de meningioma (22).
A taxa de recorrência de 18,8% em pacientes com TRG e MIB-1 >4,5%, ressalta a necessidade de vigilância próxima destes pacientes ou mesmo a consideração de radioterapia adjuvante, dependendo da preferência do paciente. A radioterapia adjuvante após ressecção para meningioma de grau I da OMS tem mostrado reduzir a recorrência, especialmente após STR (23-25), embora a observação após STR continue sendo prática padrão (8). Em um estudo de 92 meningiomas grau I da OMS, Soyuer et al. demonstraram uma sobrevida livre de progressão (PFS) de 91% em pacientes que receberam radioterapia adjuvante após a STR, que foi significativamente maior que a PFS de 38% naqueles pacientes que não receberam radioterapia adjuvante (24). Como os pacientes em nosso estudo com RST apresentaram risco de recorrência semelhante aos pacientes com RTR e MIB-1 >4,5%, a radioterapia adjuvante para ambos os grupos pode ser razoável. Entretanto, estudos maiores são necessários para validar ainda mais o corte da nossa MIB-1 e as implicações clínicas associadas. Estudos prospectivos investigando o uso de radioterapia adjuvante em meningiomas grau I da OMS também são necessários.
Preditores de Meningioma Precoce e Pós-Médico grau I da OMS Recidiva de Meningioma
Dada a tendência de recidiva posterior em pacientes com uma MIB elevada >4.5% (Figura 1C), procuramos então investigar diferenças nos preditores entre pacientes que recidivaram precocemente (definidos como dentro de 2 anos após o tratamento) ou pós-medicina (aqueles que recidivaram >2 anos após o tratamento). Poucos estudos na literatura investigaram preditores de recidivas precoces em meningiomas. Um estudo de Budohoski et al. identifica a localização da parafalcina, STR e edema peritumoral em imagens radiográficas como preditores de recidiva precoce em uma coorte de 220 meningiomas atípicos (26). Um estudo semelhante de Maillo et al., em meningiomas de grau I da OMS, utiliza a hibridação interfase fluorescente in situ (FISH) e características patológicas para identificar fatores de risco de recidiva precoce (definidos como 2,5 anos após o tratamento) e encontrou maior tamanho do tumor, anormalidades cariótipo, idade do paciente e anormalidades do cromossomo 10 a serem associadas ao aumento do risco de recidiva (19). Entretanto, os autores não consideraram a presença de atipia na patologia ou índice MIB-1. Utilizando uma coorte de pacientes com meningioma grau I da OMS com dados clínicos e patológicos mais granulares, identificamos a extensão da ressecção e atipia nuclear na patologia como preditores independentes de recorrência precoce na modelagem da regressão logística binária (Tabela 5). A RPA também revelou a importância da extensão da ressecção em pacientes com risco estratificado para a recidiva precoce (Figura 2C). Curiosamente, também destacou o aumento do risco associado à localização do tumor falx/parasagittal, correspondendo aos achados de Budohoski et al. (26). O único preditor significativo de recidiva tumoral pós-mediana na modelagem de regressão logística binária foi o índice MIB-1, embora a localização posterior da fossa tumoral tenha se aproximado da significância. Isto foi demonstrado mais detalhadamente na RPA (Figura 2B). Surpreendentemente, a extensão da ressecção não foi um preditor independente de recidiva pós-mediana, uma vez que a maioria das recidivas pós-mediana tinha sido submetida a um GTR. As recidivas pós-medianas podem destacar uma categoria de meningioma de grau I da OMS que é molecularmente mais agressiva e recorre apesar da GTR, dado seu elevado índice MIB-1 e localização posterior da fossa. As recidivas precoces são significativamente mais impactadas pela extensão da ressecção e, como resultado, provavelmente representam o crescimento contínuo do tumor residual em oposição à recidiva do tumor anterior completamente ressecado, como visto nas recidivas pós-medianas. Assim, os nossos resultados representam potencialmente dois subtipos diferentes de meningioma molecular de grau I da OMS. Entretanto, estudos futuros com maiores coortes de pacientes e dados moleculares do tumor são necessários para investigar mais profundamente as diferenças subjacentes nas alterações moleculares entre recidivas precoces e pós-medianas.
Limitações
As limitações do nosso estudo incluem sua natureza retrospectiva e baixa incidência de recidiva. Nosso estudo também inclui pacientes iniciados em 2007 e, como resultado, abrange os esquemas de classificação CNS da OMS de 2007 e 2016. Entretanto, a única mudança significativa entre as duas classificações foi a adição da invasão cerebral como critério isolado para o status de grau II da OMS. Apenas dois dos pacientes incluídos na nossa coorte tiveram invasão cerebral notada na análise patológica, e nenhum dos pacientes se repetiu. Como resultado, não acreditamos que a inclusão de pacientes classificados com o esquema de classificação de 2007 tenha tido um impacto significativo em nossos achados. Além disso, nosso estudo se baseia nos relatos patológicos após a ressecção inicial, sem uma revisão central das lâminas patológicas. Isto pode levar ao aumento da variabilidade das variáveis patológicas, como a atipia nuclear e outros achados patológicos similares que podem demonstrar variabilidade interobservador (27, 28). Entretanto, a MIB-1 é uma medida relativamente objetiva com menor variabilidade interobservador entre patologistas usando o mesmo método dentro de um laboratório de patologia (29). Os padrões de prática dos testes da MIB-1 também mudaram durante o período de tempo do estudo, de preferência individual do patologista, que variou dependendo do patologista, para testes em todos os pacientes. Fatores considerados pelos patologistas ao decidir sobre o teste MIB-1 incluíram as características atípicas incluídas em nosso estudo, minimizando assim seu potencial impacto em nossos achados. Além disso, todos os meningiomas incluídos em nosso estudo são de grau I da OMS. Como resultado, acreditamos que qualquer viés introduzido no estudo com base nessas mudanças nos padrões de prática é mínimo. Finalmente, embora incluamos características clínicas e patológicas detalhadas, a nossa coorte de pacientes carece de informações sobre mudanças genéticas e moleculares tumorais, que demonstraram ter um impacto significativo nos resultados tumorais (15, 30-32). Assim, ainda há necessidade de grandes estudos multi-institucionais adicionais com dados moleculares/genéticos, além das tradicionais variáveis patológicas e clínicas, quando se prevê a recorrência geral de meningiomas de grau I da OMS. Isto inclui a consideração de prognosticadores moleculares/geneticos, tais como padrões de metilação em todo o genoma (33, 34), mutações promotoras de TERT (35), e dados moleculares tumorais adicionais, dados nossos achados, futuras investigações em preditores genéticos/moleculares, clínicos e patológicos únicos de recidivas precoces e tardias também são justificadas, dado o potencial impacto na tomada de decisão terapêutica pelos médicos.
Não obstante, nosso estudo fornece uma visão detalhada dos preditores clínicos e histopatológicos de recidivas, especificamente nos meningiomas de grau I da OMS. Além disso, identificamos pacientes com MIB-1 >4,5% como de alto risco de recidiva após GTR. Também aproveitamos nossos dados para fornecer uma visão das diferenças entre as recidivas de meningioma de grau I precoce e pós-médico da OMS, identificando potencialmente diferentes subgrupos moleculares de meningioma de grau I da OMS. Nossos resultados sugerem que pacientes com elevado índice de MIB-1 e atipias nucleares na análise patológica, localização posterior da fossa do tumor e STR têm maior risco de recorrência e devem ser considerados para um acompanhamento mais próximo ou mesmo para radioterapia adjuvante. Além disso, pacientes com MIB-1 acima de 4,5% estão em risco semelhante de recidiva àqueles que se submeteram à RST de seus tumores e devem ser considerados também potencialmente para radioterapia adjuvante.
Conclusão
Existe ainda uma escassez de literatura sobre preditores específicos de recidiva nos meningiomas de grau I da OMS. Os achados deste estudo destacam a localização do tumor da fossa posterior, índice MIB-1, atipias nucleares e extensão da ressecção como independentemente associados à recidiva de meningiomas grau I. Demonstramos também que pacientes com MIB-1 >4,5% e GTR têm um risco de recidiva semelhante ao dos pacientes com RST. Finalmente, a análise diferencial das recidivas precoces e pós-medianas revelou a associação do índice MIB-1 e da localização da fossa posterior nas recidivas pós-medianas, enquanto as recidivas precoces foram mais significativamente impactadas pela extensão da ressecção. Estudos adicionais validando nossos achados e incluindo dados moleculares/genéticos são necessários para identificar preditores adicionais de recidivas nos meningiomas de grau I da OMS. Tais estudos poderiam fornecer uma estrutura mais precisa para a estratificação dos riscos e auxiliar na tomada de decisões terapêuticas, incluindo o potencial para radioterapia adjuvante.
Data Availability Statement
Os dados brutos que suportam as conclusões deste artigo serão disponibilizados pelos autores, sem reservas indevidas.
Ethics Statement
Os estudos envolvendo participantes humanos foram revisados e aprovados pelo Comitê de Revisão Institucional da UCSF. Não foi necessário o consentimento livre e esclarecido por escrito para participação neste estudo, de acordo com a legislação nacional e os requisitos institucionais.
Contribuições dos autores
AH: conceituação, metodologia, análise formal, investigação, redação-original, redação-revisão e edição e visualização. JY: conceitualização, metodologia, e redação-revisão e edição. IK e SS: investigação. J-SC: visualização e análise formal. DR e MM: revisão-escrita e edição. SM: revisão-escrita e edição, conceitualização e metodologia. MA: revisão-escrita e edição, e supervisão. Todos os autores contribuíram para o artigo e aprovaram a versão submetida.
Conflito de Interesses
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
O revisor BB declarou co-autoria passada com os autores DR, MM e SM ao editor de tratamento.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. Relatório estatístico CBTRUS: tumores primários do cérebro e outros tumores do sistema nervoso central diagnosticados nos Estados Unidos em 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Gestão médica de meningiomas. Situação atual, tratamentos fracassados e horizontes promissores. Clínica N Am. de Neurocirurgia. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Avanços na terapia multidisciplinar para meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. A classificação dos tumores do sistema nervoso central da Organização Mundial de Saúde em 2016: um resumo. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Acompanhamento a longo prazo de 25 anos de meningiomas parasagitais tratados cirurgicamente. Neurocirurgia mundial. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Sobrevivência deficiente e problemas neurológicos a longo prazo no meningioma benigno. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. Uma visão geral dos meningiomas. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomas: base de conhecimento, resultados do tratamento e incertezas. Uma revisão da RANO. J Neurocirurgia. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Meningiomas benignos (WHO Grade I) com características histológicas atípicas: correlação das características histopatológicas com os resultados clínicos. J Neurocirurgia. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. A invasão cerebral em meningiomas de outra forma benignos não prevê recidiva tumoral. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. A classificação simpson revisitada: cirurgia agressiva e seu lugar no manejo moderno do meningioma. J Neurocirurgia. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Análise clínica e histopatológica dos potenciais proliferativos de meningiomas recorrentes e não recorrentes. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significado do sistema de classificação Simpson na cirurgia moderna do meningioma: integração da classificação com o índice de classificação MIB-1 como chave para prever a recorrência de meningiomas de grau I da OMS – artigo clínico. J Neurocirurgia. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Paisagem genética do meningioma. Pathol do Tumor Cerebral. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Potencial clínico dos conhecimentos genómicos do meningioma: uma revisão prática para neurocirurgiões. Foco em Neurocirurgiões. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. O perfil molecular prevê a recorrência do meningioma e revela a perda da repressão do complexo DREAM em tumores agressivos. Proc Natl Acad Sci EUA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Invasão cerebral em meningiomas: incidência e correlações com variáveis clínicas e prognóstico. Neurocirurgia mundial. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Pi’em J, Velnar T, Prestor B, Mlakar J, Popović M. A capacidade de avaliação da invasão cerebral em meningiomas está relacionada ao tamanho e grau do meningioma, e pode ser melhorada através de uma ampla amostragem da amostra de meningioma removida cirurgicamente. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Recidivas precoces em meningiomas histologicamente benignos/ grau I estão associadas a grandes tumores e coexistência da monossomia 14 e del(1p36) no clone celular tumoral ancestral. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlações entre subgrupo genômico e características clínicas em uma coorte de mais de 3000 meningiomas. J Neurocirurgia. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Características histopatológicas preditivas do controle local do meningioma atípico após cirurgia e radioterapia adjuvante. J Neurocirurgia. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. O significado prognóstico de MIB-1, p53, e citometria de fluxo de DNA em meningiomas primários completamente ressecados. Câncer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Resultado cirúrgico a longo prazo e fatores de prognóstico biológico em pacientes com meningiomas da base do crânio: artigo clínico. J Neurocirurgia. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radioterapia após cirurgia para meningioma cerebral benigno. Radioterapia Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Radioterapia adjuvante adaptada ao grupo de risco para meningioma de base do crânio de grau I e II da OMS. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Preditores de progressão precoce de meningiomas atípicos tratados cirurgicamente. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Características histopatológicas que prevêem a recorrência de meningiomas após a ressecção subtotal. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. O espectro histopatológico dos meningiomas humanos. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. MIB-1 métodos de contagem em meningiomas e concordância entre patologistas. Quant Quant Cytol Histol Anal. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Alterações genéticas associadas à progressão e recidiva nos meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Determinações biológicas moleculares de progressão e recidiva do meningioma. PLoS UM. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Mudanças genéticas com valor prognóstico em meningiomas histologicamente benignos. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. Metilação do DNA na transformação maligna dos meningiomas. PLoS UM. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Marcadores de metilação de potencial maligno em meningiomas. J Neurocirurgia. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. O significado prognóstico das mutações promotoras do TERT no meningioma: uma revisão sistemática e uma meta-análise. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar