Introduction
Rice tem uma arquitetura de raiz complexa com uma mistura de raízes embrionárias e pós-embrionárias. O radícula emerge primeiro durante a germinação, seguido logo em seguida pelas raízes coronárias embrionárias (Rebouillat et al., 2009; Coudert et al., 2010). As primeiras raízes adventícias pós-embrionárias resultantes da atividade do meristema apical do rebento aparecem poucos dias após a germinação das plântulas. Raízes adventícias também são chamadas raízes coronárias ou de coroa e são produzidas durante toda a vida de uma planta.
A anatomia interna da raiz do arroz é bem descrita, particularmente na fase de muda (Rebouillat et al., 2009). Vários tecidos concêntricos (desde a periferia até a estela) estão localizados entre a epiderme e os tecidos vasculares (Figura 1). Estes tecidos, colectivamente referidos como “tecido moído”, são por vezes também referidos como o “córtex” (Lux et al., 2004). Aqui, retemos o termo genérico, ou seja, tecido moído, para descrever os tecidos exodérmico, esclerênquima, cortical e endodérmico. Referimo-nos ao “córtex” como o tecido localizado entre a endoderme e o esclerênquima.
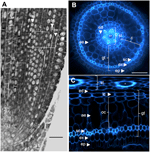
Figura 1. Anatomia de um radículo Nipponbare de 6 dias de idade. (A) Secção longitudinal de um radículo fixo e paraplástico incorporado. Barra = 100 μm. (B) Secção transversal de um radículo fresco observado sob luz UV. Barra = 50 μm. (C) Vista transformada polar de B. As camadas de tecidos são rotuladas da seguinte forma: estela (st), tecido moído (gt) composto por várias camadas celulares: uma camada de endoderme (ed), várias camadas de córtex (c), uma camada de esclerênquima (sc) e uma camada de exoderme (ex). As camadas endodérmicas (ed) e exodérmicas (ex) são facilmente identificadas pela ausência/redução de fluorescência nos centros das paredes celulares destas células. O radículo é protegido por uma camada de epiderme (ep). Dois tipos de camadas corticais podem ser identificadas: o córtex interno (ic), que está ao lado da endoderme (ed), e o córtex externo (oc), que eventualmente irá formar aerênquima (ae). Na estela, note a presença de um grande metaxilema central (cx) cercado por 6 vasos do metaxilema (x).
Texo terrestre é composto por várias camadas de tecidos que têm a mesma origem parenquimatosa, mas diferentes características específicas que desempenham vários e importantes papéis estruturais e funcionais nas raízes. Por exemplo, a exoderme e a endoderme são barreiras apoplásticas que controlam o transporte radial de água e nutrientes do solo para os órgãos fotossintéticos, uma característica proporcionada principalmente pela deposição de lamelas suberínicas e diferenciação da parede celular secundária (Gregory, 2006). Os esclerênquimos são células lignificadas que representam uma barreira crítica para alguns metais e possivelmente desempenham um papel de suporte mecânico (Huang et al., 2012). Em contraste com estes três tecidos monocamadas, o tecido cortical no radículo do arroz é composto por quatro ou cinco camadas. Este tecido, também chamado de mid-cortex ou mesodermis, é caracterizado pela formação esquizógena de espaços, levando à formação de aerênquima no arroz (Justin e Armstrong, 1991; Kawai et al., 1998). O aerênquima desempenha um papel importante na tolerância às condições de inundação e assegura o fluxo contínuo de oxigênio do rebento até a raiz, permitindo o crescimento radicular sob condições anóxicas. O córtex tem uma função importante mas variável na fisiologia radicular de numerosas espécies e está envolvido no armazenamento, tolerância à inundação, ou interações simbióticas (Lux et al., 2004).
As raízes radiculares e coronárias produzem três tipos de raízes laterais: pequenas raízes laterais (SLRs) e dois tipos de grandes raízes laterais (Kawata e Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Esta divisão é baseada no (i) diâmetro das raízes: SLRs são as menores (50-60 μm) e L-LLRs são as maiores (120-150 μm), (ii) ramificações, que são observadas apenas em LLRs, (iii) a presença de um vaso central de metaxilema apenas em LLRs, e (iv) a presença de uma camada de esclerênquima apenas em L-LLRs (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). Apesar desta classificação, a identidade dos tecidos radiculares internos nas raízes laterais, particularmente nos SLRs, permanece incerta. De facto, Rebouillat et al. (2009) e Kawata et al. (1977) afirmaram ambos que o tecido terrestre SLR era composto pela endoderme, esclerênquima e exoderme (de dentro para fora), enquanto em Kono et al. (1972), a camada celular esclerenquimatosa do cortex interior foi descrita como ausente em SLRs e T-LLRs.
Para resolver este dilema, e para estudar o desenvolvimento e função de tecidos particulares em geral, o uso de marcadores de identidade é necessário. A maioria dos marcadores de tecidos utilizados até agora são marcadores morfológicos ou manchas histoquímicas, que têm fornecido uma forma útil de caracterizar a identidade celular. A berberina revela a presença de suberina nas paredes celulares, que se encontra quase exclusivamente nas tiras casparianas que envolvem cada célula endoderme individual, sendo assim um bom marcador indirecto da identidade endoderme (Brundett et al., 1988). Em A. thaliana, os marcadores tecido-específicos também foram desenvolvidos usando promotores tecido-específicos fundidos a genes repórteres (GUS e/ou GFP) em plantas geneticamente modificadas. Por exemplo, o promotor SCARECROW é usado como um marcador de identidade endodérmico (Sugimoto et al., 2010). O QC25 e o QC46 melhoram as linhas GUS (Sabatini et al., 2003) e QHB no arroz (Kamiya et al., 2003) também foram identificados como marcadores de centro quiescente (QC) com base em sua expressão específica de QC. Apesar do interesse nestes marcadores, apenas alguns estão disponíveis e quase exclusivamente em A. thaliana. Eles também têm inconvenientes. Por exemplo, a adequação de usar o promotor SCARECROW (SCR) como um marcador “endodermis” é discutível quando questões específicas sobre os papéis SCR e SHORT ROOT (SHR) na diferenciação do tecido terrestre. De facto, os genes SCR e SHR estão envolvidos per se na formação de endodermis/cortex (Wu e Gallagher, 2014). Em A. thaliana, os únicos marcadores de córtex radicular disponíveis são os promotores de Co2 e Co3 (Heidstra et al., 2004; Ten Hove et al., 2010). No arroz, estes marcadores do córtex ainda não são utilizados porque não existem ortologs claros para os genes Co2 e Co3. Apenas marcadores morfológicos indiretos foram usados até o momento no arroz, como a formação de aerênquima para a identidade cortical (Rebouillat et al., 2009).
Outra classe de marcadores está disponível comercialmente anticorpos direcionados contra as paredes das células vegetais (http://www.plantprobes.net/index.php). Estes marcadores têm sido utilizados pouco no passado, mas a sua eficácia tem sido demonstrada. Por exemplo, os anticorpos de parede celular CCRC-M2 e JIM13 foram usados em A. thaliana para mostrar que a camada única de tecido interno presente no mutante de encolhimento tinha identidade cortical, enquanto que a camada de tecido terrestre do mutante de scr exibia múltiplas identidades (Di Laurenzio et al., 1996; Helariutta et al., 2000). Estes marcadores têm muitas vantagens: sua simplicidade e a possibilidade de combinar anticorpos secundários acoplados a diferentes fluorocromos para limitar a sobreposição com autofluorescência, não requerem transformação genética e podem ser usados para complementar outras classes de marcadores.
Neste trabalho, primeiro descrevemos um protocolo simples de média produção para seções de tecido vibratômico fresco com rotulação imunológica. Usando este protocolo, nós crivamos seções radiais de radículos de arroz com uma grande biblioteca de 174 anticorpos de parede celular. Entre estes, identificamos oito marcadores específicos do córtex e demonstramos que o arroz possui dois tipos de tecidos corticais com identidade distinta. Chamamos essas camadas de córtex interno e externo com base em sua respectiva posição anatômica nos cortes radiculares. Para demonstrar a utilidade desses marcadores específicos do córtex, nós esclarecemos as identidades dos tecidos triturados das raízes laterais usando três desses anticorpos. Nos SLRs em particular, mostramos que a camada interna do tecido tem uma identidade cortical externa. Nosso protocolo é suficientemente genérico para ser usado para o desenvolvimento de marcadores teciduais em qualquer espécie, sem a necessidade de gerar plantas transgênicas. Este protocolo pode ser facilmente adaptado com rebentos frescos, folhas, raízes ou quaisquer tecidos em outras plantas e representa uma forma simples e fácil de identificar marcadores específicos de tecidos. Além disso, estes marcadores podem ser usados em conjunto com outros marcadores moleculares.
Resultados
Imunoprofiling of Cell Wall Antibodies in Rice Root Radial Sections Reveals Specific Antibodies for Cortex Layers
Com o objetivo de identificar marcadores baseados em anticorpos para células corticais, primeiramente estabelecemos um protocolo para imunomarcação de médias tiragens de seções radiais de raízes de arroz fresco (veja Materiais e Métodos e Figura Complementar 1 para detalhes). Em seguida, realizamos uma tela com anticorpos monoclonais levantados contra componentes da parede celular (do Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) e Paul Knox Cell Wall lab (University of Leeds, UK), veja Materiais e Métodos para detalhes)) para identificar marcadores de córtex. Dos 174 anticorpos testados, apenas 12 foram retidos como putativamente específicos do córtex. Testamos sua repetibilidade realizando dois experimentos adicionais e concluímos que oito anticorpos apresentaram perfis similares e robustos entre os três replicados (Figura 2). Cinco anticorpos (JIM7, M14, M38, M130, e M131) forneceram o mesmo padrão de imunomarcação no córtex. Apenas as paredes celulares não-adjacentes foram rotuladas, resultando numa singular “forma diamantada” de todas as células corticais. Para os outros três anticorpos (LM5, M133 e M107), a etiquetagem foi detectada no córtex e às vezes nas células esclerênquimas, particularmente com os anticorpos LM5 e M107. O sinal era homogêneo na parede celular da córtex, mas era muito mais fraco nas camadas internas da córtex (a camada de córtex adjacente à camada endodérmica) do que nas camadas externas da córtex. Assim, todos estes anticorpos com perfis complementares aos tecidos corticais são marcadores específicos que podem ser usados para analisar a identidade das células corticais. Além disso, as duas diferentes etiquetas corticais, definindo duas áreas subcorticais, sugerem que as camadas externas e internas têm uma identidade molecular distinta que foi revelada por estes anticorpos.
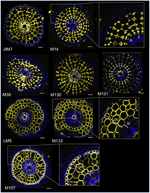
Figura 2. Identificação de oito anticorpos de córtex específicos (JIM7, M14, M38, M130, M131, LM5, M133, e M107) entre os 174 analisados a partir da biblioteca de anticorpos de parede celular monoclonal. Para cada anticorpo, foram obtidas imagens fundidas de cortes transversais sob um microscópio confocal após etiquetagem imunohistológica: em amarelo, padrão de anticorpos a 561 nm, e em azul, autofluorescência da parede celular sob luz UV. Cinco anticorpos (JIM7, M14, M38, M130, e M131) mostram um perfil semelhante em todas as camadas de células corticais coradas (formas diamantadas). Três anticorpos (LM5, M133, e M107) com rótulo homogêneo nas paredes das células corticais. Note que para estes anticorpos, as camadas interiores da cortical (ic) não estão coradas em comparação com as camadas exteriores da cortical (oc). Os revestimentos interiores são grandes planos das imagens correspondentes. Bars = 20 μm.
Algumas características específicas destas duas camadas subcorticais foram destacadas quando o plugin “transformador polar” do software ImageJ (http://imagej.nih.gov/ij/) foi usado para visualizar as imagens das seções radiculares (Figuras 1B,C; Schneider et al., 2012; Lartaud et al., 2014). As células internas foram caracterizadas por uma parede celular espessa em comparação com as células externas, que exibiam várias cavidades contendo ar, resultantes da fusão da parede celular. As células corticais internas também exibiam uma forma achatada, semelhante às células endodérmicas, em contraste com as células externas, que eram mais arredondadas. Nesta imagem transformada, a parede celular radial que é a parede que corre do lado interno da célula para o lado externo, autofluorescência das células endodérmicas e exodérmicas não são visíveis, presumivelmente devido à presença de tiras casparianas. Similarmente, mas em menor extensão, pequenos orifícios isentos de autofluorescência também eram visíveis nas paredes radiais das células corticais internas.
Todos os tipos de raízes laterais possuem apenas tecido cortical externo
Para demonstrar a utilidade dos marcadores do córtex e para caracterizar as identidades celulares, rotulamos os três tipos de raízes laterais do arroz (L-LLR, T-LLR e SLR) com três destes anticorpos (M107, M133, e M14). Para este experimento, como as L-LLRs não se desenvolvem freqüentemente em placas de Petri, as raízes laterais foram coletadas de mudas de arroz cultivadas sob condições hidropônicas por 2 semanas. Analisamos primeiro a organização do tecido terrestre de cada tipo de raiz lateral observando a autofluorescência das paredes celulares nas vistas transversal e polar das seções radiculares (Figura 3). Esta primeira análise revelou anatomia interna radial ligeiramente distinta para os três tipos de raízes laterais. Similar aos cortes radiculares vistos sob luz UV, os tecidos endodérmicos e exodérmicos podem ser identificados pela extinção da fluorescência no centro das paredes celulares radiais. Estes dois tecidos estavam presentes em todas as raízes laterais. Entre a endoderme e a exoderme, várias camadas de tecido estavam presentes nos L-LLRs e T-LLRs enquanto os SLRs possuíam apenas uma única camada celular (não identificada). A anatomia das L-LLRs pareciam raízes seminais e externas à endoderme, várias camadas de tecido cortical foram facilmente identificadas quando o tecido aerênquima foi formado. Além disso, também foi observada uma camada de esclerênquima formada por células estreitamente empacotadas com amplas paredes celulares. Dependendo do experimento, esta camada celular nem sempre foi completamente desenvolvida. Nas secções T-LLR, a camada externa assemelhava-se ao tecido cortical e a camada interna à camada SLR simples (não identificada).
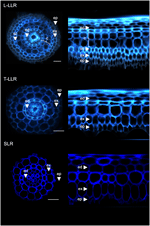
Figure 3. Composição do tecido dos tipos de raiz lateral grande (Large-LLR e Thin-LLR) e raiz lateral pequena (SLR). As plântulas foram cultivadas em condições hidropônicas durante 2 semanas. Autofluorescência da parede celular de secções transversais e vista transformada polar sob luz UV. Os tecidos são rotulados da seguinte forma: epiderme (ep), exoderme (ex), córtex (c), endoderme (ed). Note que a epiderme (ep) foi frequentemente fragmentada durante o decorrer da experiência. Bars = 20 μm.
Para identificar as camadas celulares presentes no SLR e T-LLR dos tecidos triturados e para confirmar a identidade cortical nos L-LLRs, nós imunomarcamos cortes laterais de raiz com três anticorpos específicos do córtex (M107, M133 e M14; Figura 4). Os anticorpos M107 e M133 rotulam todas as camadas celulares localizadas entre a endoderme e a exoderme em todas as raízes laterais. Com base na coloração de radícula para estes anticorpos, esta observação indicou que estas camadas celulares podem ter esclerênquima ou identidade cortical. No entanto, o fato de M14 também ter sido imunoligrado com estas camadas, particularmente nas seções SLR, demonstra claramente que estas camadas tinham identidade cortical externa.

Figura 4. Imagens fundidas dos tipos Large Lateral Root (Large-LLR e Thin-LLR) e Small Lateral Root (SLR), imunolabeladas com M107, M133, e M14. As plântulas foram cultivadas em condições hidropônicas durante 2 semanas. Em amarelo, etiquetagem de anticorpos a 561 nm, e em azul, autofluorescência sob luz UV. Os tecidos são rotulados da seguinte forma: epiderme (ep), exoderme (ex), córtex (c), endoderme (ed). Note que a epiderme (ep) foi frequentemente fragmentada durante o decorrer da experiência. Bars = 20 μm.
Variações no número de camadas de células corticais externas (uma nas SLRs, duas nas T-LLRs, três nas L-LLRs e quatro a cinco no radículo) desempenham um papel importante nos diâmetros das raízes do arroz (Figura 5).
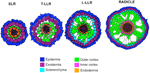
Figura 5. Representação esquemática da raiz lateral e tecidos radiculares.
Conclusões
Termos diferentes já foram usados para qualificar áreas subcorticais em plantas. Por exemplo, a presença de uma camada “interna” do córtex lignificado, comparável à estudada aqui, já foi descrita no arroz selvagem (Yang et al., 2014). No milho, os dois domínios corticais são definidos de forma diferente (Baluška et al., 1993). O domínio “interno” forma aerênquima, correspondendo aqui ao córtex externo, e o córtex “do meio-oriente” é um tecido de suporte lignificado, que poderia ser esclerênquima. Em Arabidopsis, uma camada celular do córtex “médio”, localizada entre a monocamada cortical e a endoderme, também foi descrita (Baum et al., 2002; Paquette e Benfey, 2005). Resultados recentes sugerem que esta camada córtex, cuja formação é regulada pela AG, stress oxidativo, SHR e SCR entre outros, desempenha um papel na tolerância abiótica (Paquette e Benfey, 2005; Cui e Benfey, 2009; Pauluzzi et al., 2012; Wu e Gallagher, 2014). Curiosamente, esta camada também é descrita como uma camada semelhante a uma hélice com uma forma típica (Baum et al., 2002). Poderia esta camada de “córtex médio” da Arabidopsis ser funcional e estruturalmente semelhante à camada interna do córtex do radículo do arroz? Nas seções longitudinais e transversais do arroz, a camada cortical interna também geralmente forma uma hélice, sugerindo que estas duas camadas de tecido poderiam ser comparáveis. Na Arabidopsis, a camada do “córtex médio” deriva de uma divisão endoderme periclinal, que aparece longe do CQ entre 7 e 14 dias após a germinação (Paquette e Benfey, 2005). Novas ferramentas serão necessárias para verificar estes importantes parâmetros no arroz. Por exemplo, até agora, não foi descrito nenhum mutante que afecte o tempo de formação desta camada. Além disso, também são necessários avanços técnicos na imagiologia do CQ do arroz. No entanto, nossos marcadores específicos do córtex oferecem uma nova ferramenta para comparar a função e a rede molecular envolvida na formação do córtex interno (arroz) vs. “córtex médio” (Arabidopsis). O trabalho está em andamento em nosso laboratório para identificar os determinantes moleculares da formação do córtex interno e externo, com SCR e ortologs de arroz SHR como primeiros candidatos para a regulação da formação do córtex nas raízes do arroz (Pauluzzi et al., 2012).
Materiais e Métodos
Material da planta
Seedlings de seis dias
Sementes da Oryza sativa L. ssp. japonica Nipponbare foram cultivadas verticalmente em pratos Petri estéreis (Corning, 431301; 20 × 20 cm) em condições controladas (ritmo dia/noite: 12/12 h, 28/25°C, intensidade luminosa: 500 μE m-2 s-1). Primeiro, as sementes foram esterilizadas à superfície por lavagem em etanol a 70% durante ~1 min. Em seguida, o etanol foi substituído por uma solução composta de 40% de lixívia em água destilada contendo três gotas de tween 80 (Sigma-Aldrich P4780-500 mL). As sementes foram embebidas nesta solução durante 30 min com agitação suave, e depois enxaguadas pelo menos quatro vezes com água destilada estéril. Murashige e Skoog (MS/2) meio (250 mL) esterilizado em autoclave a quente (~50°C) é vertido em placas de Petri, e deixado solidificar durante ~45 min. O meio sólido MS/2 é composto de 2,15 g.L-1 de mistura de sal basal médio de MS (Duchefa Biochemie, M0221), 75 mg.L-1 de mistura de vitaminas MS (Duchefa Biochemie, M0409), e 8 g.L-1 de agarose tipo II (Sigma-Aldrich, A6877). As sementes esterilizadas são então empurradas para o meio solidificado MS/2 com o radícula orientado para baixo. As raízes foram colhidas após 6 dias de crescimento.
Plantas de quatro semanas
Após 3 dias de germinação em água, as mudas foram transferidas para um sistema hidropônico sob condições controladas (ritmo dia/noite: 12/12 h, 28/25°C, intensidade luminosa: 500 μE m-2 s-1, umidade relativa do ar: 55%). O sistema hidropônico consiste em uma caixa plástica de 50 L contendo 30 L de solução hidropônica sobre a qual é colocado um colchão de espuma de 1 cm de espessura. O colchão de espuma é perfurado com fendas para manter as bases dos caules das plântulas. O meio hidropônico é composto de (NH4)2SO4 (0.5 mM), MgSO4.7H2O (1.6 mM), Ca(NO3)2.4H2O (1.2 mM), KNO3 (0.7 mM), FeSO4 (0.1 mM), Na2EDTA (0.1 mM), MnSO4. H2O (1.7 μM), (NH4)6Mo7O24.4H2O (0.2 μM), ZnSO4.7H2O (0.2 μM), CuSO4.5H2O (0.2 μM), H3BO3 (1.4 μM), e KH2PO4 (0.6 mM). A solução é arejada por uma bomba colocada no fundo da caixa de plástico e trocada a cada 10 dias. O pH foi ajustado e mantido em 5,4 ± 0,2,
Secionamento da raiz raiz raiz refrescante
As pontas de radículas em crescimento ou raízes laterais (2 cm) foram cortadas com uma lâmina afiada e colocadas paralelamente umas às outras para alinhar as pontas das raízes (Figuras Suplementares 1A,B). Elas foram embutidas em uma gota de 3% de agarose derretida (50°C; Figura Suplementar 1C). Manchas contendo pontas radiculares foram inseridas em um poço 3 × 1 × 1-cm preenchido com 3% de agarose derretida (Figura Suplementar 1D). Após a solidificação, os blocos foram redimensionados e colados em uma placa vibratômica para serem cortados. Os parâmetros do vibratoma (Hm650v (Thermo Scientific Microm)) foram velocidade 30, freqüência 70, amplitude 0,8 e espessura 60 μm (Figura 1E Suplementar). Os cortes foram transferidos ou para lâminas da câmara (Lab-teak 177402) para imuno-coloração (Figura Suplementar 1F), ou para lâminas umidificadas com tampão fosfato alcalino 1X (PBS, Sigma-Aldrich P3813) para observação.
Immunolocalização
Os cortes colocados nas lâminas da câmara (três por câmara) foram primeiro enxaguados em 0,1 M de glicina suplementada com 1X PBS e depois duas vezes em 1X PBS, cada um durante 10 min. Os tecidos foram então imersos numa solução de PBS contendo 5% de soro fetal bovino (solução de bloqueio, Thermo Fisher 37520) a 4°C durante a noite sob agitação. Os anticorpos primários, diluídos a 1/10 nesta solução de bloqueio, foram aplicados durante a noite a 4°C sob agitação. As secções foram depois lavadas 3 vezes em PBS 1X durante 10 minutos. Os cortes radiculares foram incubados durante 2 h com o anticorpo secundário diluído 500 vezes em solução de bloqueio sob agitação. Estes anticorpos foram acoplados a um fluoróforo, ao anticorpo anti-rato Alexa 546 (Invitrogen A11081) ou ao anticorpo anti-rato Alexa 546 (Invitrogen A11060). Em seguida, as seções foram enxaguadas novamente três vezes em 1X PBS sob agitação, durante 10 minutos cada. As câmaras foram removidas e poucas gotas de meios de montagem de mowiol (Sigma-Aldrich 81381) foram adicionadas. Uma lamela foi colocada nas seções radiculares, que foram deixadas secar por 36 h a 4°C no escuro.
Fixação de Parplastos
Radiculos cultivados em placas de Petri por 6 dias foram fixados em paraformaldeído a 4% (em PBS 1X) durante a noite a 4°C e enxaguados duas vezes usando PBS 1X (Jackson, 1991). Os tecidos fixos foram desidratados em etanol, clareados em Histochoice Clearing Agent (HistoClear, Sigma Aldrich), e embutidos em Paraplast (Fisher). Os tecidos foram seccionados (6 μm espessura) em um microtomo Leica RM2255 e montados em lâminas SuperfrostPlus (Fisher).
Microscopia
Bright field and autofluorescence observations were performed using a Leica DM4500 microscope. Para autofluorescência, as imagens foram tiradas com o cubo de filtro “A” (faixa de excitação: UV; filtro de excitação: BP 340-380; filtro de supressão: LP 425). Foram observados cortes imunes com microscópios confocais: Zeiss LSM 510 ou Leica SP8. As paredes celulares foram visualizadas pela primeira vez por autofluorescência. O anticorpo secundário foi visualizado usando um laser de Hélio/Neon a 543 ou 561 nm respectivamente. As fotos foram feitas com uma câmera colorida Retiga 2000R (QIMAGING, Canadá) rodando o software de aquisição de imagens Volocity (Improvision, UK).
Author Contributions
SH, FD, MB, CB: aquisição de dados; SH, CP, AD: análise dos dados; SH, EG, CP, AD: elaboração do manuscrito.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Acknowledgments
Agradecemos a MRI (Montpellier RIO Imaging plateform), PHIV e La Gaillarde Plateforms pelo suporte técnico para imunolocalização e/ou imagens confocais e multifotônicas. SH é apoiado por uma bolsa de doutorado do CIRAD.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
A abreviações
ae, aerênquima; c, córtex; ed, endoderme; ep, epiderme; ex, ex, exoderme; gt, tecido moído; ic, córtex interno; L-LLR, raiz lateral grande; oc, córtex externo; sc, esclerênquima; SLR, raiz lateral pequena; st, estelo; T-LLR, raiz lateral grande do tipo fino; x, xilema.
Baluška, F.., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., e Barlow, P. W. (1993). Dimorfismo celular no córtex radicular do milho: envolvimento de microtubos, etileno e giberelina na diferenciação do comportamento celular em zonas de crescimento pós-mitótico. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., e Rost, T. L. (2002). Organização apical e maturação do córtex e do cilindro vascular em raízes de Arabidopsis thaliana (Brassicaceae). Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., e Peterson, C. A. (1988). Um procedimento de coloração fluorescente de azul berbereína-anilina para suberina, lignina e calose no tecido vegetal. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., e Gantet, P. (2010). Controle genético do desenvolvimento radicular no arroz, o cereal modelo. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Interacção entre SCARECROW, GA e LIKE HETEROCHROMATIN PROTEIN 1 em padrões de tecido terrestre na raiz de Arabidopsis. Planta J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). O gene SCARECROW regula uma divisão celular assimétrica que é essencial para gerar a organização radial da raiz da Arabidopsis. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Raízes de plantas: Crescimento, Atividade e Interação com os Solos. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., e Scheres, B. (2004). Análises em mosaico usando clones de ativação e deleção marcados dissecam a Arabidopsis SCARECROW ação em divisão celular assimétrica. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). O gene SHORT-ROOT controla a padronização radial da raiz da Arabidopsis através da sinalização radial. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). Um gene de quinase de repetição rica em leucina está envolvido na especificação das camadas celulares externas nas raízes do arroz. Planta J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). “Hibridação in-situ em plantas” em Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, e S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., e Armstrong, W. (1991). Evidência do envolvimento do etileno na formação de aerênquima em raízes adventícias de arroz (Oryza sativa L.). Novo Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., e Matsuoka, M. (2003). Isolamento e caracterização de um gene homeobox tipo WUSCHEL de arroz que é especificamente expresso nas células centrais de um centro quiescente no meristema apical da raiz. Planta J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., and Uchimiya, H. (1998). Dissecção celular do padrão de degradação da morte celular cortical durante a formação de aerênquima de raízes de arroz. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., e Yamazaki, K. (1977). Sobre a estrutura da raiz da coroa e da raiz lateral, e a conexão do vaso entre elas, em plantas de arroz. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., e Shibayama, B. (1965). Sobre a formação de primórdios radiculares laterais nas raízes da planta do arroz. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., e Yamada, N. (1972). Estudos sobre a fisiologia do desenvolvimento das raízes laterais nas raízes seminais do arroz. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: uma ferramenta de análise de imagem supervisionada para quantificação de parâmetros anatômicos da raiz do arroz. Frente. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Córtex radicular: variabilidade estrutural e funcional e respostas ao stress ambiental. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., e Benfey, P. N. (2005). A maturação do tecido terrestre da raiz é regulada por giberalina e SCARECROW e requer SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., e Périn, C. (2012). Navegando ao longo da rede genética dos tecidos terrestres radiculares. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Genética molecular do desenvolvimento radicular do arroz. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW está envolvida no posicionamento do nicho de células-tronco no meristema radicular da Arabidopsis. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., e Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 anos de análise de imagem. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., and Meyerowitz, E. M. (2010). A regeneração da Arabidopsis a partir de múltiplos tecidos ocorre através de uma via de desenvolvimento radicular. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., e Heidstra, R. (2010). SCHIZORIZA codifica um factor nuclear que regula a assimetria das divisões das células estaminais na raiz da Arabidopsis. Moeda. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). O movimento do fator de transcrição não-celular autônomo, SHORT-ROOT depende do sistema de endomembrana. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., and Seago, J. L. (2014). Anatomia e histoquímica de raízes e brotos em arroz selvagem (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar