US Pharm. 2012;37(5):HS-2-HS-7.
Pain é a razão mais comum de as pessoas procurarem atenção médica.1Um estudo recente estima que a dor afeta dezenas de milhões de americanos e custa aos Estados Unidos 635 bilhões de dólares anualmente por causa do aumento do consumo de cuidados médicos e custos indiretos de dias de trabalho perdidos e perda de produtividade.2 O tratamento da dor crônica com medicamentos como opióides é uma estratégia comum, mas a dor crônica pode persistir ou piorar apesar da terapia opióide agressiva. Este artigo visa esclarecer o fenómeno dos opiáceos que são prescritos para tratar a dor mas que causam dor nova ou paradoxalmente agravada, condição que se chama hiperalgesia induzida por opiáceos (OIH). A OIH pode ser definida mais formalmente como aumento da sensibilização nociceptiva causada pela exposição a opióides.3 A OIH difere nitidamente da tolerância, dependência, dependência e progressão da doença. A prevalência clínica da HIO é desconhecida.4
Diagnóstico e Apresentação
Um dos principais problemas no diagnóstico adequado da HIO é a estreita semelhança da condição com a tolerância aos opióides. Tolerância e OIH compartilham a característica de resposta analgésica reduzida à opióide, e provavelmente compartilham muitos dos mesmos mecanismos celulares.5 A tolerância pode ser superada aumentando a dose de opióides, enquanto que o mesmo aumento em um paciente com OIH resulta em dor agravada.4Adicionalmente, a tolerância tende a se desenvolver lentamente com o tempo, enquanto que o aumento da dor resultante do tratamento com opióides no paciente com OIH ocorre de forma rápida. Muitas vezes, a HIO difere da tolerância em que a intensidade da dor é mais forte do que a inicialmente relatada.6
A dor não tratada é outra possibilidade que deve ser descartada. Se a terapia com OIH for subótima, o aumento da dose deve levar ao alívio da dor; se a OIH estiver presente, o oposto deve ser verdadeiro. Para um diagnóstico preciso da OIH, a dor deve ser resolvida uma vez que o tratamento com o opióide ofendido seja interrompido.6 Para complicar ainda mais a situação, a hiperalgesia resultante da retirada do opióide é um fenômeno bem documentado.7 Como tal, a resolução da dor resultante da descontinuação do opióide na OIH não será mediada e exigirá paciência. Isto coloca seus próprios desafios tanto para o clínico quanto para o paciente.
OIH tende a apresentar outras características distintas (TABELA 1). A dor associada à OIH tende a ser mais difusa e de menor qualidade, e os estímulos nocivos tendem a ser mais dolorosos do que normalmente seria esperado. Na OIH, a dor frequentemente se manifesta em áreas que vão além da lesão ou dano tecidual. Na OIH, à medida que o tratamento opióide progride, a dor pode dar a ilusão de ficar pior do que originalmente relatado, apesar do tempo, repouso e outras medidas que normalmente permitiriam uma quantidade clinicamente relevante de cicatrização.5 Além disso, a alodinia tem sido demonstrada em vários estudos humanos e animais sobre a OIH.8

Etiologia
Existem várias teorias sobre a causa da OIH. A teoria que tem sido a mais pesquisada e que está atualmente recebendo maior atenção é o modelo neuroexcitatório. Acredita-se que certosopióides e seus metabólitos agonizam o receptor N-metil-D-aspartate(NMDA). A ativação do receptor de NMDA causa um influxo de cálcio que aumenta muito a excitabilidade do neurônio. Quando o receptor NMDA e os neurônios correspondentes estão mais ativos, eles podem transmitir moralmente impulsos dolorosos iniciados pela substância circulante Por outros estímulos nocivos. O glutamato é o agonista endógeno primário do receptor NDMA.9
Amparando esta teoria da pronocicepção modulada pela ativação do receptor NMDA são estudos mostrando alívio da OIH após a administração de antagonistas do receptor NMDA. Esses antagonistas não se ligam de forma competitiva ao sítio de fencyclidina no canal NMDA e bloqueiam o influxo de cálcio que ocorreria quando o receptor ligasse glutamato ou outroagonista.10 Estudos com animais e humanos demonstraram que os sujeitos com OIH que receberam cetamina, um receptorantagonista de NMDA, tiveram melhor pontuação durante os testes de estímulo de dor controlado. Em estudo isolado, ratos receberam injeções de morfina intratecal por vários dias até mostrarem OIH que era sensível ao calor. A administração de dizocilpina, um inibidor de NMDA, foi eficaz em pelo menos parcialmente reverter a hiperalgesia térmica.5 Outros receptoresantagonistas de NMDA, como o dextrometorfano, demonstraram algumas evidências de aliviar os estados hiperalgésicos através da inibição no receptor de NMDA.
Opioides, como codeína, hidromorfona e morfina, sofrem um número de biotransformações como parte do processo metabólico normal.a codeína é metabolizada em morfina pela enzima CYP2D6. A morfina émetabolizada em várias moléculas, mas é metabolizada principalmente através da glucuronidação em morfina-3-glucuronida (M3G) e, em menor extensão, morfina-6-glucuronida (M6G) (FIGURA 1).11
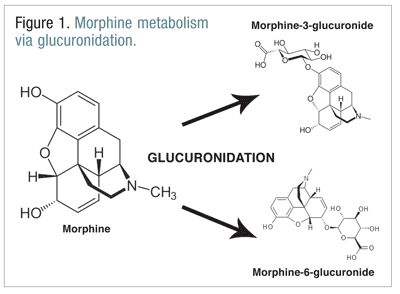
M6G é um metabólito terapeuticamente importante. Tem afinidade de receptor mu semelhante à da morfina e é capaz de produzir analgesia, depressão respiratória e outros efeitos semelhantes aos da morfina. O M3G, entretanto, não é um agonista no receptor mu, e tem pouca afinidade para o receptor mu em comparação com a morfina. Nãolikemorphine, M6G, e outros opióides, M3G é um agonista do NMDA. Através daglucuronidação, M3G é convertido a uma taxa cerca de seis vezes maior que a de M6G.12 Outros opióides têm sido implicados em ter atividade agonista de NMDA e efeitos neuroexcitatórios paradoxais.6
Amparando a teoria de que a OIH é causada pela atividade dos receptores do receptor mu opióide é evidência de que a OIH não é aliviada pela administração de um antagonista opióide (por exemplo, naloxona). Em pacientes que experimentaram a OIH durante a terapia opióide em altas doses, a administração de naloxona causou um agravamento da dor.13 Ao deslocar o teopioide do receptor mu, a naloxona impediu que o opióide ficasse com o que a analgesia era possível através da ativação do receptor mu, enquanto que, concomitantemente, a hiperalgesia agora permanecia incontestada.14
Dynorphin também pode estar envolvido no desenvolvimento da OIH.15Dynorphin é um peptídeo opióide endógeno que se liga principalmente ao receptor opióidekappa e, em menor extensão, aos receptores mu opióides e NMDAreceptores. Acredita-se que o agonismo da dynorphin do receptor opióide kappa e do receptor NMDA tem um papel na pronocicepção do OIHdes, apesar da presença de agonistas do receptor mu puro. Estudos têm mostrado que a reversão da dinorfina pode restaurar os efeitos analgésicos da morfina quando os sujeitos recebem um anti-soro de dinorfina. Além disso, a dynorphinis é conhecida por aumentar durante a administração prolongada de opióides. Dynorphinalso causa a liberação de neuropeptídeos excitatórios dentro de diferentes localizações no sistema nervoso central.
Opções de tratamento
Após o diagnóstico de OIH ter sido feito, há uma série de opções de tratamento a partir das quais se pode escolher cuidadosamente. Desde que a lesão inicial dolorosa ou dano tecidual tenha sido resolvida e os analgésicos apesar do tratamento com o opiáceo, a abordagem mais avançada é descontinuar o opiáceo ofensivo. Isto deve ser feito gradualmente para minimizar os efeitos adversos da retirada. Deve-se observar que a hiperalgesia pode provavelmente piorar no início do processo de descontinuação.16 Isso apresenta uma situação ética desafiadora na qual o clínico pode ter dificuldade em convencer o paciente de que a medicação prescrita para tratar a dor pode ter causado ou agravado a dor e que a dor pode piorar ainda mais antes de ser resolvida.17
Se a dor legítima persistir e for necessária alguma quantidade de analgesia com opióide, outras estratégias além da descontinuação total do opióide devem ser exploradas. Pacientes com HIO podem obter alívio pela redução da dose de opióides.4 Há relatos de pacientes que encontraram um equilíbrio aceitável de analgesia e alívio da redução da dose de opióides pela hiperalgesiauponemia.
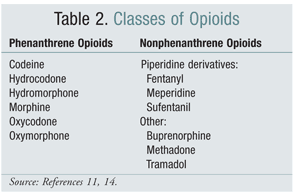
A troca de uma classe estrutural de opióides para outra tem sido uma opção eficaz para mitigar a HIO em alguns estudos. Estudos até o momento demonstraram que a OIH está mais fortemente associada aos opióides da classe de fenantreno (TABELA 2).4 A titulação do opióide fenantreno e a conversão para outro pode proporcionar a resolução da OIH. Codeína, hidromorfona, morfina e opioidsundergo glucuronidação estruturalmente semelhantes como parte do seu metabolismo. É possível evitar um metabolito de glucuronida ativador de receptoresNMDA ao mudar para um opióide estruturalmente único, como o fentanil. Nesta escrita, o OIH não foi demonstrado em ensaios envolvendo oximorfone.4
A suplementação da terapia opióide com um inibidor da ciclo-oxigenase 2 (COX-2)é outra estratégia que tem algum suporte. Ao reduzir a síntese daprostaglandina, os inibidores da COX-2 podem diminuir a sensibilização dos neurônios pronociceptivos. Os antiinflamatórios não-esteróides (AINEs) e inibidores da COX-2 parecem ter efeitos analgésicos independentes de sua capacidade de suprimir a síntese da prostaglandina de forma periférica.9 Os inibidores da COX-2 também demonstraram a capacidade de antagonizar o receptor NMDA. Centralmente, os AINE são capazes de antagonizar o receptor de NMDA através do bloqueio do glutamato, substância P e outros aminoácidos excitatórios. Independentemente disso, a ativação do receptor NMDA pode upregular a expressão COX-2.18
Dando a atenção que o receptor NMDA recebeu pelo seu papel noOIH, antagonizar este receptor pareceria ser uma estratégia de tratamento razoável. A cetamina tem sido muito pesquisada, mas os seus efeitos adversos podem ser graves. Enquanto antagoniza o NMDA e proporciona um efeito anestésico que promoveria analgesia, os efeitos colaterais são comuns, diversos e graves.19 Esses efeitos incluem taquiarritmia, hipertensão, deficiências cognitivas e reações psicomiméticas, incluindo mudanças de humor, sonhos vívidos, delírios, alucinações e sedação. A cetamina é eficaz na reversão da hiperalgesia e no aumento dos efeitos dos opióides em pacientes que recebem grandes doses, mas seus efeitos adversos impedem que seja uma opção de tratamento viável.
Dextrometorfano é outro antagonista dos receptores de NMDA que tem sido investigado para o tratamento da OIH. Um produto combinado contendo uma mistura de 1:1 de morfina e dextrometorfano foi estudado.20Estudos não conseguiram demonstrar que a terapia combinada poderia alcançar uma analgesia superior em comparação com a morfina sozinha. Ocorreram falhas terapêuticas similares em um estudo que utilizou uma mistura 2:1 dos mesmos agentes. Os estudos foram criticados por terem uma quantidade insuficiente de dextrometorfano para antagonizar adequadamente o receptor de NMDA.21O que permanece desconhecido é a dose de dextrometorfano necessária para aumentar a analgesia de um opióide ou prevenir a OIH causada pela ativação do receptor NMDA.
Metadona é um opióide com qualidades únicas que o tornam uma opção de tratamento da dor no paciente com OIH. Além de seus efeitos analgésicos através da ligação ao receptor mu opióide, a metadona é um antagonista fraco do receptor NMDA.4 Tem sido relatado que a adição de até mesmo uma dose baixa de metadona tem sido eficaz para reduzir a hiperalgesia. Em um caso, a adição de metadona em dose de fluxo (10 mg duas vezes ao dia) melhorou os relatos de dor marcadamente, com uma redução na dose total de opióides de 40% a 50%.22 A troca do opióide ofensor pela metadona tem sido uma estratégia de tratamento popular. Tramadol e meperidina também têm alguma atividade receptorantagonista de NMDA.
Outra modalidade de tratamento que tem algum potencial para tratar a OIH é a buprenorfina.23,24 A buprenorfina é um agonista opióide parcial no receptor mu e também tem atividade antagonista do receptor kappa.4Dynorphin, um agonista receptor kappa, é conhecido por aumentar o tratamento durável com opióides. A ativação do receptor kappaantagoniza em grande parte os efeitos mediados pelo receptor mu dos opióides.25 A utilidade clínica da buprenorfina no tratamento da OIH ainda não foi totalmente explicada.
Conclusão: Looking Forward
Muito trabalho ainda tem de ser feito antes de se poder declarar que a OIH é compreendida. O mecanismo celular exato e os caminhos de sinalização responsáveis por este fenômeno não estão definidos. Para complicar isto, existem relatórios contraditórios sobre se componentes específicos desempenham um papel chave, ou qualquer papel que seja. O grosso da pesquisa sobre a elucidação da fisiopatologia da OIH tem envolvido o modelo animal. Isto tem algum valor, mas a informação do modelo humano é escassa.
Um fraco entendimento da causa de uma condição gera um armamentário de opções de tratamento. A melhor estratégia disponível é a descontinuação total do opióide problemático, mas isto é de pouca utilidade para o paciente que necessita de alívio da dor tipo opióide. Várias outras modalidades de tratamento têm sido exploradas, mas todas elas se beneficiariam de um estudo mais aprofundado. A maioria dos estudos realizados em pacientes peri-cirúrgicos em humanos, em recuperação de dependentes de drogas e em modelos de dor experimental. Estes estudos não são desprovidos de valor, mas estas populações não reflectem a população de dor crónica. Outras limitações das opções de tratamento disponíveis incluem resultados pouco brilhantes, toxicidade excessiva apesar do sucesso moderado e pequenos estudos que produzem conclusões fracas.
Neste texto, vários estudos clínicos usando o antagonista do receptor NMDA memantine para tratar a HIOA estão em andamento ou planejados.26 Ainda assim, há relatos conflitantes quanto ao papel exato dos receptores de NMDA na HIOA. Pesquisas adicionais devem ser feitas para determinar os principais receptores e mecanismos responsáveis presentes na OIH. A ampliação da amostra de estudos ajudará a apoiar as conclusões já feitas sobre quais os agentes de tratamento responsáveis pela HIO e a eficácia do seu tratamento. A realização de estudos que focam a dor crônica, em vez de modelos de dor aguda, pode trazer informações clinicamente relevantes ao clínico.
Chapman e colegas têm levantado questões específicas que devem ser respondidas antes que o diagnóstico de HIO e o tratamento eficaz possam ser entregues ao paciente.27 Quais são as relações da dose e da duração da opiácea com a HIO? Com que tipo de dor, ou em que tipo de paciente, a OIH está mais apta a se desenvolver? Estas são as questões que devem orientar as pesquisas futuras.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalência e características do uso de opiáceos na população adulta americana. Dor. 2008;138:507-513.
2. Instituto de Medicina. Alívio da Dor na América: Um Plano para a Prevenção, Cuidados, Educação e Pesquisa da Transformação. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. Uma revisão abrangente da hiperalgesia induzida por opiáceos. Médico da dor. 2011;14:145-161.
5. Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Dor. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Hiperalgesia induzida por opióides: é clinicamente relevante para o tratamento de pacientes com dor? Enfermagem para o tratamento da dor. 2011;1-17.
7. Li X, Clark JD. Hyperalgesia during opioid abstinence: mediation by glutamate and substance P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioids and abnormal painperception: new evidence from a study of chronic opioid addicts and healthy subjects. Dependência de drogas dependentes do álcool. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hiperalgesia mediada por glutamato espinhal substância P receptor bloqueado pela inibição da ciclo-oxigenase espinhal. Ciência. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Apontando o receptor N-metil-D-aspartate para o controle da dor crônica. Estudos pré-clínicos com animais, experiência clínica recente e futuras direcções de investigação. J Sintomas de Dor Manejar. 2000;20:358-373.
11. Lötsch J. Metabolitos de opiáceos. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolites: clinical implications. Semin Anesth, Perioperative Med Dor. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Res. Cerebral 2006;1070:35-44.
14. Angst M, Clark JD. Opioid-induced hyperalgesia: uma revisão sistemática qualitativa. Anestesiologia. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promove dor anormal e tolerância antinociceptiva opióide espinhal. J Neuroci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Associação entre a percepção de dor térmica e a dose de opióides entre pacientes com dor crônica submetida a afilamento opióide. Med. da dor. 2010;11:1587-1598.
17. Silverman S. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Médico da dor. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. A ativação do receptor NMDA está associada à regulação da expressão da COX-2 na coluna vertebral dorsalhorn durante as entradas nociceptivas em ratos. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamine: uma introdução para o médico da dor e medicina paliativa. Médico da dor. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (combinação de morfinesulfato/dextrometorfano) no tratamento da dor crônica: três ensaios multicêntricos, randomizados, duplo-cegos e clínicos controlados falham em demonstrar o aumento da analgesia opióide ou redução na tolerância. Dor. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Terapias antagonistas combinados opioides-NMDA. Que vantagens oferecem para o controlo das síndromes da dor? As drogas. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Melhor efeito analgésico opióide após redução da dose de opiáceos. Analgésico da dor. 2008;9:724-727.
23. Barão MJ, McDonald PW. Redução significativa da dor em pacientes com dor crônica após a desintoxicação por opióides em altas doses. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Diferentes perfis de analgesia induzida por buprenorfina e anti-hiperalgesia em um modelo de dor humana. Pain. 2005;118:15-22.
25. Pan ZZ. Acções mu-opositivas do receptor kappa-opioide. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioid therapy for chronic pain. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid pharmacotherapy for chronic non-cancer pain in the United States: a research guidelinefor developing an evidence-base. J Dor. 2010;11:807-829.