Ligação de Hidrogênio Definição
Ligação de Hidrogênio é uma força atrativa entre um hidrogênio parcialmente carregado positivo e um átomo parcialmente carregado negativo (oxigênio e nitrogênio). Esta é uma ligação muito fraca e a resistência da ligação de hidrogênio (5-10 Kcal por ligação) é muito menor do que a resistência da ligação covalente. As ligações de hidrogênio são normalmente mostradas como linhas pontilhadas entre dois átomos. Por exemplo, a ligação de hidrogênio entre duas moléculas de água é mostrada abaixo:
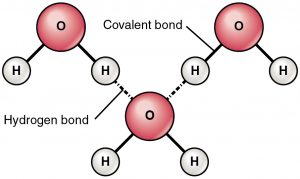
Razão da ligação de hidrogênio
Por causa da presença de átomos muito eletronegativos como oxigênio ou nitrogênio, o par de elétrons compartilhados entre oxigênio e hidrogênio são puxados para o átomo mais eletronegativo. Esta distribuição desigual do par de elétrons leva à formação de dois dipolos parciais. O hidrogênio parcialmente carregado positivo é então atraído pelo outro oxigênio ou nitrogênio parcialmente carregado negativo é conhecido como ligação de hidrogênio.
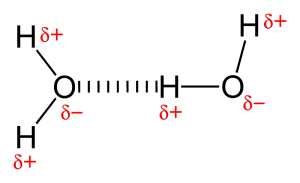
Tipos de ligação de hidrogênio
Ligação de hidrogênio pode ocorrer entre dois átomos da mesma molécula ou entre dois átomos de molécula diferente. Dependendo dessa ligação de hidrogênio são de dois tipos:
- Ligação intermolecular de hidrogênio
- Ligação intramolecular de hidrogênio
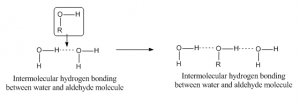
Ligação intermolecular de hidrogênio
Quando a ligação de hidrogênio ocorre entre átomos de molécula diferente, então é chamada de ligação intermolecular de hidrogênio. Para tal ligação uma molécula deve ter um hidrogênio parcialmente positivo como átomo aceitador e outra deve ter um átomo parcialmente negativo ou doador. Como por exemplo, a ligação de hidrogênio entre o aldeído e a molécula de água tem dado abaixo:
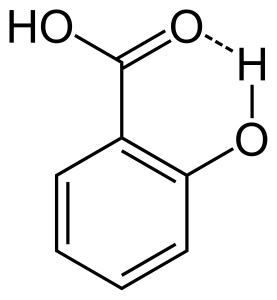
2. Ligação intramolecular de hidrogênio
Quando a ligação de hidrogênio ocorre entre dois átomos parcialmente carregados da mesma molécula que é chamada de ligação intramolecular de hidrogênio. Isto ocorre quando dois grupos funcionais estão presentes na mesma molécula e estão de tal forma que podem atrair um ao outro para formar a ligação de hidrogênio. Por exemplo, o ácido salicílico tem dois grupos funcionais: o álcool e o ácido carboxílico. Aqui a ligação intramolecular de hidrogênio ocorre entre o átomo de hidrogênio do grupo álcool e o átomo de oxigênio do grupo ácido carboxílico.
Efeitos da ligação de hidrogênio
Em ponto de ebulição
É esperado que o ponto de ebulição de substâncias com o mesmo peso molecular ou com peso molecular semelhante tenha o mesmo ponto de ebulição ou ponto de ebulição semelhante. O ponto de ebulição do éter e do alcano de peso molecular similar não estão muito distantes. Mas o ponto de ebulição dos álcoois é muito superior ao do éter de peso molecular semelhante. Isto pode ser explicado em termos de ligações de hidrogênio. Devido às ligações de hidrogênio no álcool, o ponto de ebulição sobe. É necessária energia extra para quebrar a ligação de hidrogênio antes que ela ferva. Como não há ligações de hidrogênio, alcanos e éteres têm baixo ponto de ebulição.

Em solubilidade
Álcoois são solúveis em água, mas alcanos não são. Isto porque, os compostos ligados ao hidrogênio intermolecular podem dissolver-se em solvente ligado ao hidrogênio intermolecular. Uma molécula polar como o álcool pode entrar em duas moléculas de água para formar a ligação de hidrogênio, enquanto uma substância não polar como os alcanos não pode. Contudo, com o aumento da cadeia de carbono nos álcoois, a solubilidade diminui à medida que a longa cadeia se interpõe no caminho para formar a ligação de hidrogênio.
Sumário
- Aglutinação de hidrogênio é uma força atrativa entre um hidrogênio parcialmente carregado positivo e um átomo parcialmente carregado negativo.
- Quando a ligação de hidrogênio ocorre entre átomos de diferentes moléculas então é chamada de ligação intermolecular de hidrogênio.
- Quando a ligação de hidrogênio ocorre entre dois átomos parcialmente carregados da mesma molécula que é chamada de ligação de hidrogênio intramolecular.
- Por causa da ligação de hidrogênio intermolecular o ponto de ebulição dos compostos polares é maior que nenhum composto polar com o mesmo a.
- Por causa da ligação de hidrogênio entre composto orgânico e água, a solubilidade é possível até certo ponto.