Introduction
Immunofluorescence (IF) uses antibodies and fluorescent detection to study the localization, relative expression, and activation states of target proteins in fixed cells or tissues. IF é amplamente utilizado em diversos campos de estudo.
IF pode ser usado para responder perguntas como:
- Que células ou tecidos expressam minha(s) proteína(s) alvo?
- Como a expressão e/ou ativação da minha proteína alvo muda em resposta às perturbações experimentais?
- Onde na célula/tecido está a proteína alvo localizada?
- Qual é a relação espacial entre as diferentes proteínas alvo no contexto da arquitetura celular ou tecidual?
Immunofluorescência engloba uma série de técnicas relacionadas que evoluíram ao longo do tempo. Todas estas técnicas alavancam o reconhecimento específico de alvos biológicos por anticorpos e detecção de repórteres fluorescentes na análise citométrica. Assegurar que a amostra biológica esteja bem preservada enquanto os antígenos alvo são acessíveis aos anticorpos é importante, mas pode apresentar desafios que variam dependendo da amostra, do alvo e do anticorpo.
Nesta página, compilamos recursos para ajudá-lo a navegar nos protocolos, responder a perguntas comuns e ajudá-lo a projetar experimentos IF bem sucedidos.
Selecionando a técnica e o protocolo IF correto
A técnica/protocolo IF ideal é influenciada pelo tipo de material biológico, as etapas de processamento da amostra, as propriedades do antígeno alvo, e o anticorpo particular que está sendo usado.
As considerações incluem:
- Os materiais de entrada podem ser linhas celulares de cultura, tecido congelado, ou tecido fixado em formol e incluído em parafina (FFPE).
- Para linhas celulares de cultura e células primárias, procure por anticorpos validados para imunofluorescência-imunocitoquímica (IF-IC).
- Em muitos laboratórios, “imunohistoquímica/IHC” é usado como um termo de captura para incluir tecido que é ou parafinado ou congelado, e pode ser usado para incluir tanto a detecção cromogénica como fluorescente. Em cellignal.com, as aplicações diferem entre preparações de tecido congeladas (IF-F) e incluídas em parafina.
- Para amostras de tecido FFPE, os anticorpos validados para imunohistoquímica (IHC-P) também podem ser usados com detecção fluorescente sem amplificação se o antígeno alvo for abundante, ou em IHC multiplexado (mIHC) com amplificação de sinal.
- Um anticorpo pode ser validado para uma ou mais das aplicações listadas acima. As recomendações de protocolo são o resultado de testes realizados por cientistas durante o processo de validação.
- Protocolos específicos do produto podem ser encontrados na página web de cada produto. Para anticorpos validados pelo IF, selecione “IF” na página do produto para visualizar os dados e o protocolo de validação do IF. Informação básica (diluições/ concentração de trabalho, aplicações validadas, reactividade de espécies, espécies hospedeiras) para cada anticorpo está incluída na página do produto.
- Os protocolos IF mais utilizados também podem ser encontrados na página do protocolo.
- Não precisa ou quer utilizar a detecção de fluorescência para as suas amostras de tecido? Uma abordagem alternativa é a detecção cromogénica, abordada na página do IHC.
Seleccionar anticorpos para IF: a importância da validação de anticorpos
Os melhores anticorpos produzem um sinal forte e específico com o mínimo de fundo. É importante escolher anticorpos que tenham sido validados na aplicação que vai utilizar. A validação de anticorpos em IF pode incluir experimentos de expressão positiva e negativa (usando linhas celulares knockout, modelos genéticos, CRISPR ou RNAi), manipulação experimental de localização da proteína alvo ou modificações pós-tradução, e otimização do protocolo.
O desempenho de um anticorpo varia de acordo com a aplicação. Um anticorpo que tem bom desempenho em um experimento western blot, por exemplo, pode ter ou não desempenho em IF. Durante o teste de novos anticorpos, alguns exibirão ligaduras menores fora do alvo; estes nunca são recomendados para IF ou outras aplicações nãoWB. Adicionalmente, um anticorpo pode ter um bom desempenho em tecido congelado, mas não em tecido FFPE, ou vice versa. A sensibilidade e desempenho dos anticorpos pode mudar dependendo de como a amostra é fixada e processada e das condições de trabalho dos anticorpos.
Após você ter decidido que tipo de amostras biológicas usar em sua experiência e como elas serão preparadas, a maneira mais fácil de pesquisar anticorpos no site cellsignal.com é primeiro selecionar a aplicação apropriada. Depois, você pode inserir termos de pesquisa ou selecionar outros atributos (como espécies hospedeiras, área de pesquisa, e mais) para refinar ainda mais sua pesquisa e selecionar um anticorpo que tenha sido validado na aplicação que você precisa.
Desenhando experimentos de controle para IF
Para estar confiante em seu projeto experimental e nos resultados, e que seu anticorpo está relatando fielmente seu alvo, os experimentos de controle positivo e negativo podem ser informativos. Por exemplo:
- Controles apenas secundários podem dizer se há ligação não específica de anticorpos secundários.
- Confirmar a especificidade de um anticorpo primário desenhando experimentos Knockout/siRNA ou comparando linhas celulares conhecidas que expressam e não expressam.
- Experimentos de alvo único são usados na configuração de imagens de desmixagem espectral. Este tipo de experimento pode ajudar a determinar se a falta de coloração é devida a um impedimento estéreo que ocorre quando 2 antígenos estão próximos um do outro.
- Trate amostras com fosfatase para confirmar anticorpos fosfóricos específicos apenas reconhecem o alvo fosforilado em IF.
- Se você suspeita de problemas com fixação ou permeabilização, verificar com um anticorpo que funcionou para o seu laboratório no passado pode ser útil na solução de problemas.
Cell Signaling Technology (CST) cientistas realizam rotineiramente esses tipos de controles como parte do nosso processo de validação (veja um exemplo). Pode valer a pena configurar controles similares em seu sistema modelo experimental, particularmente se você estiver tendo dificuldade em obter os resultados desejados.
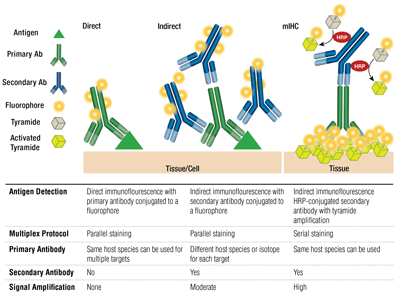
Anticorpos primários vs secundários e coloração direta vs indireta
Anticorpos primários fornecem reconhecimento específico do antígeno alvo. Os anticorpos secundários ligam-se aos anticorpos primários com base nas espécies em que foram criados. Anticorpos primários que foram criados em coelhos ou ratos são passíveis de detecção com anti-corpos secundários de coelhos ou ratos, respectivamente.
O par de um anticorpo primário e um anticorpo secundário (específico para as espécies hospedeiras do primário) que é conjugado a um fluoróforo é conhecido como coloração indireta. O uso de anticorpos primários conjugados a fluoróforos, sem anticorpos secundários, é conhecido como coloração direta. Os métodos de coloração direta economizam tempo e permitem a multiplexação usando anticorpos criados na mesma espécie hospedeira. A coloração indireta tradicionalmente oferece maior sensibilidade graças à amplificação de sinal que ocorre quando múltiplos anticorpos secundários se ligam a um único anticorpo primário.
Outras variações nestas técnicas estão disponíveis, como o uso de anticorpos primários biotinylated com avidina/streptavidin-conjugated fluorochrome. Os fragmentos de anticorpos secundários F(ab’)2 conjugados com fluorocromo (sem o domínio Fc) podem ajudar a reduzir o fundo. Em mIHC, os anticorpos secundários conjugados com peroxidase de rábano (HRP) são empregados para catalisar a deposição de conjugados fluoróforos de tiramida.
Anticorpos seletivos Fluoróforos
Anticorpos seletivos Fluoróforos
Quantos alvos/anticorpos podem ser multiplexados?
Multiplexação emprega a detecção de mais de 1 alvo de cada vez através de múltiplos anticorpos e detecção de diferentes comprimentos de onda (cores) para cada alvo. Para a coloração indireta, a capacidade de multiplexação depende do emparelhamento de anticorpos secundários conjugados a fluoróforos, específicos da espécie, com cada anticorpo primário. Os anticorpos do rato de isótipos distintos também podem ser multiplexados usando secundárias específicas do isótipo, permitindo a detecção de até 5 anticorpos do rato de uma só vez. Para a coloração direta, cada anticorpo primário deve ser acoplado a um fluoróforo diferente. Isto permite que múltiplos anticorpos da mesma espécie/isótipo sejam combinados e também permite a coloração “rato sobre rato”, uma vez que a ligação não específica dos secundários anti-rato ao tecido do rato não é uma preocupação.
Ao desenhar experiências com multiplex IF, as características espectrais do microscópio de fluorescência, incluindo fontes de excitação e conjuntos de filtragem disponíveis, devem ser tidas em conta para evitar a hemorragia espectral. Os modernos microscópios epifluorescentes e fluorescentes confocais têm tipicamente a capacidade de distinguir 3 ou mais canais.
Combinação de coloração de anticorpos com corantes ou etiquetas
Corantes celulares que são aplicados pós-fixação ou etiquetas de células vivas fixáveis podem ser incorporados num fluxo de trabalho IF. A etiquetagem de organelas é frequentemente utilizada para verificar a localização subcelular de um alvo. Etiquetas expressas, como GFP, são frequentemente usadas para rastrear células transfectadas ou em experiências com mosaicos; se o sinal de fluorescência GFP for baixo, um anticorpo anti-GFP pode ser usado em IF. Usando corantes ou proteínas fluorescentes ocuparão os canais de fluorescência, deixando menos disponíveis para anticorpos.
Selecionar fluoróforos para o seu experimento
Isso dependerá das características espectrais da fonte de excitação e da filtragem de excitação/emissão disponível para você. Avalie o perfil de excitação e emissão do fluoróforo antes de executar seu experimento para evitar o sangramento por fluorescência. A CST oferece uma variedade de anticorpos primários e secundários conjugados ao fluoróforo, incluindo corantes na linha Alexa Fluor®.
Preparação da amostra
Tissue
Seções de tecido podem ser preparadas ou por congelamento rápido em meio com temperatura de corte ótima (OCT) ou por fixação e incorporação em parafina. As amostras congeladas podem ser seccionadas usando um criostato e deixadas secar ao ar na lâmina 10 a 15 minutos antes da fixação antes do próximo passo. Para amostras de tecido FFPE, os requisitos para as etapas de colheita, fixação e incorporação em parafina podem variar no tipo de tecido individual.
Tecido congelado vs tecido FFPE
Em geral, o tecido FFPE dá uma melhor morfologia do que o tecido congelado incorporado em OCT. Isto pode facilitar a quantificação de células positivas ou a identificação de limites entre manchas. O tecido FFPE é também muito estável; uma vez incorporado, os blocos de tecido podem ser armazenados durante anos. Este tipo de tecido também é mais fácil de enviar entre laboratórios, e é o método de processamento preferido para amostras de patologia humana.
Por outro lado, o tecido FFPE passa por várias etapas extras de processamento que reduzem a quantidade total de antígeno devido à degradação da proteína, requerem etapas de desmascaramento para detectar o antígeno remanescente e exacerbam a autofluorescência induzida por aldeídos. A menos que se trabalhe com uma proteína muito abundante, o antígeno remanescente pode ser difícil de detectar por IF indireto e pode requerer amplificação para produzir uma coloração adequada. Também é possível que a recuperação do antígeno possa desmascarar antígenos que normalmente não seriam detectados e um anticorpo que, de outra forma, dê o padrão de coloração esperado pode dar uma coloração inespecífica. É igualmente possível trabalhar com um alvo onde é necessário um método específico de recuperação de antígenos para detectar o epitopo alvo. Portanto, é importante considerar como um anticorpo é validado e que passos são necessários para usá-lo.
No caso de tecido congelado com OCT, a redução do processamento é priorizada em relação à morfologia. Este é o método mais rápido para obter resultados imunológicos, pois as lâminas estão prontas para uso no momento em que o tecido é cortado e há menos etapas de processamento antes da incorporação. Há menos degradação proteica e mais antigénio disponível para ligar os anticorpos sem necessidade de quaisquer etapas adicionais e duras de recuperação. Como este método não requer amplificação, é mais sensível à qualidade do tecido. O tipo de fixação (álcool vs aldeído), duração (alguns alvos como os factores de transcrição requerem um tempo de fixação mais curto), e a idade do tecido (especialmente após a secção) são todos importantes e irão variar de acordo com o alvo. Finalmente, trabalhar com tecido congelado dá mais flexibilidade na seleção do alvo, pois o processamento pode ocorrer após a secção, permitindo uma maior personalização no desenho do ensaio.
Células cultivadas
Células devem ser semeadas em um material de suporte compatível com microscopia de fluorescência. Os suportes típicos incluem pratos de cultura de células de fundo de vidro, lamelas de vidro (mantidas em pratos de cultura de plástico) preparadas com componentes de polisina e/ou matriz extracelular para suportar a cultura de células aderentes, e câmaras multipoços disponíveis comercialmente montadas em lâminas de vidro que são compatíveis com microscópios.
Note que as condições de cultura de células podem afetar a saúde celular, morfologia e expressão/localização de sua proteína alvo e, em última instância, ditar a qualidade de seus dados IF. Assegure-se de que suas células são saudáveis verificando regularmente os meios de cultura quanto a mudanças de pH e inspecionando sinais de estresse celular (como células multinucleadas) com baixa ampliação em um microscópio. Verifique também se a confluência das células é apropriada para o tipo de célula e alvo.
A fixação da amostra
O fixador ideal preserva um instantâneo “semelhante à vida” enquanto pára rapidamente o processo degradante da autólise por reticulação e inibição de enzimas endógenas, e apresenta o antígeno para reconhecimento pelo anticorpo. Infelizmente, não há um método de fixação único que funcione idealmente em cada amostra e para cada antígeno. Mesmo antígenos diferentes na mesma proteína alvo podem apresentar diferenças entre os protocolos. É por isso que o melhor protocolo pode variar não só por tipo de amostra, mas também por epitópo (e anticorpo).
Tissue
Para tecido fresco congelado, as secções que foram congeladas e seccionadas por criostato devem agora ser tratadas com fixador. Alternativamente, amostras de tecido podem ser preservadas através da fixação primeiro com perfusão transcárdica ou imersão, pós fixação e criopreservação, seguida por congelamento e secção.
No processamento de tecido FFPE, o tecido é preservado através da fixação por imersão com formalina (ou outro fixador à base de aldeídos) ou com perfusão como acima, seguida por incorporação e secção de parafina. Antes da incubação com anticorpos, as secções devem ser submetidas a desparafinização, reidratação e recuperação de antigénios para permitir o acesso dos anticorpos à amostra e ligar as moléculas alvo.
Células
Resaguardar as células com meios quentes sem proteínas ou PBS imediatamente antes da fixação pode prevenir a precipitação de proteína extracelular e detritos. A fixação rápida é realizada pela troca rápida de meios por solução fixadora.
Fixação de aldeído vs fixação de álcool
Fixadores à base de aldeído como formaldeído, formalina (uma mistura de formaldeído dissolvido com uma porcentagem menor de metanol), e glutaraldeído são mais comumente usados quando a preservação da estrutura é fundamental. Para a maioria dos anticorpos, a CST recomenda a fixação com formaldeído a 4% (livre de metanol). Os aldeídos reagem com e cruzam as aminas primárias das proteínas celulares e estabilizam a amostra. Além disso, as enzimas celulares, incluindo fosfatases e proteases, são desativadas por reticulação. Os aldeídos cruzam a membrana plasmática e fixam as proteínas solúveis melhor que os álcoois, mas alguns alvos podem perder sua antigenicidade com o reticulado de aldeídos.
Desidratante/desnaturante fixadores de álcool, como o metanol, deslocam a água ao redor das macromoléculas celulares, resultando em sua desnaturação e precipitação in situ. A desnaturação da proteína alvo pode expor epitopos enterrados, tornando esta abordagem vantajosa em relação à fixação de aldeídos para alguns anticorpos. Entretanto, fixadores desidratantes são menos adequados para alvos solúveis e anticorpos específicos do estado de modificação, como os anticorpos fosfo-anti-corpos. Verifique na folha de dados do produto o método de fixação ideal.
Se for usado um fixador reticulado, a membrana plasmática ainda estará intacta, tornando os alvos intracelulares inacessíveis aos anticorpos. Portanto, a permeabilização deve ser realizada após a fixação de reticulação, a menos que seus anticorpos reconheçam epitopos extracelulares. O método de permeabilização ideal varia dependendo do anticorpo; verifique sempre na página do produto o protocolo recomendado.
O uso de Triton® X-100 de permeabilização após a fixação é comum. O Triton e outros detergentes, como NP-40, TWEEN®, Saponin, Digitonin e DOTMAC, interagem com as membranas celulares para criar tamanhos variáveis de “poros” e permitir o acesso de anticorpos.
Alternativamente, a permabilização do álcool com etanol ou metanol pode ser realizada após a etapa de fixação. Este método combina a fixação rápida de fixadores reticulados com desnaturação e delipidação intermediária da proteína da membrana. Isto pode melhorar o sinal para certos alvos, particularmente aqueles associados com organelas ou o citoesqueleto.
Que condições de fixação/perminação eu uso quando a multiplexação?
Se você está multiplexando com anticorpos que requerem diferentes protocolos CST, você pode precisar priorizar qual anticorpo usar em suas condições ideais. Um exemplo de otimização de pedidos realizada em mIHC é mostrado nesta nota de aplicação (PDF). Executar um teste em pequena escala comparando diferentes protocolos pode ser informativo antes de aumentar a escala dos seus experimentos.
Selecionar um reagente de bloqueio
A recomendação mais comum é 5% de soro normal de cabra (ou soro da mesma espécie do anticorpo secundário) em PBS + 0,3% de Triton® X-100. Verifique na ficha técnica o agente de bloqueio recomendado.
Se os receptores Fc estiverem presentes na amostra, o sinal de anticorpos virá de uma mistura de reconhecimento de alvo específico (através do local de ligação do antigénio/região variável do anticorpo), bem como da absorção não específica da ligação de cadeia pesada de anticorpos aos receptores Fc. A IgG total presente nos receptores Fc do soro animal bloqueia os receptores Fc para evitar a ligação de anticorpos primários e secundários e reduzir o ruído de fundo. A escolha de fragmentos de F(ab’)2 conjugados com fluoróforo também evitará a ligação dos receptores Fc para o anticorpo secundário (mas não para o anticorpo primário)
Em outras aplicações baseadas em anticorpos, tais como a mancha ocidental, os passos de bloqueio reduzem o sinal de fundo causado pela ligação não específica e de menor afinidade dos anticorpos primários e secundários a outros locais que não o seu alvo pretendido. No entanto, descobrimos que os anticorpos monoclonais recombinantes de coelho que foram rigorosamente testados em IF têm um bom desempenho em muitas amostras com ou sem bloqueio. Em última análise, a escolha de anticorpos de qualidade validados em imunofluorescência vai muito longe para evitar ruídos de fundo.
Concentração de anticorpos e relação sinal/ruído em IF
A relação sinal/ruído (S/N) está relacionada com a especificidade e sensibilidade de um anticorpo em uma aplicação particular. A S/N pode ser calculada comparando o “sinal” de intensidades de fluorescência em células que expressam o alvo de interesse com o “ruído de fundo” de células que não têm expressão. Se o anticorpo for aplicado em uma concentração muito baixa, o sinal de fluorescência será muito fraco para distinguir do ruído de fundo. Por outro lado, uma concentração excessivamente alta contribuirá para a coloração do fundo, diminuindo o S/N. Verifique sempre a ficha do produto para a diluição recomendada, que é baseada em titulações realizadas durante a validação do anticorpo.
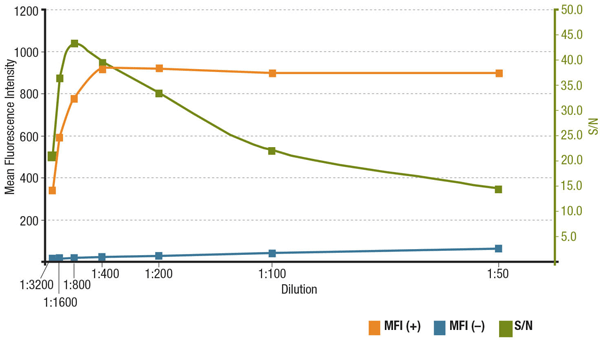
Análise de S/N para MUC1 (D9O8K) XP® Coelho mAb #14161 diluição. Quantificação da Intensidade Média de Fluorescência na expressão (MFI(+), laranja) células ZR-75-1 e células não-expressoras (MFI(-), azul) HCT 116, e calculado S/N (verde).
Analyis de S/N para MUC1 (D9O8K) XP® Coelho mAb #14161 diluição. Quantificação da Intensidade Média de Fluorescência na expressão (MFI(+), laranja) ZR-75-1 células e células não Expressoras (MFI(-), azul) HCT 116 células, e calculado S/N (verde).
Tempo de incubação de anticorpos
Em geral, as incubações nocturnas a 4°C resultam em forte sinal. A alteração do tempo de incubação e da temperatura pode alterar o sinal e o S/N. Anticorpos diferentes podem responder a condições de incubação alteradas de forma diferente; para mais, veja este blog post.
Preciso de acesso a um microscópio confocal para realizar IF?
IF pode ser realizado em qualquer microscópio de fluorescência com fonte de excitação e filtragem apropriada, incluindo microscópios confocais epifluorescentes, de varrimento e de disco giratório. A imunofluorescência também é geralmente compatível com técnicas de fluorescência especializadas, incluindo fluorescência de reflexão interna total (TIRF), microscopia de folha de luz e algumas técnicas de super-resolução.
Compatibilidade com a triagem automatizada de alto rendimento/análise de alto conteúdo
Cada anticorpo aprovado para IF-IC pode ser utilizado na triagem de alto rendimento (HCS) e na análise de alto conteúdo (HCA). Estes experimentos são baseados em técnicas padrão de IF, incorporando automação.
Correr em problemas com seu experimento de IF? Clique aqui para um guia de solução de problemas.
Cell Signaling Technology, CST, e XP são marcas registradas da Cell Signaling Technology, Inc. Todas as outras marcas registradas são de propriedade de seus respectivos proprietários.