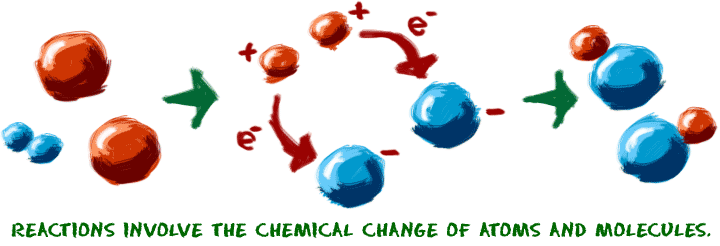
Să începem cu ideea de reacție chimică. Reacțiile au loc atunci când două sau mai multe molecule interacționează și moleculele se modifică. Legăturile dintre atomi sunt rupte și create pentru a forma noi molecule. Asta este. Ce molecule sunt acestea? Cum interacționează ele? Ce se întâmplă? Posibilitățile sunt infinite.
Când încercați să înțelegeți reacțiile chimice, imaginați-vă că lucrați cu atomii. Imaginați-vă că elementele constitutive sunt chiar în fața dumneavoastră, pe masă. Uneori folosim jucăriile noastre de chimie pentru a ne ajuta să vizualizăm mișcarea atomilor. Conectăm și deconectăm micii conectori care reprezintă legăturile chimice. Există câteva puncte cheie pe care trebuie să le cunoașteți despre reacțiile chimice:
1. Trebuie să aibă loc o schimbare chimică. Se începe cu o moleculă și se transformă în alta. Se fac sau se rup legături chimice pentru a crea o nouă moleculă. Un exemplu de reacție chimică este ruginirea unui coș de gunoi din oțel. Această ruginire are loc deoarece fierul (Fe) din metal se combină cu oxigenul (O2) din atmosferă. Legăturile chimice sunt create și distruse pentru a obține în final oxidul de fier (Fe2O3).  Când un frigider sau un aparat de aer condiționat răcește aerul, nu are loc nicio reacție în moleculele de aer. Schimbarea temperaturii este o schimbare fizică. Atunci când topiți un cub de gheață, este o schimbare fizică. Când puneți înălbitor în mașina de spălat pentru a vă curăța hainele, o schimbare chimică descompune moleculele din pete.
Când un frigider sau un aparat de aer condiționat răcește aerul, nu are loc nicio reacție în moleculele de aer. Schimbarea temperaturii este o schimbare fizică. Atunci când topiți un cub de gheață, este o schimbare fizică. Când puneți înălbitor în mașina de spălat pentru a vă curăța hainele, o schimbare chimică descompune moleculele din pete.
2. O reacție poate include atomi, ioni, compuși sau molecule ale unui singur element. Trebuie să vă amintiți că o reacție chimică poate avea loc cu orice, atâta timp cât are loc o schimbare chimică. Dacă puneți într-o încăpere hidrogen pur gazos (H2) și oxigen pur gazos, acestea ar putea fi implicate într-o reacție pentru a forma apă (H2O). Cu toate acestea, va fi în cantități foarte, foarte mici. Dacă ați adăuga o scânteie, aceste gaze ar fi implicate într-o reacție chimică violentă care ar duce la o explozie uriașă (exotermă). O altă reacție chimică ar putea include ioni de argint (Ag+). Dacă amestecați o soluție cu ioni de argint cu o soluție care are ioni de clorură (Cl-), se va forma un precipitat de clorură de argint (AgCl) care va cădea din soluție. 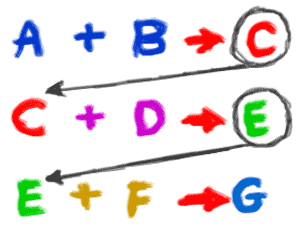 3. Reacțiile simple au loc adesea ca parte a unei serii mai mari de reacții. Atunci când o plantă produce zaharuri, pot exista până la o duzină de reacții chimice pentru a trece prin ciclul Calvin și pentru a crea (sintetiza) în cele din urmă molecule de glucoză (C6H12O6). Exemplul de ruginire pe care l-am folosit mai devreme v-a arătat doar reactanții inițiali și produsele finale ale reacției chimice. Au existat mai multe reacții intermediare în care au fost create și distruse legături chimice. Exemplul cu clorura de argint s-a concentrat doar asupra ionilor. În realitate, cele două soluții au fost create atunci când două săruri s-au disociat (despărțit în ioni) în apă.
3. Reacțiile simple au loc adesea ca parte a unei serii mai mari de reacții. Atunci când o plantă produce zaharuri, pot exista până la o duzină de reacții chimice pentru a trece prin ciclul Calvin și pentru a crea (sintetiza) în cele din urmă molecule de glucoză (C6H12O6). Exemplul de ruginire pe care l-am folosit mai devreme v-a arătat doar reactanții inițiali și produsele finale ale reacției chimice. Au existat mai multe reacții intermediare în care au fost create și distruse legături chimice. Exemplul cu clorura de argint s-a concentrat doar asupra ionilor. În realitate, cele două soluții au fost create atunci când două săruri s-au disociat (despărțit în ioni) în apă.
Wikipedia: Reacții chimice
Encyclopedia.com: Chemical Reactions
Rhode Island College: Reactions