HormonfrisättningRedigera
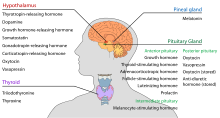
Hypotalamus har en central neuroendokrin funktion, främst genom sin kontroll av den främre hypofysen, som i sin tur reglerar olika endokrina körtlar och organ. Frisättande hormoner (även kallade frisättande faktorer) produceras i hypotalamiska kärnor och transporteras sedan längs axoner till antingen median eminence eller bakre hypofysen, där de lagras och frisätts efter behov.
Främre hypofysen
I den hypotalamiska-adenohypofysära axeln frisätts frigörande hormoner, även kallade hypofysiotropa eller hypotalamiska hormoner, från median eminens, en förlängning av hypotalamus, till det hypofysära portalsystemet, som transporterar dem till främre hypofysen där de utövar sina reglerande funktioner på utsöndringen av adenohypofysära hormoner. Dessa hypofysiotropa hormoner stimuleras av parvocellulära neurosekretoriska celler i hypotalamus periventrikulära område. Efter att de hypofysiotropa hormonerna har släppts ut i kapillärerna i den tredje ventrikeln, färdas de genom den så kallade hypotalamo-hypofysiska portalcirkulationen. När de når sin destination i den främre hypofysen binder dessa hormoner till specifika receptorer som finns på hypofyscellernas yta. Beroende på vilka celler som aktiveras genom denna bindning kommer hypofysen antingen att börja eller sluta utsöndra hormoner till resten av blodomloppet.
| Hormon som utsöndras | Abkortning | Produceras av | Effekt |
|---|---|---|---|
| Thyrotropinfrisättande hormon (Prolaktinfrisättande hormon) |
TRH, TRF, eller PRH | Parvocellulära neurosekretoriska celler i den paraventrikulära kärnan | Stimulerar frisättning av sköldkörtelstimulerande hormon (TSH) från främre hypofysen (främst) Stimulerar frisättning av prolaktin från främre hypofysen |
| Cortikotropin-frisättande hormon | CRH eller CRF | Parvocellulära neurosekretoriska celler i den paraventrikulära kärnan | Stimulera frisättning av adrenokortikotropt hormon (ACTH) från främre hypofysen |
| Dopamin (Prolaktin-hämmande hormon) |
DA eller PIH | Dopaminneuronerna i den bågformade kärnan | Hämmar frisättning av prolaktin från den främre hypofysen |
| Växt-hormonfrisättande hormon | GHRH | Neuroendokrina neuronerna i den bågformiga kärnan | Stimulerar tillväxt-hormon (GH) från främre hypofysen |
| Gonadotropinfrisättande hormon | GnRH eller LHRH | Neuroendokrina celler i det preoptiska området | Stimulerar follikel-stimulerande hormon (FSH) från främre hypofysen Stimulera luteiniserande hormon (LH) från främre hypofysen |
| Somatostatin (tillväxthormonhämmande hormon) |
SS, GHIH, eller SRIF | Neuroendokrina celler i den periventrikulära kärnan | Hämmar frisättning av tillväxthormon (GH) från främre hypofysen Hämmar (måttligt) frisättning av sköldkörtelstimulerande hormon (TSH) från främre hypofysen |
Avsevärda hormoner som utsöndras från den mediala eminensen är vasopressin, oxytocin och neurotensin.
Bakre hypofysen
I den hypotalamisk-neurohypofysiska axeln frisätts neurohypofysiska hormoner från bakre hypofysen, som egentligen är en förlängning av hypotalamus, till cirkulationen.
| Hormon som utsöndras | Abkortning | Produceras av | Effekt |
|---|---|---|---|
| Oxytocin | OXY eller OXT | Magnocellulära neurosekretoriska celler i den paraventrikulära kärnan och supraoptiska. Nucleus | Uteruskontraktion Laktation (nedsläppningsreflex) |
| Vasopressin (antidiuretiskt hormon) |
ADH eller AVP | Magnocellulära och parvocellulära neurosekretoriska celler i den paraventrikulära kärnan, magnocellulära celler i supraoptiska kärnan | Ökat vattengenomsläpplighet hos cellerna i distala tubuli och collecting duct i njuren och möjliggör därmed vattenreabsorption och utsöndring av koncentrerad urin |
Det är också känt att hypotalamus-hypofysen-njurebarksaxelns (HPA) hormoner är relaterade till vissa hudsjukdomar och hudhomeostasen. Det finns bevis som kopplar hyperaktivitet av HPA-hormoner till stressrelaterade hudsjukdomar och hudtumörer.
StimuleringRedigera
Hypotalamus samordnar många hormonella och beteendemässiga cirkadiska rytmer, komplexa mönster av neuroendokrina utflöden, komplexa homeostatiska mekanismer och viktiga beteenden. Hypotalamus måste därför reagera på många olika signaler, varav en del genereras externt och en del internt. Deltavågssignaler som uppstår antingen i thalamus eller i cortex påverkar utsöndringen av frisättande hormoner; GHRH och prolaktin stimuleras medan TRH hämmas.
Hypotalamus reagerar på:
- Ljus: Dagslängd och fotoperiod för reglering av cirkadiska och säsongsmässiga rytmer
- Olfaktoriska stimuli, inklusive feromoner
- Steroider, inklusive gonadala steroider och kortikosteroider
- Neuralt överförd information som kommer särskilt från hjärtat, det enteriska nervsystemet (i mag-tarmkanalen) och fortplantningsorganen.
- Autonoma inflöden
- Blodburna stimuli, inklusive leptin, ghrelin, angiotensin, insulin, hypofyshormoner, cytokiner, plasmakoncentrationer av glukos och osmolaritet etc.
- Stress
- Invaderar mikroorganismer genom att öka kroppstemperaturen, återställer kroppens termostat uppåt.
Olfaktoriska stimuliRedigera
Olfaktoriska stimuli är viktiga för sexuell reproduktion och neuroendokrin funktion hos många arter. Om till exempel en dräktig mus utsätts för urin från en ”främmande” hane under en kritisk period efter samlag misslyckas dräktigheten (Bruce-effekten). Under samlag bildar en mushona alltså ett exakt ”luktminne” av sin partner som består i flera dagar. Feromonala signaler hjälper till att synkronisera brunsten hos många arter; hos kvinnor kan synkroniserad menstruation också uppstå av feromonala signaler, även om feromonernas roll hos människor är omtvistad.
Blodburna stimuliRedigera
Peptidhormoner har viktiga influenser på hypotalamus, och för att kunna göra det måste de passera genom blod-hjärnbarriären. Hypotalamus avgränsas delvis av specialiserade hjärnregioner som saknar en effektiv blod-hjärnbarriär; det kapillära endotelet på dessa platser är fenestrerat för att tillåta fri passage av även stora proteiner och andra molekyler. Några av dessa områden är platser för neurosekretion – neurohypofysen och den mediala eminensen. Andra är dock platser där hjärnan tar prover på blodets sammansättning. Två av dessa platser, SFO (subfornical organ) och OVLT (organum vasculosum of the lamina terminalis) är så kallade circumventrikulära organ, där neuronerna är i intim kontakt med både blod och CSF. Dessa strukturer är tätt vaskulariserade och innehåller osmoreceptiva och natriumreceptiva neuroner som kontrollerar drickande, vasopressinfrisättning, natriumutsöndring och natriumapptit. De innehåller också neuroner med receptorer för angiotensin, atriell natriuretisk faktor, endotelin och relaxin, som alla är viktiga för regleringen av vätske- och elektrolytbalansen. Neuroner i OVLT och SFO projicerar till den supraoptiska kärnan och den paraventrikulära kärnan och även till preoptiska hypotalamiska områden. De circumventrikulära organen kan också vara den plats där interleukiner verkar för att framkalla både feber och ACTH-sekretion, via effekter på paraventrikulära neuroner.
Det är inte klart hur alla peptider som påverkar den hypotalamiska aktiviteten får den nödvändiga tillgången. När det gäller prolaktin och leptin finns det bevis för ett aktivt upptag vid plexus choroidus från blodet till cerebrospinalvätskan (CSF). Vissa hypofyshormoner har ett negativt återkopplingsinflytande på hypotalamisk sekretion; till exempel återkopplar tillväxthormonet till hypotalamus, men hur det kommer in i hjärnan är oklart. Det finns också bevis för att prolaktin verkar centralt.
Fynd har visat att sköldkörtelhormon (T4) tas upp av de hypotalamiska gliacellerna i infundibulära kärnan/median eminens och att det här omvandlas till T3 av typ 2 deiodinas (D2). Därefter transporteras T3 till de neuroner som producerar tyrotropinfrisättande hormon (TRH) i den paraventrikulära kärnan. Sköldkörtelhormonreceptorer har hittats i dessa neuroner, vilket tyder på att de verkligen är känsliga för T3-stimuli. Dessutom uttryckte dessa neuroner MCT8, en sköldkörtelhormontransportör, vilket stöder teorin att T3 transporteras in i dem. T3 skulle sedan kunna binda till sköldkörtelhormonreceptorn i dessa neuroner och påverka produktionen av tyrotropinfrisättande hormon och därmed reglera produktionen av sköldkörtelhormon.
Hypothalamus fungerar som en slags termostat för kroppen. Den ställer in en önskad kroppstemperatur och stimulerar antingen värmeproduktion och retention för att höja blodtemperaturen till en högre inställning eller svettning och vasodilatation för att kyla ner blodet till en lägre temperatur. All feber beror på en förhöjd inställning i hypotalamus; förhöjda kroppstemperaturer som beror på någon annan orsak klassificeras som hypertermi. I sällsynta fall orsakar direkta skador på hypotalamus, t.ex. till följd av en stroke, feber; detta kallas ibland hypotalamisk feber. Det är dock vanligare att sådana skador orsakar onormalt låga kroppstemperaturer.
SteroiderRedigera
Hypotalamus innehåller neuroner som reagerar starkt på steroider och glukokortikoider – (binjurens steroidhormoner som frisätts som svar på ACTH). Den innehåller också specialiserade glukoskänsliga neuroner (i arcuate nucleus och ventromedial hypothalamus) som är viktiga för aptiten. Det preoptiska området innehåller termokänsliga neuroner; dessa är viktiga för TRH-sekretionen.
NeuralEdit
Oxytocinsekretion som svar på amning eller vagino-cervikal stimulering medieras av några av dessa vägar; vasopressinsekretion som svar på kardiovaskulära stimuli som härrör från kemoreceptorer i halskotan och aortabågen, och från receptorer för förmaksvolym med lågt tryck, medieras av andra. Hos råttan orsakar stimulering av vagina också prolaktinsekretion, vilket leder till pseudo-graviditet efter en infertil parning. Hos kaninen framkallar samlag reflexmässig ägglossning. Hos får kan stimulering av livmoderhalsen i närvaro av höga östrogennivåer framkalla ett moderligt beteende hos en jungfrulig tacka. Alla dessa effekter förmedlas av hypotalamus, och informationen överförs huvudsakligen via ryggmärgsbanor som vidarebefordras till hjärnstammen. Stimulering av bröstvårtorna stimulerar frisättningen av oxytocin och prolaktin och undertrycker frisättningen av LH och FSH.
Kardiovaskulära stimuli överförs av vagusnerven. Vagusmuskeln förmedlar också en mängd olika visceral information, inklusive t.ex. signaler som härrör från magens distension eller tömning, för att undertrycka eller främja ätande, genom att signalera frisättning av leptin respektive gastrin. Även denna information når hypotalamus via reläer i hjärnstammen.
Den hypotalamiska funktionen reagerar dessutom på – och regleras av – nivåerna av alla tre klassiska monoaminneurotransmittorer, noradrenalin, dopamin och serotonin (5-hydroxitryptamin), i de banor från vilka den får innervation. Till exempel har noradrenerga inflöden från locus coeruleus viktiga reglerande effekter på nivåerna av kortikotropinfrisättande hormon (CRH).
Kontroll av födointagRedigera
| Peptider som ökar ätandet. beteende |
Peptider som minskar födningsbeteende |
|---|---|
| Ghrelin | Leptin |
| Neuropeptid Y | (α,β,γ)-Melanocyt-stimulerande hormoner |
| Agouti-relaterad peptid | Kokain- och amfetaminreglerade transkriptpeptider |
| Orexiner (A,B) | Corticotropinfrisättande hormon |
| Melaninkoncentrerande hormon | Cholecystokininin |
| Galanin | Insulin |
| Glukagon-like peptide 1 |
Den yttersta laterala delen av den ventromediala kärnan i hypotalamus ansvarar för kontrollen av födointaget. Stimulering av detta område orsakar ökat matintag. Bilateral lesion av detta område orsakar fullständigt upphörande av födointag. De mediala delarna av kärnan har en kontrollerande effekt på den laterala delen. Bilateral lesion av den mediala delen av den ventromediala kärnan orsakar hyperfagi och fetma hos djuret. Ytterligare lesion av den laterala delen av den ventromediala kärnan hos samma djur ger fullständigt upphörande av födointag.
Det finns olika hypoteser relaterade till denna reglering:
- Lipostatisk hypotes: Enligt denna hypotes producerar fettvävnad en humoral signal som står i proportion till fettmängden och som verkar på hypotalamus för att minska födointaget och öka energiproduktionen. Det har visat sig att ett hormon leptin verkar på hypotalamus för att minska födointaget och öka energiuttaget.
- Gutpeptidhypotes: Gastrointestinala hormoner som Grp, glukagoner, CCK och andra påstås hämma födointaget. Maten som kommer in i mag-tarmkanalen utlöser frisättning av dessa hormoner, som verkar på hjärnan för att producera mättnadskänsla. Hjärnan innehåller både CCK-A- och CCK-B-receptorer.
- Glukostatisk hypotes: Aktiviteten hos mättnadscentret i de ventromediala kärnorna styrs troligen av glukosutnyttjandet i neuronerna. Det har postulerats att när deras glukosutnyttjande är lågt och följaktligen när den arteriovenösa blodglukosdifferensen över dem är låg, minskar aktiviteten över neuronerna. Under dessa förhållanden är aktiviteten i matningscentret okontrollerad och individen känner sig hungrig. Matintaget ökar snabbt genom intraventrikulär administrering av 2-deoxyglukos och minskar därför glukosutnyttjandet i cellerna.
- Thermostatisk hypotes: Enligt denna hypotes stimulerar en sänkning av kroppstemperaturen under ett givet börvärde aptiten, medan en ökning över börvärdet hämmar aptiten.
Behandling av rädslaRedigera
Den mediala zonen i hypotalamus är en del av ett kretslopp som kontrollerar motiverade beteenden, t.ex. försvarsbeteenden. Analyser av Fos-märkning visade att en serie kärnor i ”beteendekontrollkolumnen” är viktiga för att reglera uttrycket av medfödda och betingade försvarsbeteenden.
Antipredatoriskt försvarsbeteende
Exponering för ett rovdjur (t.ex. en katt) framkallar försvarsbeteenden hos försöksgnagare, även om djuret aldrig har varit utsatt för en katt. I hypotalamus orsakar denna exponering en ökning av Fos-märkta celler i den främre hypotalamiska kärnan, den dorsomediala delen av den ventromediala kärnan och i den ventrolaterala delen av den premammillära kärnan (PMDvl). Den premammillära kärnan har en viktig roll i uttrycket av försvarsbeteenden mot ett rovdjur, eftersom skador i denna kärna upphäver försvarsbeteenden som frysning och flykt. PMD modulerar inte defensiva beteenden i andra situationer, eftersom lesioner av denna kärna hade minimal effekt på poäng för frysning efter chock. PMD har viktiga kopplingar till det dorsala periaqueductal grey, en viktig struktur för uttrycket av rädsla. Dessutom uppvisar djuren riskbedömningsbeteenden till den miljö som tidigare associerats med katten. Fos-märkta cellanalyser visade att PMDvl är den mest aktiverade strukturen i hypotalamus, och inaktivering med muscimol före exponering för sammanhanget upphäver det defensiva beteendet. Därför har hypotalamus, främst PMDvl, en viktig roll i uttrycket av medfödda och betingade försvarsbeteenden mot ett rovdjur.
Socialt nederlag
På samma sätt har hypotalamus en roll i socialt nederlag: Kärnor i den mediala zonen mobiliseras också vid ett möte med en aggressiv artfrände. Det besegrade djuret har en ökning av Fos-nivåerna i sexuellt dimorfiska strukturer, såsom den mediala preoptiska kärnan, den ventrolaterala delen av den ventromediala kärnan och den ventrala premammilära kärnan. Sådana strukturer är viktiga för andra sociala beteenden, t.ex. sexuella och aggressiva beteenden. Dessutom mobiliseras även den premammillära kärnan, den dorsomediala delen men inte den ventrolaterala delen. Lesioner i denna kärna upphäver passivt försvarsbeteende, som frysning och ”on-the-back”-ställning.