Thylakoider indeholder mange integrale og perifere membranproteiner samt lumenale proteiner. Nylige proteomiske undersøgelser af thylakoidfraktioner har givet yderligere detaljer om proteinsammensætningen i thylakoiderne. Disse data er blevet sammenfattet i flere plastidproteindatabaser, der er tilgængelige online.
I henhold til disse undersøgelser består thylakoidproteomet af mindst 335 forskellige proteiner. Af disse er 89 i lumenet, 116 er integrale membranproteiner, 62 er perifere proteiner på stromasiden og 68 perifere proteiner på lumenetsiden. Yderligere lumenale proteiner med lav forekomst kan forudsiges ved hjælp af beregningsmetoder. Af de thylakoide proteiner med kendte funktioner er 42 % involveret i fotosyntesen. De næststørste funktionelle grupper omfatter proteiner, der er involveret i målretning, behandling og foldning af proteiner med 11 %, oxidativ stressrespons (9 %) og translation (8 %).
Integrale membranproteinerRediger
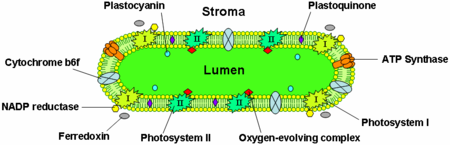
Thylakoidmembraner indeholder integrale membranproteiner, som spiller en vigtig rolle i lyshøstningen og de lysafhængige reaktioner i fotosyntesen. Der er fire store proteinkomplekser i thylakoidemembranen:
- Fotosystem I og II
- Cytochrom b6f-komplekset
- ATP-syntase
Fotosystem II er for det meste placeret i grana thylakoiderne, mens fotosystem I og ATP-syntase for det meste er placeret i stroma thylakoiderne og i de ydre lag af grana. Cytokrom b6f-komplekset er jævnt fordelt i thylakoidmembranerne. På grund af de to fotosystemers adskilte placering i thylakoidmembransystemet er det nødvendigt med mobile elektronbærere til at flytte elektroner mellem dem. Disse bærere er plastoquinon og plastocyanin. Plastoquinon transporterer elektroner fra fotosystem II til cytokrom b6f-komplekset, mens plastocyanin transporterer elektroner fra cytokrom b6f-komplekset til fotosystem I.
Sammen gør disse proteiner brug af lysenergi til at drive elektrontransportkæder, der genererer et kemiosmotisk potentiale på tværs af thylakoidemembranen og NADPH, et produkt af den terminale redoxreaktion. ATP-syntasen bruger det chemiosmotiske potentiale til at lave ATP under fotofosforylering.
FotosystemerRediger
Hovedartikel: Fotosystem
Disse fotosystemer er lysdrevne redoxcentre, der hver består af et antennekompleks, der bruger klorofyller og accessoriske fotosyntetiske pigmenter såsom carotenoider og phycobiliproteiner til at høste lys ved en række forskellige bølgelængder. Hvert antennekompleks har mellem 250 og 400 pigmentmolekyler, og den energi, de absorberer, sendes via resonansenergioverførsel til et specialiseret klorofyl a i hvert fotosystems reaktionscenter. Når et af de to klorofyl a-molekyler i reaktionscentret absorberer energi, bliver en elektron exciteret og overført til et elektronacceptormolekyle. Fotosystem I indeholder et par klorofyl a-molekyler, benævnt P700, i sit reaktionscenter, som maksimalt absorberer 700 nm lys. Fotosystem II indeholder P680-klorofyl, der absorberer 680 nm lys bedst (bemærk, at disse bølgelængder svarer til dyb rødt – se det synlige spektrum). P’et er en forkortelse for pigment, og tallet er det specifikke absorptionstæppe i nanometer for klorofylmolekylerne i hvert reaktionscenter. Dette er det grønne pigment, der findes i planter, og som ikke er synligt for det blotte øje.
Cytochrom b6f-kompleksRediger
Cytochrom b6f-komplekset er en del af den thylakoide elektrontransportkæde og kobler elektronoverførsel til pumpning af protoner ind i thylakoidlumenet. Energimæssigt er det placeret mellem de to fotosystemer og overfører elektroner fra fotosystem II-plastoquinon til plastocyanin-fotosystem I.
ATP-syntaseRediger
Den thylakoide ATP-syntase er en CF1FO-ATP-syntase, der ligner den mitokondrielle ATPase. Den er integreret i thylakoidmembranen med CF1-delen, der stikker ind i stromaet. ATP-syntesen sker således på stromasiden af thylakoiderne, hvor ATP er nødvendig for fotosyntesens lysuafhængige reaktioner.
LumenproteinerRediger
Elektrontransportproteinet plastocyanin er til stede i lumen og transporterer elektroner fra cytokrom b6f-proteinkomplekset til fotosystem I. Mens plastoquinoner er lipidopløselige og derfor bevæger sig inden for thylakoidemembranen, bevæger plastocyanin sig gennem thylakoidlumen.
Thylakoidernes lumen er også stedet for vandoxidation af det iltudviklende kompleks, der er tilknyttet den lumenale side af fotosystem II.
Lumenale proteiner kan forudsiges beregningsmæssigt på grundlag af deres målretningssignaler. I Arabidopsis er de største grupper med kendte funktioner ud af de forudsagte lumenale proteiner, der besidder Tat-signalet, 19 % involveret i proteinbehandling (proteolyse og foldning), 18 % i fotosyntese, 11 % i metabolisme og 7 % redoxbærere og forsvar.
ProteinekspressionRediger
Chloroplaster har deres eget genom, som koder for en række thylakoidproteiner. I løbet af plastidernes udvikling fra deres cyanobakterielle endosymbiotiske forfædre er der imidlertid sket en omfattende genoverførsel fra kloroplastgenomet til cellekernen. Dette resulterer i, at de fire vigtigste thylakoidproteinkomplekser delvis er kodet af kloroplastgenomet og delvis af kernegenomet. Planter har udviklet flere mekanismer til at samregulere ekspressionen af de forskellige underenheder, der er kodet i de to forskellige organeller, for at sikre en korrekt stoikiometri og samling af disse proteinkomplekser. F.eks. reguleres transkriptionen af kernegener, der koder for dele af det fotosyntetiske apparat, af lyset. Biogenese, stabilitet og omsætning af thylakoide proteinkomplekser reguleres af fosforylering via redox-følsomme kinaser i thylakoidemembranerne. Oversættelseshastigheden af kloroplastkodede proteiner styres af tilstedeværelsen eller fraværet af samlingspartnere (kontrol ved epistasy af syntesen). Denne mekanisme indebærer negativ feedback gennem binding af overskydende protein til den 5′ utranslaterede region af kloroplast-mRNA’et. Kloroplaster skal også afbalancere forholdet mellem fotosystem I og II til elektronoverførselskæden. Redoxtilstanden af elektronbæreren plastoquinon i thylakoidemembranen påvirker direkte transkriptionen af kloroplastgener, der koder for proteiner i fotosystemernes reaktionscentre, og modvirker således ubalancer i elektronoverførselskæden.
Proteinmålretning til thylakoiderneRediger
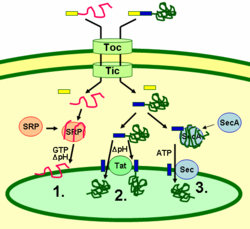
Thylakoidproteiner målrettes til deres bestemmelsessted via signalpeptider og sekretoriske veje af prokaryotisk type inde i kloroplasten. De fleste thylakoidproteiner, der er kodet af en plantes kernegenom, har brug for to målretningssignaler for korrekt lokalisering: Et N-terminalt kloroplast-målpeptid (vist med gul farve på figuren) efterfulgt af et thylakoid-målpeptid (vist med blå farve). Proteinerne importeres gennem transloconen i de ydre og indre membrankomplekser (Toc og Tic). Når det første målpeptid er kommet ind i kloroplasten, bliver det første målpeptid spaltet af af en protease, der behandler importerede proteiner. Derved afmaskeres det andet målretningssignal, og proteinet eksporteres fra stromaet til thylakoidet i et andet målretningstrin. Dette andet trin kræver, at thylakoidernes proteintranslokationskomponenter virker, og det er energiafhængigt. Proteinerne indsættes i membranen via den SRP-afhængige vej (1), den Tat-afhængige vej (2) eller spontant via deres transmembrandomæner (ikke vist i figuren). Lumenale proteiner eksporteres gennem thylakoidemembranen ind i lumenet enten via den Tat-afhængige vej (2) eller den Sec-afhængige vej (3) og frigives ved spaltning fra thylakoidmålretningssignalet. De forskellige veje anvender forskellige signaler og energikilder. Sec-vejen (sekretorisk) kræver ATP som energikilde og består af SecA, som binder sig til det importerede protein, og et Sec-membrankompleks, der transporterer proteinet på tværs. Proteiner med et dobbelt argininmotiv i deres thylakoid-signalpeptid transporteres gennem Tat-vejen (twin argininine translokation), som kræver et membranbundet Tat-kompleks og pH-gradienten som energikilde. Nogle andre proteiner indsættes i membranen via SRP-vejen (signal recognition particle). Kloroplast-SRP’en kan interagere med sine målproteiner enten posttranslationelt eller co-translationelt og dermed transportere importerede proteiner såvel som proteiner, der er oversat inde i kloroplasten. SRP-vejen kræver GTP og pH-gradienten som energikilder. Nogle transmembranproteiner kan også spontant indsættes i membranen fra stromalsiden uden energikrav.