Les thylakoïdes contiennent de nombreuses protéines membranaires intégrales et périphériques, ainsi que des protéines luménales. De récentes études protéomiques de fractions de thylakoïdes ont permis d’obtenir des détails supplémentaires sur la composition protéique des thylakoïdes. Ces données ont été résumées dans plusieurs bases de données de protéines de plastides qui sont disponibles en ligne.
Selon ces études, le protéome du thylakoïde se compose d’au moins 335 protéines différentes. Parmi celles-ci, 89 se trouvent dans la lumière, 116 sont des protéines membranaires intégrales, 62 sont des protéines périphériques du côté du stroma, et 68 des protéines périphériques du côté de la lumière. D’autres protéines luménales peu abondantes peuvent être prédites par des méthodes de calcul. Parmi les protéines thylakoïdes dont les fonctions sont connues, 42 % sont impliquées dans la photosynthèse. Les groupes fonctionnels les plus importants suivants comprennent les protéines impliquées dans le ciblage, le traitement et le repliement des protéines avec 11%, la réponse au stress oxydatif (9%) et la traduction (8%).
Protéines de la membrane intégraleEdit
Les membranes thylakoïdes contiennent des protéines de la membrane intégrale qui jouent un rôle important dans la récolte de la lumière et les réactions de la photosynthèse dépendant de la lumière. Il existe quatre complexes protéiques majeurs dans la membrane thylakoïde :
- Photosystèmes I et II
- Complexe du cytochrome b6f
- ATP synthase
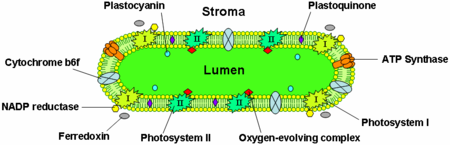
Le photosystème II est situé principalement dans les thylakoïdes du grana, alors que le photosystème I et l’ATP synthase sont principalement situés dans les thylakoïdes du stroma et les couches externes du grana. Le complexe cytochrome b6f est réparti uniformément dans les membranes des thylakoïdes. En raison de l’emplacement séparé des deux photosystèmes dans le système de la membrane thylakoïde, des transporteurs d’électrons mobiles sont nécessaires pour faire la navette entre eux. Ces transporteurs sont la plastoquinone et la plastocyanine. La plastoquinone fait la navette entre les électrons du photosystème II et le complexe cytochrome b6f, tandis que la plastocyanine transporte les électrons du complexe cytochrome b6f vers le photosystème I.
Ensemble, ces protéines utilisent l’énergie lumineuse pour entraîner les chaînes de transport d’électrons qui génèrent un potentiel chimiosmotique à travers la membrane thylakoïde et du NADPH, un produit de la réaction d’oxydoréduction terminale. L’ATP synthase utilise le potentiel chimiosmotique pour fabriquer de l’ATP lors de la photophosphorylation.
PhotosystèmesEdit
Ces photosystèmes sont des centres redox pilotés par la lumière, chacun étant constitué d’un complexe d’antenne qui utilise des chlorophylles et des pigments photosynthétiques accessoires tels que les caroténoïdes et les phycobiliprotéines pour récolter la lumière à une variété de longueurs d’onde. Chaque complexe d’antenne compte entre 250 et 400 molécules de pigment et l’énergie qu’elles absorbent est acheminée par transfert d’énergie de résonance vers une chlorophylle a spécialisée située au centre de réaction de chaque photosystème. Lorsque l’une des deux molécules de chlorophylle a du centre de réaction absorbe de l’énergie, un électron est excité et transféré à une molécule acceptrice d’électrons. Le photosystème I contient une paire de molécules de chlorophylle a, désignée P700, au niveau de son centre de réaction qui absorbe au maximum la lumière de 700 nm. Le photosystème II contient une chlorophylle P680 qui absorbe le mieux la lumière de 680 nm (notez que ces longueurs d’onde correspondent au rouge profond – voir le spectre visible). Le P est l’abréviation de pigment et le nombre correspond au pic d’absorption spécifique en nanomètres des molécules de chlorophylle dans chaque centre de réaction. Il s’agit du pigment vert présent dans les plantes qui n’est pas visible à l’œil nu.
Complexe du cytochrome b6fEdit
Le complexe du cytochrome b6f fait partie de la chaîne de transport d’électrons du thylakoïde et couple le transfert d’électrons au pompage des protons dans la lumière du thylakoïde. Sur le plan énergétique, il se situe entre les deux photosystèmes et transfère les électrons du photosystème II-plastoquinone au plastocyanine-photosystème I.
Atp synthaseModifié
L’ATP synthase thylakoïde est une CF1FO-ATP synthase similaire à l’ATPase mitochondriale. Elle est intégrée dans la membrane thylakoïde avec la partie CF1 collée dans le stroma. Ainsi, la synthèse de l’ATP se produit du côté stromal des thylakoïdes où l’ATP est nécessaire pour les réactions indépendantes de la lumière de la photosynthèse.
Protéines de la lumièreEdit
La protéine de transport d’électrons plastocyanine est présente dans la lumière et fait la navette entre les électrons du complexe protéique cytochrome b6f et le photosystème I. Alors que les plastoquinones sont liposolubles et se déplacent donc à l’intérieur de la membrane thylakoïde, la plastocyanine se déplace dans la lumière des thylakoïdes.
La lumière des thylakoïdes est également le site d’oxydation de l’eau par le complexe d’évolution de l’oxygène associé au côté luminal du photosystème II.
Les protéines lumineuses peuvent être prédites par calcul sur la base de leurs signaux de ciblage. Chez Arabidopsis, parmi les protéines luménales prédites possédant le signal Tat, les plus grands groupes avec des fonctions connues sont 19% impliqués dans le traitement des protéines (protéolyse et repliement), 18% dans la photosynthèse, 11% dans le métabolisme, et 7% les transporteurs redox et la défense.
Expression des protéinesEdit
Les chloroplastes ont leur propre génome, qui code pour un certain nombre de protéines thylakoïdes. Cependant, au cours de l’évolution des plastes à partir de leurs ancêtres endosymbiotiques cyanobactériens, un important transfert de gènes du génome du chloroplaste vers le noyau cellulaire a eu lieu. Il en résulte que les quatre principaux complexes protéiques thylakoïdes sont codés en partie par le génome chloroplastique et en partie par le génome nucléaire. Les plantes ont développé plusieurs mécanismes pour co-réguler l’expression des différentes sous-unités codées dans les deux organites différents afin d’assurer la stœchiométrie et l’assemblage corrects de ces complexes protéiques. Par exemple, la transcription des gènes nucléaires codant pour des parties de l’appareil photosynthétique est régulée par la lumière. La biogenèse, la stabilité et le renouvellement des complexes protéiques thylakoïdes sont régulés par la phosphorylation via des kinases sensibles à l’oxydoréduction dans les membranes thylakoïdes. Le taux de traduction des protéines codées par le chloroplaste est contrôlé par la présence ou l’absence de partenaires d’assemblage (contrôle par épistasie de la synthèse). Ce mécanisme implique une rétroaction négative par la liaison de la protéine en excès à la région 5′ non traduite de l’ARNm du chloroplaste. Les chloroplastes doivent également équilibrer les ratios des photosystèmes I et II pour la chaîne de transfert d’électrons. L’état redox du transporteur d’électrons plastoquinone dans la membrane thylakoïde affecte directement la transcription des gènes du chloroplaste codant pour les protéines des centres de réaction des photosystèmes, contrebalançant ainsi les déséquilibres dans la chaîne de transfert d’électrons.
Ciblage des protéines vers les thylakoïdesModification
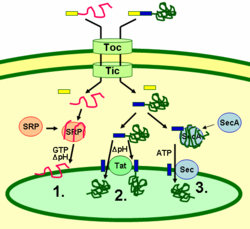
Les protéines thylakoïdes sont ciblées vers leur destination via des peptides signaux et des voies de sécrétion de type procaryote à l’intérieur du chloroplaste. La plupart des protéines thylakoïdes codées par le génome nucléaire d’une plante ont besoin de deux signaux de ciblage pour être correctement localisées : Un peptide de ciblage chloroplastique N-terminal (représenté en jaune sur la figure), suivi d’un peptide de ciblage thylakoïde (représenté en bleu). Les protéines sont importées par le translocon des complexes de la membrane externe et interne (Toc et Tic). Après avoir pénétré dans le chloroplaste, le premier peptide de ciblage est clivé par une protéase traitant les protéines importées. Cela démasque le second signal de ciblage et la protéine est exportée du stroma vers le thylakoïde lors d’une seconde étape de ciblage. Cette deuxième étape nécessite l’action des composants de translocation des protéines des thylakoïdes et est dépendante de l’énergie. Les protéines sont insérées dans la membrane via la voie dépendante de SRP (1), la voie dépendante de Tat (2), ou spontanément via leurs domaines transmembranaires (non représentés sur la figure). Les protéines luménales sont exportées à travers la membrane thylakoïde dans la lumière par la voie dépendante de Tat (2) ou la voie dépendante de Sec (3) et libérées par clivage du signal de ciblage thylakoïde. Les différentes voies utilisent des signaux et des sources d’énergie différents. La voie Sec (sécrétoire) nécessite de l’ATP comme source d’énergie et se compose de SecA, qui se lie à la protéine importée et d’un complexe membranaire Sec pour faire passer la protéine. Les protéines dont le peptide signal thylakoïde comporte un motif à deux arginines sont transportées par la voie Tat (translocation à deux arginines), qui nécessite un complexe Tat lié à la membrane et le gradient de pH comme source d’énergie. D’autres protéines sont insérées dans la membrane par la voie SRP (signal recognition particle). La SRP du chloroplaste peut interagir avec ses protéines cibles de manière post-traductionnelle ou co-traductionnelle, transportant ainsi les protéines importées ainsi que celles qui sont traduites à l’intérieur du chloroplaste. La voie SRP nécessite du GTP et le gradient de pH comme sources d’énergie. Certaines protéines transmembranaires peuvent également s’insérer spontanément dans la membrane à partir du côté stromal sans besoin d’énergie.