Introduction
Die Analyse der Herzfrequenzvariabilität (HRV) bietet Einblicke in die autonome Regulation und die Interaktionen zwischen Sympathikus und Parasympathikus. Die HRV beschreibt die Schwankungen der Herzfrequenz im Zeitverlauf, die bei gesunden Menschen natürlich auftreten. Diese Schwankungen spiegeln die Fähigkeit des Organismus wider, sich kontinuierlich an interne und externe Ereignisse anzupassen, um die Homöostase aufrechtzuerhalten. Interessanterweise definierten Chrousos und Gold (1992, S. 1245) Stress als einen „Zustand der bedrohten Homöostase“. Daher wurde im Laufe der Jahre davon ausgegangen, dass eine Abnahme der HRV eine Zunahme des Stresses widerspiegelt, und die HRV-Analyse wurde zunehmend als eine der Methoden zur Messung von Stress anerkannt.
Eine der einfachsten HRV-Messungen (SDNN) quantifiziert die Standardabweichung der Dauer normaler RR-Intervalle, d. h., wie sich das Intervall zwischen normalen (Sinus-)R-Zacken aufeinanderfolgender QRS im Elektrokardiogramm (EKG) im Laufe der Zeit verändert. Dennoch wurden im Laufe der Jahre zahlreiche mathematische Metriken und Ansätze zur HRV-Analyse entwickelt, um immer genauere Informationen aus der HRV zu extrahieren (Shaffer und Ginsberg, 2017).
Die HRV-Analyse im Zeitbereich konzentriert sich auf die Veränderung der NN-Intervalle (d. h. der normalen RR-Intervalle) im Laufe der Zeit. Zusätzlich zur SDNN untersuchen HRV-Studien häufig das mittlere Quadrat der aufeinanderfolgenden Differenzen (RMSSD) oder den Prozentsatz der Intervalle, die sich um mehr als 50 ms (pNN50) oder 20 ms (pNN20) vom vorherigen unterscheiden. Für alle diese HRV-Metriken im Zeitbereich spiegeln höhere Werte eine größere Variabilität wider, die in gesunden Zuständen häufiger vorkommt.
Eine nicht-lineare oder geometrische HRV-Analyse kann durch Auftragen der NN-Intervalle auf einem Poincaré-Plot durchgeführt werden, wobei jedes NN-Intervall in Relation zum vorherigen NN-Intervall aufgetragen wird (Golińska, 2013) und die Standardabweichung des Hauptclusters von Datenpunkten quer (SD1) oder längs (SD2) gemessen wird. Metriken wie der Cardiac Sympathetic Index (CSI) und der Cardiac Vagal Index (CVI) wurden entwickelt, um die Wechselwirkungen zwischen SD1 und SD2 zu erfassen (Toichi et al., 1997). Der CSI verhält sich entgegengesetzt zum CVI, so dass ein höherer CSI im Gegensatz zu den meisten anderen HRV-Metriken mit einer geringeren Variabilität, d. h. einer höheren Belastung, verbunden ist. Andere geometrische Metriken sind der Dreiecksindex (TINN) und der HRV-Index. Wie der SDNN geben diese beiden Parameter ein Maß für die Gesamtvariabilität während des Aufzeichnungszeitraums an. Der TINN misst die normalisierte Breite der Basis des Histogramms der NN-Intervalle (im Verhältnis zum höchsten Wert des NN-Histogramms), und der HRV-Index ist ein Verhältnis zwischen der Anzahl aller NN-Intervalle und der Anzahl der NN-Intervalle am höchsten Punkt des NN-Histogramms (normalisiert auf eine Abtastrate von 128 Werten pro Sekunde).
In der Frequenzbereichsanalyse werden verschiedene Bänder des EKG-Leistungsspektrums sowie ihre Wechselwirkungen (zwischen den Bändern und im Verhältnis zur Gesamtleistung) analysiert. Bei Erwachsenen haben frühere Studien vier Frequenzbänder von Interesse definiert: Ultra-low frequency (ULF), Very-low frequency (VLF), Low-frequency (LF) und High-frequency (HF), von denen angenommen wird, dass sie jeweils unterschiedliche physiologische Ursachen haben. ULF wird mit zirkadianen Oszillationen der Körperkerntemperatur und der Renin-Angiotensin-Regulierung in Verbindung gebracht; VLF wird mit einer längerfristigen Regulierung der Thermoregulation und hormonellen Mechanismen in Verbindung gebracht; LF wird mit einer Mischung aus sympathischer und vagaler Aktivität und Barorezeptoraktivität in Verbindung gebracht und HF mit vagaler Aktivität (Pomeranz et al., 1985). Die Definition und Bedeutung von ULF und VLF bei Säuglingen ist jedoch unzureichend dokumentiert und wird daher in diesem Bericht nicht behandelt. Obwohl die absolute Quantifizierung der Leistung in den HF- und NF-Bändern zunehmen/abnehmen kann, erwarten wir bei normaler kardialer Leitfähigkeit, dass sich LFn und HFn (d. h. NF und HF normalisiert auf die Gesamtleistung) in den meisten Fällen in entgegengesetzter Richtung verhalten. Während HFn (das die parasympathische Aktivität repräsentiert) bei geringer physiologischer Belastung höher sein dürfte, wird LFn bei hoher Belastung höher sein. Diese Assoziationen sind jedoch umstritten (von Rosenberg et al., 2017; Adjei et al., 2019), und bei der Interpretation von LF- und HF-Befunden in realen Szenarien ist Vorsicht geboten.
Die Analyse der Herzfrequenzvariabilität ist als Methode zur Messung autonomer Beeinträchtigungen weithin akzeptiert und wird zunehmend auf ihren Wert für die Krankheitsstratifizierung untersucht (Ahmad et al., 2009; Lees et al., 2018; Oliveira et al., 2018). Obwohl frühere Studien normative HRV-Referenzwerte für Neugeborene in den ersten Tagen beschrieben haben (Mehta et al., 2002; Longin et al., 2005; Doyle et al., 2009; Makarov et al., 2010; Lucchini et al., 2019), fehlt es an Untersuchungen zur HRV in den ersten Stunden nach der Geburt. Diese Studien haben meist nur einige Minuten EKG während des ersten Tages aufgezeichnet oder beginnen erst jenseits des 12. Lebensjahres, und keine hat kontinuierliche HRV-Trends während der ersten 24 Stunden des Lebens beschrieben.
Allerdings ist es bei einigen Zuständen wichtig, normale HRV-Referenzwerte unmittelbar nach der Geburt und ihre Trends während der ersten 24 Stunden zu beschreiben, insbesondere bei solchen, die aufgrund von Geburtskomplikationen auftreten und zeitkritische Entscheidungen erfordern, wie z. B. neonatale Enzephalopathie. Solche frühen Trends können wertvolle Informationen darüber liefern, wie sich ein Baby von einer geburtsbedingten Komplikation erholt hat. Unser primäres Ziel war die Beschreibung von Standardreferenzwerten für HRV-Trends in den ersten 24 Stunden des postnatalen Lebens bei gesunden Terminkindern. Als sekundäres Ziel untersuchten wir, welche (wenn überhaupt) klinischen Merkmale oder Risikofaktoren einen größeren Einfluss auf die HRV haben.
Materialien und Methoden
Studienpopulation
Wir rekrutierten prospektiv und konsekutiv 150 gesunde Terminkinder aus dem Geburtszentrum, der Kreißsaalabteilung oder der postnatalen Station des Queen Charlotte’s and Chelsea Hospital zwischen August 2017 und Januar 2019. Wir schlossen gesunde Babys ein, die nach unkomplizierten Schwangerschaften im Gestationsalter von 36 Wochen oder mehr geboren wurden und die in gutem Zustand mit einem Geburtsgewicht zwischen der 9. und 91. Ausgeschlossen wurden Säuglinge, die eine medikamentöse Behandlung oder Phototherapie benötigten, bei denen während oder innerhalb von 48 Stunden nach Einsetzen der Wehen eine perinatale mütterliche Pyrexie auftrat, die bei oder nach der Geburt reanimiert werden mussten (Intubation oder Herzdruckmassage oder Medikamente) oder bei denen eine intrapartale Komplikation auftrat (mütterliche Blutung, Plazentaabruptio, Präeklampsie oder Nabelschnurvorfall). In unsere Studie wurden nur Babys aufgenommen, denen es bei der Geburt gut ging und die daher die ganze Zeit bei ihren Müttern blieben.
Intrapartale und frühe postnatale Betreuung
Die in unsere Studie aufgenommenen Babys wurden entweder im Geburtshaus oder auf der Kreißsaalstation geboren, je nachdem, was die Mütter bevorzugten. Frauen, die eine natürlichere, weniger medizinisch geprägte Geburt bevorzugten, entschieden sich für die von Hebammen geleitete Betreuung im Geburtshaus. Ein warmes Becken, Aromatherapie, Musik, Lachgas und verschiedene Geräte stehen zur Verfügung, um diesen Frauen bei der Bewältigung der Wehenschmerzen zu helfen. Frauen, die sich für eine Epiduralanästhesie entschieden, wurden von Geburtshelfern auf der Kreißsaalstation betreut. In beiden Umgebungen war die Raumtemperatur auf 24-25 °C eingestellt. Gemäß den nationalen Richtlinien werden Babys, die in gutem Zustand geboren wurden, direkt nach der Geburt der Mutter übergeben und zur Haut-zu-Haut-Pflege auf ihre Brust/ihren Bauch gelegt. Sie können auf der Brust der Mutter sanft gereinigt werden und innerhalb von 1 Stunde nach der Geburt gestillt oder mit der Flasche gefüttert werden.
EKG-Erfassung
Die Aufzeichnungen des Elektrokardiogramms wurden so bald wie möglich nach der Geburt begonnen, nachdem die Eltern ihre schriftliche Zustimmung gegeben hatten, die vor oder nach der Geburt eingeholt werden konnte. Diese Studie wurde von einer nationalen Ethikkommission für Forschung (REC17/LO/0956) und von der örtlichen Abteilung für Forschungsentwicklung & genehmigt. Die Aufzeichnungen wurden für mindestens 6 Stunden fortgesetzt, konnten aber auf Wunsch der Eltern oder bei der Entlassung des Babys auch früher unterbrochen werden. Wir verwendeten einen tragbaren 2-Zoll-EKG-Rekorder (Faros 180, Bittium, Oulu, Finnland) mit Dreielektroden-Thoraxanordnung und einer Abtastrate von 500 Hz (Abbildung 1), den wir zuvor getestet hatten. Nach Abschluss der Aufzeichnung wurde die EKG-Datei zur EKG- und HRV-Analyse in die CardiscopeTM HRV Analysis Software (Hasiba Medical, Graz, Österreich) hochgeladen.
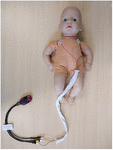
Abbildung 1. Tragbarer EKG-Rekorder und thorakaler Aufbau. Drei EKG-Elektroden wurden durch eine Ausrichtungshülse geführt, um den Abstand zwischen den EKG-Drähten zu verringern und magnetische Induktionsartefakte auf dem EKG-Rohsignal zu vermeiden (500 Hz mit automatischer R-Peak-Erkennung).
HRV-Analyse
Die Metriken der Herzfrequenzvariabilität im Zeit- (linear und nichtlinear) und Frequenzbereich wurden für jedes 5-minütige EKG-Segment (nicht überlappende Fenster) berechnet. Wir haben eine Mindest-QRS-Validität von 90 % verwendet, d. h. alle 5-Minuten-Segmente mit weniger als 90 % konsekutiven QRS von guter Qualität wurden von der Analyse ausgeschlossen. Da es keine internationalen Empfehlungen für die HRV-Analyse speziell für Neugeborene gibt, basierten unsere Methoden und ausgewählten Metriken auf einer Anpassung der verfügbaren internationalen Richtlinien (Task Force der European Society of Cardiology und der North American Society of Pacing and Electrophysiology, 1996; Schwartz et al., 2002) sowie auf aktuellen Empfehlungen für die HRV-Forschung (Laborde et al., 2017) und einer Überprüfung relevanter HRV-Studien bei Neugeborenen in den ersten Lebenstagen (Doyle et al., 2009; Goulding et al., 2015; Temko et al., 2015). Die 16 HRV-Metriken, die wir zur Analyse ausgewählt haben, basieren auf diesen Referenzen. Die Frequenzanalyse erfolgte mittels Fourier-Transformation (Welch-Periodogramm) und wir verwendeten detrendierte und interpolierte (kubischer Spline) RR-Intervall-Zeitreihen. Auf der Grundlage der oben genannten Literatur verwendeten wir ein LF-Band von 0,04-0,20 Hz und ein HF-Band von 0,20-2,0 Hz. Anschließend analysierten wir die normalisierten NF- und HF-Werte, d. h. den Anteil der Leistung in diesen Bereichen im Verhältnis zur gesamten spektralen Leistung. Die Liste der in dieser Studie berichteten HRV-Metriken und ihre Bedeutung sind in Tabelle 1 beschrieben.

Tabelle 1. HRV-Metriken: Abkürzungen und Bedeutung.
Statistische Analyse
Wir verwendeten Stata 15 (StataCorp, Austin, TX, Vereinigte Staaten) für die statistische Analyse. Wir beschrieben die HRV-Zeittrends mit stündlichen Medianen und Interquartilsbereichen und berechneten die individuellen Durchschnittswerte für die ersten 6 und 24 Stunden des Lebens. Da die EKG-Aufzeichnungen zu unterschiedlichen Zeiten beginnen und enden konnten und unsere Daten unausgewogen waren, d. h. wir hatten nicht für alle Teilnehmer die exakt gleiche Anzahl von Messungen, wurden die Veränderungen der HRV im Laufe der Zeit mit einer Mehrebenen-Regression mit gemischten Effekten und autoregressiver Kovarianz oder mit paarweisen Tests analysiert, wenn sechs stündliche Durchschnittswerte verglichen wurden. Die Relevanz der klinischen Variablen wurde ebenfalls mit einer mehrstufigen Regression mit gemischten Effekten und autoregressiver Kovarianz getestet, und für die signifikanten klinischen Variablen wurden Subgruppenvergleiche mit Hilfe von Proportions-/Mittelwertvergleichstests durchgeführt. Da die meisten Trends nicht linear waren und mindestens eine Abweichung aufwiesen, verwendeten wir einen quadratischen Term für die Zeitvariable im Regressionsmodell. Wir haben HRV-Variablen, die nicht normalverteilt waren, log-transformiert, um normale Residuen zu gewährleisten.
Ergebnisse
Zwischen September 2017 und Januar 2019 untersuchten wir 511 Babys, von denen 360 in Frage kamen und 151 nicht. Von diesen 360 Babys baten uns 201 Mütter/Väter, zu einem späteren Zeitpunkt oder zu einem anderen geeigneten Zeitpunkt wiederzukommen, wodurch das maximale Zeitfenster für die Rekrutierung überschritten wurde oder die Rekrutierung aufgrund von in Gebrauch befindlichen Geräten unmöglich wurde. Von 159 Müttern/Vätern, die umfassend über die Studie informiert wurden, lehnten 9 die Teilnahme ab und 150 gaben ihre schriftliche Einwilligung. Von diesen 150 Teilnehmern begannen 7 nach 24 Stunden mit der EKG-Aufzeichnung. Die Merkmale der Stichprobe sind in den Tabellen 2 und 3 aufgeführt. Insgesamt wurden 1858 Stunden und 55 Minuten EKG aufgezeichnet, beginnend mit einem medianen (IQR) Alter von 2 Stunden und 46 Minuten (3 Stunden und 6 Minuten), mindestens 1 Minute nach der Geburt und maximal 52 Stunden und 23 Minuten. Nicht alle Säuglinge begannen die EKG-Aufzeichnung zur gleichen Zeit, und nicht alle Aufzeichnungen dauerten gleich lang. Abbildung 2 zeigt die Anzahl der gültigen Aufzeichnungen und Säuglinge nach Zeit.

Tabelle 2. Stichprobenmerkmale I (kontinuierliche Variablen).

Tabelle 3. Stichprobenmerkmale II (kategoriale Variablen).
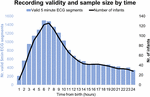
Abbildung 2. Aufzeichnungsvalidität und Stichprobengröße nach Zeit.
HRV-Werte im Zeitverlauf
Während der ersten 6 h postnatalen Alters waren die Medianwerte (IQR) HR 122 (15,9), SDNN 27,5 (13,2), RMSSD 18,32 (11,42), SD1 13.6 (7.7), SD2 36.2 (17.8), SDSD 18.8 (11.4), CVI 2.7 (0.4), CSI 2.6 (1.2), pNN20 14.8 (15.2), pNN50 1.7 (2.5) HFn 40,4 (16,9) LFn 57,7 (17,8) Gesamtleistung 751 (835), TINN 226 (144) HRV Index 5,9 (2,3) Parseval 0,7 (0,2). Neun dieser HRV-Metriken (einschließlich der Herzfrequenz) veränderten sich im Laufe der Zeit signifikant (HR p < 0,01; SDNN p = 0,01; SD2 p < 0,01; CSI p < 0,01; HFn p = 0,03; LFn p < 0,01; Gesamtleistung p < 0,01; HRV-Index p = 0,01; Parseval-Index p = 0,03), bereinigt um relevante klinische Variablen. Eine ausgeprägtere Variation wurde während der ersten 6 Stunden des postnatalen Lebens beobachtet. Nur Herzfrequenz und LFn veränderten sich zwischen 6 und 12 Stunden und nur die Herzfrequenz veränderte sich zwischen 12 und 18 Stunden (Bonferroni-bereinigte p-Werte: 0,03, < 0,01 bzw. < 0,01). Diese Metriken zeigten einen Anstieg der HRV während der ersten 6 Stunden, gefolgt von einem leichten Rückgang bis zu 12 Stunden, von da an blieb die HRV stabil (Tabelle 4). Stündliche Trends, ausgedrückt durch Median und Interquartilsbereiche, sind in Abbildung 3 dargestellt. Die HRV-Trends im Zeitverlauf wurden unabhängig voneinander durch das Schwangerschaftsalter, reduzierte fetale Bewegungen, die Kardiotokographie (CTG)-Klassifizierung, chronische oder schwangerschaftsbedingte Erkrankungen der Mutter und das Auftreten von Geburtskomplikationen beeinflusst. Wir untersuchten die gegenseitigen Abhängigkeiten aller HRV-Metriken mit einer Korrelationsmatrix (Abbildung 4), in der wir (a) die Ähnlichkeit zwischen den Metriken im Zeitbereich und (b) die Tendenz zur Symmetrie zwischen HFn und LFn und CSI und CVI hervorheben.
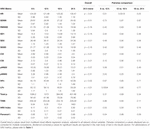
Table 4. Sechsstündige HRV-Mittelwerte und paarweise Vergleiche.
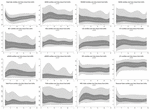
Abbildung 3. HRV-Zentilen während der ersten 24 Stunden des Alters. Hellgraue Bereiche: 5. bis 25. Perzentile und 75. bis 95. Perzentile. Dunkelgraue Bereiche: 25. bis 75. Perzentile. Die mittlere weiße Linie entspricht dem Median. Die angegebenen p-Werte ergeben sich aus einer Regression mit gemischten Effekten auf mehreren Ebenen zur Messung der Veränderung im Zeitverlauf. Alle Zentile mit kubischem Spline geglättet.

Abbildung 4. Korrelationsmatrix: alle HRV-Metriken. Die Abkürzungen der HRV-Metriken finden sich in Tabelle 1. Besonders hervorzuheben sind (a) die Übereinstimmung zwischen RMSSD, SDSD und SD1, die bereits zuvor beschrieben wurde; (b) das Verhalten verschiedener HRV-Metriken in Bezug auf die Herzfrequenz, was deutlich macht, wie viele zusätzliche Informationen die HRV-Analyse liefern kann; (c) die gegenseitige Abhängigkeit von HFn und LFn sowie CVI und CSI, was das Zusammenspiel zwischen sympathischen und parasympathischen Einflüssen verdeutlicht.
Auswirkung klinischer Faktoren
Zusätzlich zum Alter (Zeitpunkt der Geburt) zeigte die univariable Mehrebenen-Regression mit gemischten Effekten, dass die HRV-Metriken durch das Schwangerschaftsalter, reduzierte fetale Bewegungen, CTG, mütterliche Erkrankungen und Geburtskomplikationen beeinflusst wurden. Nach Bereinigung um diese Variablen blieb die zeitliche Variation der oben genannten sieben HRV-Metriken statistisch signifikant. HFn und Parseval-Index zeigten ebenfalls signifikante Veränderungen. Obwohl die Parität in der univariablen Regressionsanalyse kein unabhängiger Prädiktor war, beobachteten wir in der Untergruppe der spontanen vaginalen Entbindungen einen konsistenten Trend zu einer höheren HRV für Primiparas im Vergleich zu Multiparas.
Reduzierte fetale Bewegungen
Reduzierte fetale Bewegungen waren konsistent mit niedrigeren HRV-Werten für alle Metriken verbunden, mit Ausnahme des CSI (der sich in die entgegengesetzte Richtung verhält, d.h. das Ergebnis ist konkordant). Diese Unterschiede zwischen den Untergruppen waren nur für die Trends von CSI (p = 0,001), pNN20 (p = 0,045) und Parseval Index (p = 0,047) statistisch signifikant. Abbildung 5 zeigt die Entwicklung dieser drei Messgrößen im Zeitverlauf im Vergleich zur Herzfrequenz. Dies gilt, obwohl es keine signifikanten Unterschiede zwischen den Untergruppen gab, mit Ausnahme der durchschnittlichen Gravidität, die die HRV nicht unabhängig vorhersagte (Tabelle 5). Die Assoziationen mit CSI und pNN20 blieben auch nach Anpassung an das Gestationsalter, die Zeit nach der Geburt, die CTG-Klassifikation, das Vorliegen chronischer Erkrankungen der Mutter oder Geburtskomplikationen signifikant (Tabelle 6). Die Untergruppe mit reduzierten fetalen Bewegungen hatte eine niedrigere durchschnittliche HRV während der ersten 6 Stunden, obwohl diese Unterschiede statistisch nicht signifikant waren.
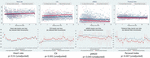
Abbildung 5. HRV-Veränderungen bei Säuglingen, deren Mütter über reduzierte fetale Bewegungen berichteten. Die Abkürzungen der HRV-Metriken finden sich in Tabelle 1. Die oberen Felder zeigen die Streuung der HRV-Daten über die Zeit sowie lineare Trendlinien für die Herzfrequenz (vergleichend) und die drei HRV-Metriken, die signifikant mit den Berichten der Mütter über reduzierte fetale Bewegungen verbunden waren. Rote Linien stellen Babys dar, deren Mütter über reduzierte fetale Bewegungen berichteten, und blaue Linien stellen Babys dar, deren Mütter dies nicht taten. Die unteren Felder zeigen die Mittelwerte und 95 %-Konfidenzintervalle für diese Messwerte.
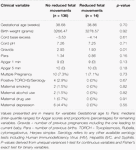
Tabelle 5. Untergruppenvergleich – Säuglinge mit und ohne reduzierte fetale Bewegungen.

Tabelle 6. Unbereinigte und bereinigte Korrelation zwischen HRV-Metriken und eingeschränkten fetalen Bewegungen.
Kardiotokographie
Es bestand ein signifikanter Zusammenhang zwischen CTG-Befunden und HRV-Trends im Zeitverlauf für CSI (p = 0,03), LFn (0,01) und HFn (p = 0,02), der auch nach Bereinigung um eingeschränkte fetale Bewegungen, Gestationsalter, Zeit nach der Geburt, Vorhandensein von chronischen mütterlichen oder schwangerschaftsbedingten Erkrankungen oder Entbindungskomplikationen statistisch signifikant blieb. In Anbetracht der geringen Anzahl von Ereignissen in jeder CTG-Klassifikation verglichen wir auch den 6-Stunden-Mittelwert in diesen Untergruppen. Der CSI in der Bradykardie-Untergruppe unterschied sich signifikant von den Gruppen „normal“, „variable Dezeleration“ und „andere“ (Bonferroni-bereinigte p-Werte: 0,02, 0,03 bzw. 0,04), aber keine anderen Gruppenunterschiede waren statistisch signifikant. HFn unterschied sich nur zwischen den Untergruppen „Bradykardie“ und „variable Verzögerung“ (p = 0,03) und LFn variierte nicht zwischen den verschiedenen CTG-Untergruppen.
Chronische oder schwangerschaftsbedingte Erkrankungen der Mutter
In unserer Stichprobe hatten 104 (69 %) Frauen weder eine chronische noch eine schwangerschaftsbedingte Erkrankung, 20 (13 %) hatten einen isolierten Diabetes mellitus oder einen Schwangerschaftsdiabetes, 7 (3 %) eine Schilddrüsenerkrankung, 1 (0,7 %) hatte Bluthochdruck und die übrigen hatten andere Erkrankungen, einschließlich Kombinationen der oben genannten (Tabelle 3). Mütterliche chronische oder schwangerschaftsbedingte Erkrankungen waren signifikant mit unbereinigten HRV-Trends assoziiert, obwohl dies nur für den Parseval-Index (p = 0,03) nach Bereinigung um klinische Störfaktoren statistisch signifikant blieb. Bei der binären Analyse wiesen die Säuglinge von Müttern mit schwangerschaftsbedingten/chronischen Erkrankungen weder während der ersten 6 Stunden (p = 0,98) noch während des 24-Stunden-Zeitraums (p = 0,29) unterschiedliche durchschnittliche Parseval-Indizes auf. Die Krankheitsgruppe mit dem niedrigsten Parseval-Index war die Schilddrüsenerkrankung.
Ereignisse während der Geburt
Alle Babys in unserer Studie wurden nach unkomplizierten Schwangerschaften und Entbindungen geboren und kamen in gutem Zustand zur Welt. Dennoch gab es 13 Geburten, bei denen eines der folgenden Ereignisse auftrat: mit Mekonium gefärbte Flüssigkeit (11), zirkuläre Nabelschnur (1), verlängerte zweite Phase der Wehen (1) und Schulterdystokie (1, zusätzlich zu Mekonium). Die CSI-Trends über 24 Stunden waren signifikant mit dem Vorhandensein von Wehen- und Geburtsereignissen vor (p = 0,04), aber nicht nach Bereinigung um Störfaktoren (p = 0,42) assoziiert.
Obwohl der Entbindungsmodus die HRV-Werte nicht unabhängig vorhersagte, hatten Babys, die durch eine instrumentelle Entbindung geboren wurden, eine niedrigere 24-Stunden-HFn und einen höheren 24-Stunden-CSI als Babys, die durch eine natürliche vaginale Entbindung geboren wurden. Dies war der Fall, obwohl es keine signifikanten Unterschiede zwischen anderen relevanten klinischen Variablen gab, mit Ausnahme des Apgar-Scores bei 1 Minute und der Anzahl der Schwangerschaften, die die HRV nicht unabhängig voneinander vorhersagten (Tabelle 7).
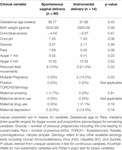
Tabelle 7. Untergruppenvergleich – Säuglinge mit normaler vaginaler versus instrumenteller Entbindung.
Diskussion
Dies ist die erste Studie, die frühe postnatale kontinuierliche HRV-Trends bei gesunden Termingeborenen in der unmittelbaren postnatalen Zeit beschreibt. Die Identifizierung dieser Schwellenwerte und Trends war wichtig, weil wir jetzt wissen, dass die HRV-Analyse und -Interpretation in der frühen postnatalen Periode zeitabhängig ist, d.h. was im Alter von 1-6 Stunden normal ist, ist im Alter von 12-18 Stunden möglicherweise nicht mehr normal. Dies wird es Klinikern und Forschern ermöglichen, die Unterschiede in der HRV zwischen gesunden und kranken Säuglingen in der unmittelbaren postnatalen Periode genauer zu untersuchen. Genaue Referenzwerte für die unmittelbare postnatale Periode zu haben bedeutet auch, dass wir nun besser gerüstet sind, um Frühwarnsysteme auf der Grundlage der HRV-Analyse zu entwickeln.
Es gibt einige mögliche Gründe für die von uns beobachteten Veränderungen in den ersten 6 Stunden nach der Geburt. Da die Geburt bereits früher als ein stressiges Ereignis für Babys beschrieben wurde (Peebles et al., 1994; Aldrich et al., 1996), ist es möglich, dass die Verbesserung der HRV in den ersten Stunden das Ende des Stressors (d.h. das Ende der Geburt) widerspiegelt. Dieser parasympathische Rebound könnte auftreten, weil das sympathische Nervensystem die parasympathische Aktivität vorübergehend unterdrücken kann, die nach Beendigung der Stressperiode aufhört. Aus einer anderen Perspektive berichteten Reyes-Lagos et al. (2015) über eine höhere mütterliche HRV während der Wehen als während des dritten Trimesters, und Musa et al. (2017) beschrieben einen Anstieg von LFn und HFn durch die zervikale Dilatation während der Wehen. Wenn die fetale HRV der mütterlichen HRV folgt, würde dies eher darauf hindeuten, dass die Geburt eine Periode mit besonders hoher HRV darstellt, die die gute Anpassung an physiologische Herausforderungen bei gesunden Babys widerspiegelt. Schließlich ist es auch möglich, dass die in den ersten Stunden beobachteten Veränderungen der HRV ein teilweiser Ausdruck der HRV-Reifung sind, die mit dem Alter auftritt (Fyfe et al., 2015).
Wir haben die in anderen neonatalen und fetalen Studien berichteten HRV-Ergebnisse mit der Absicht überprüft, diese Werte mit denen in unserer Studie zu vergleichen, aber angesichts der Unterschiede in der Metrik und der Erfassung und Dauer der Aufzeichnungen war dies sehr schwierig. Die HRV-Werte, die wir in den ersten 6-12 Stunden beobachteten, waren vergleichbar (etwas höher) mit denen, die von Doyle et al. (2009) im aktiven Schlaf während der ersten 12 Stunden des Lebens und von Lucchini et al. (2019) im Alter von 12-84 Stunden berichtet wurden, und niedriger als die Werte, die im höheren Alter, d. h. 24-168 Stunden, berichtet wurden (von Mehta et al., 2002; Longin et al., 2005; Makarov et al., 2010). Die Babys in unserer Studie hatten in den ersten 6 Stunden ihres Lebens SDNN-Werte, die mit denen von Termingeborenen (Brändle et al., 2015; Schneider et al., 2018) vergleichbar (leicht höher) waren, was angesichts der längeren Aufzeichnungsdauer und des zunehmenden Gestationsalters zu erwarten war. Die Tatsache, dass die HRV vor und nach der Geburt ähnlich ist, unterstützt die Theorie, dass die Geburt bei gesunden Babys mit einer guten HRV-Stabilität verbunden ist.
Wir beobachteten bei allen HRV-Metriken eine größere Variabilität zwischen den Probanden als innerhalb der Probanden. Dies unterstreicht, dass die HRV-Analyse nicht nur auf der Grundlage von Referenzwerten interpretiert werden muss, sondern auch die Veränderungen und Fortschritte im Vergleich zu den individuellen Ausgangswerten berücksichtigt werden müssen. Während wir stündliche HRV-Änderungen während der ersten 6 Stunden des Alters beobachten konnten, wären wir möglicherweise nicht in der Lage gewesen, solche Variationen zu erkennen, wenn wir nur einen einzigen Zeitpunkt oder einen Durchschnitt analysiert hätten. Die Beobachtung solcher Trends kann weitere Erkenntnisse darüber liefern, wie sich ein Säugling im Falle einer komplizierten Entbindung oder eines Notfalleingriffs von der Geburt erholt. Die Tatsache, dass die HRV-Metriken signifikant mit reduzierten fetalen Bewegungen, anormalen CTGs, chronischen oder schwangerschaftsbedingten Erkrankungen der Mutter und Entbindungskomplikationen assoziiert waren, unterstreicht den Wert der HRV-Analyse als Maß für das allgemeine Wohlbefinden.
Der Zusammenhang zwischen HRV und fetalen Bewegungen wurde zuvor von Brändle et al. (2015) unter Verwendung der fetalen Biomagnetographie beschrieben. In ihrer Studie zur Bewertung des Verhaltenszustands auf der Grundlage von Bewegungen, die gesunde Föten von 24 bis 41 Wochen umfasste, stiegen die HRV-Metriken (aber nicht die Entropie) vom ruhigen Schlaf zum aktiven Schlaf und vom aktiven Schlaf zum Wachzustand für alle Schwangerschaftsalter an. Tatsächlich hatten Nijhuis et al. (1982) bereits eine Klassifizierung der fetalen Bewegung vorgeschlagen, die auf der fetalen HRV, der Augenbewegung und der Körperbewegung basiert.
Vorherige Autoren haben Unterschiede in den HRV-Werten zwischen verschiedenen Entbindungsmodi gefunden. Kozar et al. (2018) berichteten über niedrigere HFn und höhere LFn bei Babys, die per Kaiserschnitt geboren wurden, als bei vaginal geborenen Babys. Es ist möglich, dass ihre Ergebnisse mit der Verwendung von Thiopental für die Allgemeinanästhesie (GA) bei all ihren elektiven Eingriffen (Riznyk et al., 2005; Tsuchiya et al., 2006) und nicht mit dem Entbindungsmodus zusammenhängen, während in unserer Studie keine GA verwendet wurde. Unsere Interpretation ist, dass die HRV einen Unterschied zwischen den Entbindungsarten anzeigt, wenn es einen Unterschied im Wohlbefinden gibt, was in unserer Studie mit dem Einsatz von Instrumenten während der Entbindung aufgrund der schwierigen Extraktion in Verbindung gebracht wurde.
Grenzwerte
Wir haben den Schlafzustand der rekrutierten Säuglinge in den ersten 24 Stunden nach der Geburt nicht untersucht. Es ist unwahrscheinlich, dass Säuglinge innerhalb weniger Stunden nach der Geburt einen zirkadianen Rhythmus entwickelt haben; stattdessen folgen Neugeborene häufig ultradianen Rhythmen (Mirmiran et al., 2003). Dennoch ist es möglich, dass der leicht rückläufige Trend, den wir in der zweiten Hälfte der 24-Stunden-Aufzeichnungen beobachtet haben, auf einen größeren Anteil von schlafenden oder ruhigeren Babys zurückzuführen ist. Wir haben einige gesunde Säuglinge in unsere Studie aufgenommen, deren Mütter chronische oder schwangerschaftsbedingte Krankheiten hatten. Es könnte argumentiert werden, dass die Einbeziehung dieser Fälle unsere Definition von gesunden Neugeborenen und gesunder neonataler HRV beeinträchtigt. Die Tatsache, dass es keine signifikanten Assoziationen zwischen irgendeiner HRV-Metrik und dem pH-Wert, dem Basenüberschuss oder dem Apgar-Score gab, unterstreicht, dass unsere Stichprobe tatsächlich gesund war, da alle Babys in unserer Studie in gutem Zustand geboren wurden und keine Untersuchungen oder Behandlungen benötigten. Unser Ziel war es, das gesamte Spektrum der Geburten zu repräsentieren, die aus pragmatischer Sicht als „gesund“ gelten und klinisch behandelt werden (d. h. alle „risikoarmen“ und „unkomplizierten“ Geburten). Die Einbeziehung dieser Geburten war daher ein wichtiger Schritt, um mögliche „Abweichungen von der Norm“ zu untersuchen und unseren Datensatz zu erweitern. Ebenso haben wir mögliche Unterschiede in der HRV in verschiedenen Untergruppen untersucht (je nach klinischen Variablen, wie in Tabelle 2 beschrieben). Es ist wichtig, klarzustellen, dass unsere Studie nicht darauf abzielte, mögliche Unterschiede zwischen diesen Untergruppen im Detail zu untersuchen, und dass bei der Interpretation unserer Ergebnisse Vorsicht geboten ist. Nichtsdestotrotz glauben wir, dass die Untersuchung dieser Assoziationen für Gesundheitsteams in der Geburtshilfe und der perinatalen/neonatalen Versorgung von Interesse sein wird.
Schlussfolgerung
Wir haben die frühen postnatalen Referenzwerte für HRV-Metriken bei gesunden Terminkindern beschrieben, die bisher nicht erreicht wurden. Die HRV verändert sich während des ersten Lebenstages signifikant, insbesondere während der ersten 6 Stunden, in denen sie einen kurzen Anstieg zu zeigen scheint, gefolgt von einer Normalisierung. Die signifikanten Korrelationen zwischen der HRV und klinischen Risikovariablen stützen die Hypothese, dass die HRV ein guter Indikator für das allgemeine Wohlbefinden eines Babys ist und empfindlich darauf reagiert, geburtsbedingten Stress zu erkennen und seine Auflösung im Laufe der Zeit zu überwachen.
Datenverfügbarkeit
Die Rohdaten, die die Schlussfolgerungen dieses Manuskripts untermauern, werden von den Autoren ohne unangemessene Vorbehalte jedem qualifizierten Forscher zur Verfügung gestellt.
Ethikerklärung
Diese Studie wurde in Übereinstimmung mit den Empfehlungen der britischen Gesundheitsforschungsbehörde und der GCP ICH mit schriftlicher Einwilligung aller Probanden durchgeführt. Alle Probanden gaben ihre schriftliche Einwilligung nach Aufklärung gemäß der Erklärung von Helsinki. Das Protokoll wurde von der Londoner Chelsea-Forschungsethikkommission genehmigt.
Beiträge der Autoren
VO konzipierte die Studie, sammelte, analysierte und interpretierte die Daten, schrieb den ersten Entwurf und leitete die Entwicklung des Manuskripts. WvR trug zur Analyse und Interpretation der Daten bei und lieferte entscheidende Beiträge zur Erstellung des Manuskripts. PM und TA trugen zur Interpretation der Daten bei und leisteten wichtige Beiträge zur Ausarbeitung des Manuskripts. JM trug zum Studiendesign und zur Dateninterpretation bei, rekrutierte Patienten und sammelte Daten. VS trug zum Studienmanagement und zur Rekrutierung bei. DM überwachte alle Aspekte der HRV-Analyse und -Interpretation und leistete wichtige Beiträge zur Erstellung des Manuskripts. ST hatte die Idee und konzipierte die Studie, überwachte alle Aspekte der Studie und leitete die Entwicklung des Manuskripts.
Finanzierung
VO wurde durch das NIHR ICA Doctoral Research Fellowship finanziert. PM wurde durch das MRC Doctoral Research Fellowship finanziert. Die geäußerten Ansichten sind die des Autors/der Autoren und nicht unbedingt die des NIHR oder des Gesundheitsministeriums.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken allen Eltern, die der Teilnahme ihrer Babys an dieser Studie zugestimmt haben, und Herrn Paul Basset (medizinischer Statistiker) für seine Unterstützung bei der statistischen Analyse der in diesem Manuskript enthaltenen Daten.
Adjei, T., Rosenberg, W., Von, Nakamura, T., und Chanwimalueang, T. (2019). The classA framework : HRV-basierte Bewertung der SNS- und PNS-Dynamik ohne LF-HF-Kontroversen. Front. Physiol. 10:505. doi: 10.3389/fphys.2019.00505
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract |Ref Full Text | Google Scholar
Aldrich, C. J., D’Antona, D., Spencer, J. A. D., Delpy, D. T., Reynolds, E. O. R., und Wyatt, J. S. (1996). Veränderungen der fetalen Herzfrequenz und der zerebralen Oxygenierung, gemessen durch Nahinfrarotspektroskopie während der ersten Phase der Wehen. Eur. J. Obstet. Gynecol. Reprod. Biol. 64, 189-195. doi: 10.1016/0301-2115(95)02284-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Brändle, J., Preissl, H., Draganova, R., Ortiz, E., Kagan, K. O., Abele, H., et al. (2015). Herzfrequenzvariabilitätsparameter und fetale Bewegungen ergänzen die Erfassung fetaler Verhaltenszustände mittels Magnetographie zur Überwachung der neurovegetativen Entwicklung. Front. Hum. Neurosci. 9:147. doi: 10.3389/fnhum.2015.00147
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Doyle, O. M., Korotchikova, I., Lightbody, G., Marnane, W., Kerins, D., and Boylan, G. B. (2009). Herzfrequenzvariabilität während des Schlafs bei gesunden Neugeborenen in der frühen postnatalen Phase. Physiol. Meas. 30, 847-860. doi: 10.1088/0967-3334/30/8/009
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
CrossRef Full Text | Google Scholar
Goulding, R. M., Stevenson, N. J., Murray, D. M., Livingstone, V., Filan, P. M., and Boylan, G. B. (2015). Herzfrequenzvariabilität bei hypoxischer ischämischer Enzephalopathie: Korrelation mit EEG-Grad und 2-Jahres-Neuroentwicklungsergebnis. Pediatr. Res. 77, 681-687. doi: 10.1038/pr.2015.28
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Laborde, S., Mosley, E., and Thayer, J. F. (2017). Herzfrequenzvariabilität und kardialer Vagustonus in der psychophysiologischen Forschung – Empfehlungen zur Versuchsplanung, Datenanalyse und Datenberichterstattung. Front. Psychol. 8:1-18. doi: 10.3389/fpsyg.2017.00213
PubMed Abstract | CrossRef Full Text | Google Scholar
Lees, T., Shad-Kaneez, F., Simpson, A. M., Nassif, N. T., Lin, Y., and Lal, S. (2018). Herzfrequenzvariabilität als Biomarker zur Vorhersage von Schlaganfall, Komplikationen nach Schlaganfall und Funktionalität. Biomark. Insights 13:117727191878693. doi: 10.1177/1177271918786931
PubMed Abstract | CrossRef Full Text | Google Scholar
Longin, E., Schaible, T., Lenz, T., and König, S. (2005). Kurzzeitige Herzfrequenzvariabilität bei gesunden Neugeborenen: normative Daten und physiologische Beobachtungen. Early Hum. Dev. 81, 663-671. doi: 10.1016/j.earlhumdev.2005.03.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Lucchini, M., Burtchen, N., Fifer, W., and Signorini, M. (2019). Multiparametrische kardiorespiratorische Analyse bei Spätgeborenen, Frühgeborenen und Vollgeborenen bei der Geburt. Med. Biol. Eng. Comput. 57, 99-106. doi: 10.1007/s11517-018-1866-4
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
CrossRef Full Text | Google Scholar
Musa, S. M., Adam, I., Hassan, N. G., Rayis, D. A., and Lutfi, M. F. (2017). Maternal heart rate variability during the first stage of labor. Front. Physiol. 8:1-6. doi: 10.3389/fphys.2017.00774
CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Pomeranz, B., Macaulay, R. J., Caudill, M. A., Kutz, I., Adam, D., Gordon, D., et al. (1985). Bewertung der autonomen Funktion beim Menschen durch Herzfrequenz-Spektralanalyse. Am. J. Physiol. 248, H151-H153. doi: 10.1152/ajpheart.1985.248.1.H151
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes-Lagos, J. J., Echeverría-Arjonilla, J. C., Peña-Castillo, M. Á, García-González, M. T., Ortiz-Pedroza Mdel, R., Pacheco-López, G., et al. (2015). Ein Vergleich der Herzfrequenzvariabilität bei Frauen im dritten Trimester der Schwangerschaft und während risikoarmer Wehen. Physiol. Behav. 149, 255-261. doi: 10.1016/j.physbeh.2015.05.041
PubMed Abstract |Ref Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, U., Bode, F., Schmidt, A., Nowack, S., Rudolph, A., Doelcker, E. M., et al. (2018). Developmental milestones of the autonomic nervous system revealed via longitudinal monitoring of fetal heart rate variability. PLoS One 13:1-13. doi: 10.1371/journal.pone.0200799
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Shaffer, F., and Ginsberg, J. P. (2017). An overview of heart rate variability metrics and norms. Front. Public Heal. 5:1-17. doi: 10.3389/fpubh.2017.00258
PubMed Abstract | CrossRef Full Text | Google Scholar
CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Toichi, M., Sugiura, T., Murai, T., and Sengoku, A. (1997). Eine neue Methode zur Bewertung der autonomen Herzfunktion und ihr Vergleich mit der Spektralanalyse und dem Variationskoeffizienten des R-R-Intervalls. J. Auton. Nerv. Syst. 62, 79-84. doi: 10.1016/S0165-1838(96)00112-9
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar