Introduction
Bacillus- ja Clostridium-sukujen gram-positiiviset bakteerit voivat erilaistua muodostaakseen endosporin (itiön), aineenvaihdunnallisesti hiljaisen solun, joka syntyy vastauksena olosuhteisiin, jotka eivät salli solun kasvua (McKenney ym., 2012). Kun itiö vapautuu ympäristöön, se selviytyy lepotilassaan erittäin pitkiä aikoja ja kestää hyvin monenlaisia stressitekijöitä, kuten korkeita lämpötiloja, kuivumista, ravinteiden puutetta ja myrkyllisten kemikaalien läsnäoloa (McKenney et al., 2012). Lepotilassa oleva itiö pystyy kuitenkin jatkuvasti seuraamaan ympäristöä ja reagoimaan veden ja ravinteiden läsnäoloon itämällä ja synnyttämällä vegetatiivisen solun, joka pystyy kasvamaan ja itämään (McKenney et al., 2012). Kestävyys ei-fysiologisissa olosuhteissa johtuu osittain itiöiden pintarakenteista. Bacillus subtiliksessa, itiönmuodostajien mallisysteemissä, itiön pinta on järjestäytynyt monikerroksiseen vaippaan ja äskettäin löydettyyn kuoreen, joka ympäröi itiön vaippaa (McKenney et al., 2012). B. subtilis -itiöt ovat negatiivisesti varautuneita (Huang ym., 2010; Pesce ym., 2014) ja niillä on suhteellinen hydrofobisuus, joka johtuu osittain joidenkin itiöpinnan proteiinien glykosylaatiosta (Cangiano ym., 2014; Rusciano ym., 2014). Useilla Bacillus- ja Clostridium-lajeilla, mukaan lukien B. cereus, B. anthracis, B. megaterium ja C. difficile, uloin itiörakenne on eksosporium, morfologisesti erillinen proteiineista ja glykoproteiineista koostuva kerros, joka ympäröi vaippaa (Díaz-González ym., 2015; Manetsberger ym, 2015b; Stewart, 2015).
Bakteerin itiötä on ehdotettu alustaksi heterologisten proteiinien esittämiseen, ja sen potentiaaliset käyttökohteet vaihtelevat limakalvo-rokotteiden kehittämisestä uudelleenkäytettäviin biokatalyytteihin, diagnostisiin välineisiin ja bioremediaatiolaitteisiin (Knecht ym., 2011; Isticato ja Ricca, 2014; Ricca ym., 2014). Itiöiden huomattava ja hyvin dokumentoitu vastustuskyky (McKenney et al., 2012), useiden itiöitä muodostavien lajien soveltuvuus geneettiseen manipulointiin (Harwood ja Cutting, 1990) ja useiden lajien turvallisuus (Cutting, 2011; Baccigalupi et al., 2015) tukevat itiöiden käyttöä näyttö- ja toimitusjärjestelmänä. Heterologisten proteiinien näyttämiseksi itiön pinnalla on kehitetty kaksi strategiaa. Rekombinanttistrategiaa, joka perustuu geenifuusioiden rakentamiseen valitun itiön pintaproteiinia koodaavan DNA:n ja näytettävää proteiinia koodaavan DNA:n välille, on vuosien mittaan käytetty erilaisten heterologisten proteiinien näyttämiseen (Isticato ja Ricca, 2014). Puhdistettujen itiöiden ja puhdistettujen proteiinien väliseen spontaaniin adsorptioon perustuvaa ei-rekombinanttista lähestymistapaa on myös käytetty erilaisten entsyymien ja antigeenien näyttämiseen (Ricca et al., 2014). Itiöiden adsorptiota ohjaavia molekulaarisia yksityiskohtia ei ole täysin selvitetty. Tiedetään, että adsorptio on tehokkaampaa, kun sitoutumispuskurin pH on hapan (pH 4) (Huang et al., 2010; Sirec et al., 2012) ja että vuorovaikutukseen osallistuu todennäköisesti sähköstaattisten ja hydrofobisten vuorovaikutusten yhdistelmä (Huang et al., 2010; Sirec et al., 2012). Tiedetään myös, että mutantti-itiöt, joiden itiöpinnat ovat voimakkaasti muuttuneet, ovat tehokkaammin vuorovaikutuksessa malliproteiinien kanssa kuin isogeeniset villityypin itiöt (Sirec et al., 2012; Donadio et al., 2016).
Tässä käytimme fluoresoivaa proteiinia, korallin Discosoma sp. punaisen fluoresoivan proteiinin (mRFP, Red Fluorescent Protein) monomeeristä muotoa (Campbell et al., 2002), arvioidaksemme, pystyvätkö B. megateriumin itiöt olemaan vuorovaikutuksessa ja adsorboimaan heterologisen malliproteiinin kanssa. B. megaterium käsittää useita morfologisesti erilaisia kantoja, joilla on yhteiset epätavallisen suuret mitat sekä soluissa (pituus jopa 4 μm ja halkaisija 1,5 μm) että itiöissä (pituus jopa 3 μm ja halkaisija 1 μm) (Di Luccia et al., 2016). Joidenkin B. megaterium -kantojen itiöitä ympäröi eksosporium, ja koska adsorptioalustoina on toistaiseksi pidetty vain sellaisten lajien itiöitä, joilla ei ole eksosporiumia, ei ole saatavilla tietoja eksosporiumin vaikutuksesta vuorovaikutuksessa heterologisten proteiinien kanssa.
QM B1551 -kanta on parhaiten karakterisoitu B. megaterium -kanta. Tämä kanta kantaa noin 11 % genomistaan seitsemällä kotoperäisellä plasmidilla (Rosso ja Vary, 2005; Vary et al., 2007; Eppinger et al., 2011), joista kahden – pBM500:n ja pBM600:n – on tunnistettu kantavan geenejä, jotka ovat välttämättömiä tämän kannan tunnusomaisen ”saksanpähkinän muotoisen” eksosporiumin muodostumiselle (Manetsberger et al., 2015a). QM B1551:n eksosporiumin proteiinikoostumus on toistaiseksi heikosti karakterisoitu, ja genomianalyyseillä on tunnistettu vain muutamia geenejä, jotka koodaavat ortologeja muiden lajien itiöissä tunnistetuista eksosporiumin proteiineista. Näihin kuuluvat geenit, jotka koodaavat BclA-nap-proteiineja, jotka muodostavat B. megaterium QM B1551:n itiöissä paikallisen napin, sekä BxpB-proteiinin ortologi, joka muodostaa eksosporiumin tyvikerroksen B. cereus -perheen itiöissä. Jälkimmäisellä näyttäisi olevan erilainen tehtävä B. megaterium QM B1551:n itiöissä, sillä nollamutaatiokannassa säilyi ilmeisesti normaali eksosporium (Manetsberger et al., 2015a).
Tässä artikkelissa esitämme tietoja, jotka osoittavat, että B. megaterium QM B1551:n itiöt kykenevät tehokkaasti adsorboimaan mRFP:tä, ja tarjoamme todisteita siitä, että proteiinimolekyylit kykenevät ylittämään eksosporiumin esittämän läpäisevyysesteen paikallistuakseen päällysteiden väliseen tilaan.
Materiaalit ja menetelmät
Bakteerikannat, itiöt ja RFP:n tuotanto
Tässä tutkimuksessa käytetyt B. megaterium -kannat ovat QM B1551 ja sen plasmiditon johdannainen PV361 (Rosso ja Vary, 2005). Tässä tutkimuksessa käytetty B. subtilis -kanta oli PY79 (Youngman et al., 1984). Kaikkien Bacillus-kantojen sporulaatio indusoitiin uupumusmenetelmällä (Cutting ja Vander Horn, 1990). Kun itiöitä oli kasvatettu 30 tuntia Difco Sporulation (DS) -alustassa 37 °C:ssa voimakkaasti ravistellen, ne kerättiin ja puhdistettiin Nicholsonin ja Setlow’n (1990) kuvaamalla tavalla inkuboimalla niitä yön yli H2O:ssa 4 °C:ssa jäljellä olevien itiösolujen liuottamiseksi. Saatujen puhdistettujen itiöiden määrä mitattiin suoralla laskennalla Bürkerin kammiolla optisen mikroskoopin alla (Olympus BH-2, jossa on 40-kertainen linssi).
MRFP:n tuotantoa varten käytettiin Escherichia coli -kannan RH161 soluja (Donadio et al., 2016), jossa oli ekspressiovektori pRSET-A, joka sisältää rfp:n koodaavan alueen 5′-pään in-frame-fuusion kuuteen histidiinikodoniin T7-promoottorin transkriptio-ohjauksessa, kasvatettiin 18 tuntia 37 °C:ssa 100 ml:ssa autoinduktioväliaineessa heterologisen proteiinin ilmentämiseksi (Isticato ym., 2010). His6-merkitty RFP-proteiini puhdistettiin natiiviolosuhteissa käyttämällä His-Trap-kolonnia valmistajan suositusten mukaisesti (GE Healthcare Life Science). Puhdistettu proteiini suolanpoistettiin PD10-kolonnilla (GE Healthcare Life Science) korkeiden NaCl- ja imidatsolipitoisuuksien poistamiseksi.
Adsorptioreaktio
Jos ei ole toisin määritelty, 5 μg puhdistettua rekombinantti mRFP:tä lisättiin itiöiden suspensioon (5 × 108) 50 mM natriumsitraatissa pH 4,0 25 °C:n lämpötilassa lopputilavuuteen 200 μl. Yhden tunnin inkubaation jälkeen sitovaa seosta sentrifugoitiin (10 min 13 000 g:ssa), jotta pelletissä olevat mRFP:hen sitoutuneet itiöt saatiin fraktioitua supernatantissa olevasta vapaasta mRFP:stä.
Western- ja Dot-Blot-analyysi
Adsorptioreaktioista saadut itiöpelletit suspendoitiin uudestaan 40 μl:aan itiöemänkalvon uuttamispuskuria (Nicholson ja Setlow, 1990; Giglio ym., 1990; Giglio ym., 1990), 2011), inkuboitiin 68 °C:ssa 1 h itiökuoren proteiinien liuottamiseksi ja ladattiin 12 % SDS-PAGE-geelille. Proteiinit siirrettiin sitten sähköisesti nitroselluloosasuodattimille (Amersham Pharmacia Biotech) ja käytettiin Western blot -analyysiin, kuten aiemmin on raportoitu (Isticato et al., 2008), käyttäen monoklonaalista mRFP:n tunnistavaa anti-His-vasta-ainetta (Sigma). Kvantitatiivinen määritys mRFP:n määrästä saatiin dot blot -kokeilla, joissa verrattiin puhdistetun mRFP:n ja sitoutumiskokeen supernatantin sarjalaimennoksia. Tämän jälkeen suodokset visualisoitiin ECL-prime-menetelmällä (Amersham Pharmacia Biotech) ja niille tehtiin densitometrinen analyysi Quantity One 1-D Analysis -ohjelmistolla (Bio-Rad). Dot blot- ja suhteelliset densitometriset analyysit tehtiin kolme kertaa tulosten merkityksen tarkistamiseksi.
Fluoresenssi- ja immunofluoresenssimikroskopia
Adsorptiota seuraavat itiöt resuspensioitiin 50 μl:aan 1x PBS pH 4,0:aa ja 5 μl suspensiota asetettiin mikroskooppilasille ja peitettiin peitinliu’uilla, jotka oli käsitelty aiemmin 30 s:n ajaksi poly-L-lysiiniä sisältävällä poly-L-lysiiniä sisältävällä liu’ulla (Sigma). Immunofluoresenssi suoritettiin Isticaton ym. (2013) kuvaamalla tavalla seuraavin muutoksin: QM B1551- ja PV361 B. megaterium -kantojen 2,0 × 106 RFP-adsorboitua itiötä esikäsiteltiin 1 % naudan seerumin albumiinilla (BSA) – 1x PBS pH 4,0 30 minuutin ajan ennen 2 tunnin inkubointia 4 ° C: ssa anti-polyHistidiini-vasta-aineilla (hiiri; Sigma), jotka on laimennettu 1:20 1x PBS pH 4,0-1 % BSA: ssa. Tämän tekniikan spesifisyyden kontrolloimiseksi adsorboimattomat itiöt käsiteltiin suoraan anti-His-vasta-aineilla. Kolmen pesun jälkeen näytteet inkuboitiin 64-kertaisesti laimennetulla hiiren vasta-aineella, joka oli konjugoitu fluoreseiini-isotiosyanaatilla, FITC (Santa Cruz Biotechnology, Inc.), ja pestiin neljä kertaa 1x PBS pH 4,0:lla. Pestyt näytteet suspendoitiin uudelleen 20 μl:aan 1x PBS pH 4,0:aa ja 10 μl analysoitiin. Kaikkia näytteitä havainnoitiin Olympus BX51 -fluoresenssimikroskoopilla, johon oli asennettu 100 × UPlan F1 -öljyobjektiivi; U-MNG- tai U-MWIBBP-kuutiosuodattimia käytettiin mRFP:n punaisen fluoresenssiemissiota tai FITC-konjugoitujen vasta-aineiden vihreää emissiota havaitsemaan. Valotusajat olivat välillä 200-3000 ms. Kuvat otettiin Olympus DP70 -digitaalikameralla ja käsiteltiin Image Analysis Software -ohjelmistolla (Olympus) kirkkauden, kontrastin ja väritasapainon pienten säätöjen suorittamiseksi (McCloy et al., 2014). ImageJ:tä (v1.48, NIH) käytettiin piirtämään ääriviivat 80 itiön ympärille kunkin kannan osalta, ja kunkin itiön osalta kirjattiin minimi-, maksimi- ja keskimääräinen fluoresenssiarvo pikseliä kohti. Fluoresenssin intensiteetin arvot esitettiin myöhemmin laatikkosuunnitelmina 5-95 %:n luottamusväleillä (McCloy et al., 2014).
Statistinen analyysi
Pisteblot- ja fluoresenssimikroskopia-analyysien tulokset ovat kolmen riippumattoman kokeen keskiarvoja. Tilastollinen merkitsevyys määritettiin Studentin t-testillä, ja merkitsevyystasoksi asetettiin P < 0,05.
Tulokset
mRFP of Discosoma sp. is Adsorbed by B. megateriumin itiöt
Varmistaaksemme, pystyivätkö B. megaterium QM B1551:n itiöt adsorboimaan mRFP:tä, 5 μg puhdistettua proteiinia (Materiaalit ja menetelmät) inkuboitiin 5,0 × 108 puhdistetun itiön kanssa. Adsorptioreaktio suoritettiin 50 mM natriumsitraatissa pH 4,0:ssa, kuten aiemmin on kuvattu (Sirec et al., 2012). Reaktion jälkeen itiöt pestiin laajasti 1x PBS pH 4,0:lla, itiöiden pintaproteiinit uutettiin kohdassa Materiaalit ja menetelmät kuvatulla tavalla ja analysoitiin western blotting -menetelmällä anti-polyHistidine-Peroxidase -vasta-aineella (Sigma), joka tunnistaa mRFP:n histidiini-merkityn N-terminaalin. Kuten kuvassa 1A näkyy, mRFP uutettiin itiöistä, mikä osoittaa, että se imeytyi reaktion aikana ja vapautui sitten uuttokäsittelyllä. Adsorption tehokkuuden arvioimiseksi analysoimme sitoutumatta jääneen mRFP:n määrän, eli adsorboitujen itiöiden jälkeen itiöt kerättiin sentrifugoimalla ja supernatantti laimennettiin sarjallisesti ja analysoitiin pisteblottaamalla (kuva 1B). Pisteblotin densitometrinen analyysi (lisätaulukko 1) osoitti, että kun adsorptioreaktiossa käytettiin 5 μg mRFP:tä, alle 1 % jäi sitoutumatta, mikä osoittaa, että noin 99 % heterologisesta proteiinista adsorboitui B. megateriumin itiöihin

KUVIO 1. Heterologisen proteiinin adsorboituminen itiöihin. Bacillus megaterium QM B1551:n itiöt adsorboivat mRFP:tä. 5 × 108 itiötä inkuboitiin 5 μg puhdistetun mRFP:n kanssa, minkä jälkeen näytteet sentrifugoitiin. (A) Sporien pintaproteiinit uutettiin pellettifraktiosta SDS-DTT-käsittelyllä, fraktioitiin SDS-PAGE:lla ja analysoitiin Western blotilla. Markkerina käytettiin puhdistettua mRFP:tä (20 μg). (B) Supernatantti, joka sisälsi sitoutumatonta mRFP:tä, laimennettiin sarjaan ja analysoitiin dot blotilla (QM B1551). Standardina käytettiin puhdistetun mRFP:n (mRFP) sarjalaimennoksia. (C) mRFP:llä adsorboituneet itiöt pestiin kahdesti (W1 ja W2) PBS-puskurilla, jonka pH oli 3,0 tai 7,0, tai 1 M NaCl, 0,1 % Triton X-100 -liuoksella. Standardeina käytettiin puhdistetun mRFP:n ja sitoutumattoman mRFP:n (UN-mRFP) sarjalaimennoksia. Immunoreaktiot kaikissa paneeleissa tehtiin mRFP:n tunnistavalla anti-His-vasta-aineella, joka oli konjugoitu piparjuuriperoksidaasilla.
Analysoidaksemme, olivatko adsorboituneet mRFP-molekyylit tiukasti sidottuja itiön pintaan, adsorptioreaktion jälkeiset itiöt pestiin kahdesti PBS-puskurilla, jonka pH oli pH:ssa 3,0 tai pH:ssa 7,0, tai liuoksella, joka sisälsi 1M NaCl, 0,1 %:n pitoisuuksina 0,1 %:n pitoisuuksina 1M NaCl, 0,1 %:n pitoisuuksina 1M:n pitoisuuksina 0,1 %:aa Triton X-100:aa, kuten on jo aiemmin kuvattu (Donadio et ai., 2016). Kuten kuvasta 1C käy ilmi ja kuten dot blotin densitometrinen analyysi tukee (lisätaulukko 2), pesut pH:lla 3,0 eivät aiheuttaneet adsorboituneen mRFP:n irtoamista, kun taas pesut pH:lla 7,0 tai 1M NaCl, 0,1 % Triton X-100 -liuoksella aiheuttivat minimaalisen, alle 1 %:n, mRFP-molekyylien irtoamisen. Näin ollen kuvassa 1 esitetyt tulokset viittaavat siihen, että mRFP adsorboitui tehokkaasti ja sitoutui tiukasti B. megateriumin itiöihin. Arvioidaksemme, säilyttivätkö itiöihin adsorboituneet mRFP-molekyylit fluoresenssiominaisuutensa, teimme fluoresenssimikroskopia-analyysin. Kuten kuvasta 2 nähdään, adsorptioreaktion jälkeisiin itiöihin liittyi voimakas fluoresenssisignaali, joka näkyi koko itiön pinnan ympärillä.
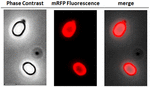
KUVA 2. Adsorptioreaktion jälkeiset itiöt. B. megaterium QM B1551-mRFP:n B. megaterium QM B1551-mRFP- itiöiden fluoresenssimikroskopia-analyysi. QM B1551:n itiöt, jotka inkuboitiin mRFP:llä (5 μg) ja pestiin sen jälkeen, analysoitiin fluoresenssimikroskopialla. Samaa mikroskopointikenttää tarkasteltiin vaihekontrasti- ja fluoresenssimikroskopialla. Mittakaavapalkki 1 μm. Yhdistelmäpaneeli on raportoitu. Valotusaika oli 200 ms.
Exosporiumilla on olennainen rooli mRFP:n adsorptiossa
B. megateriumin QM B1551-rotu sisältää seitsemän kotoperäistä plasmidia (Rosso ja Vary, 2005; Eppinger ym., 2011), ja plasmidien koodaamat geenit ovat välttämättömiä eksosporiumin muodostumiselle (Manetsberger ym., 2015a). PV361 on QM B1551-käsitelty kanta, josta puuttuvat kaikki seitsemän plasmidia ja josta näin ollen puuttuu kokonaan eksosporium (Manetsberger ym., 2015a). Käytimme PV361-kannan itiöitä analysoidaksemme eksosporiumin roolia mRFP-adsorptiossa. Samanaikaisesti käytimme myös itiöitä B. subtilis PY79, joiden on aiemmassa tutkimuksessa osoitettu adsorboivan mRFP:tä (Donadio et al., 2016). Vertaillaksemme B. subtilis PY79- ja B. megaterium QM B1551- ja PV361 -kantojen itiöiden adsorptiotehokkuutta, adsorboimme 5 μg puhdistettua mRFP:tä 5,0 × 108 itiöllä kustakin kolmesta kannasta. Adsorptioreaktioiden jälkeen itiöt kerättiin sentrifugoimalla, proteiinit uutettiin SDS-DTT-käsittelyllä ja analysoitiin western blottingilla mRFP:n tunnistavalla anti-His-vasta-aineella. Kuten kuvasta 3A käy ilmi, mRFP:tä uutettiin ilmeisesti suurempia määriä QM B1551:n itiöistä kuin kahden muun kannan itiöistä. Näiden ilmeisten erojen kvantifioimiseksi adsorptioreaktioista sitoutumatonta mRFP:tä laimennettiin sarjaan ja analysoitiin pisteblottauksella (kuva 3B). Kuvan 3B dot blotin densitometrinen analyysi (lisätaulukko 3) osoitti, että PY79- ja PV361- itiöt adsorboivat noin 90 % koko mRFP:stä, kun taas QM B1551- itiöt adsorboivat lähes kaiken (yli 99 %) puhdistetun mRFP:n.
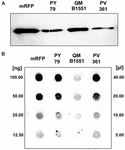
KUVIO 3. PY79- ja PV361- itiöt adsorboivat noin 90 % koko mRFP:stä. Monomeerisen punaisen fluoresoivan proteiinin adsorptio B. megaterium QM B1551:n ja PV361:n sekä B. subtilis PY79:n itiöihin. Kunkin kannan 5 × 108 itiötä inkuboitiin 5 μg:n puhdistetun mRFP:n kanssa, minkä jälkeen näytteet sentrifugoitiin. Pelletöityjen fraktioiden itiöitä käytettiin pintaproteiinien uuttamiseen, jotka analysoitiin myöhemmin western blot -menetelmällä (A), kun taas supernatantit laimennettiin sarjaan ja analysoitiin dot blot -menetelmällä (B). Standardeina käytettiin puhdistetun mRFP:n sarjalaimennoksia. Immunoreaktiot molemmissa paneeleissa tehtiin anti-His-vasta-aineella, joka oli konjugoitu piparjuuriperoksidaasilla.
Kolmen kannan itiöiden adsorptiotehokkuutta analysoitiin myös fluoresenssimikroskopialla (kuva 4A ja lisäkuva S1). Mikroskooppikuvat analysoitiin ImageJ-ohjelmistolla (v1.48, NIH) kvantitatiivisen fluoresenssikuva-analyysin suorittamiseksi, ja itiöiden fluoresenssi laskettiin kohdassa Materiaalit ja menetelmät kuvatulla tavalla. Kunkin kannan 80 itiön analyysi osoitti, että keskimääräinen fluoresenssiarvo pikseliä kohti oli 52,43 (± 5,94), 20,81 (± 2,71) ja 32,33 (± 2.97; mielivaltaiset yksiköt) QM B1551:llä, PV361:llä ja PY79:llä (kuva 4B), mikä antaa lisätodisteita siitä, että QM B1551:n itiöt adsorboivat enemmän mRFP:tä kuin kahden muun kannan itiöt.
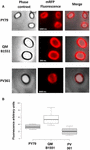
KUVA 4. QM B1551:n itiöt adsorboivat enemmän mRFP:tä kuin kahden muun kannan itiöt. B. megaterium QM B1551:n ja PV361:n sekä B. subtilis PY79:n itiöiden mRFP:n adsorptiotehokkuus. (A) Fluoresenssimikroskopiakuvat PY79:n, QM B1551:n ja PV361:n itiöistä mRFP-adsorption ja pesun jälkeen. Valotusajat on merkitty. Vaihekontrasti- ja punaisen fluoresenssin päällekkäiskuvat on esitetty (yhdistelmäpaneeli). Mittakaavapalkit 1 μm. (B) Laatikkokaaviot, joissa esitetään kunkin kannan kahdeksankymmenen eri itiön fluoresenssin intensiteetti. Kunkin laatikon rajat edustavat ensimmäistä ja kolmatta kvartiilia (25 ja 75 %), ja laatikoiden ulkopuolella olevat arvot edustavat enimmäis- ja vähimmäisarvoja. Laatikkoa jakava viiva osoittaa kunkin kannan mediaaniarvon. P-arvo on alle 0,0001.
Kuvien 3 ja 4 tulosten perusteella voimme päätellä, että QM B1551:ssä esiintyvällä ja PV361:stä puuttuvalla eksosporiumilla on merkittävä rooli mRFP:n adsorptiossa.
Lisäksi kuvan 4 tulokset osoittivat, että B. subtilis PY79:n itiöt adsorboivat mRFP:tä tehokkaammin kuin B. megaterium PV361:n itiöt, kun taas kuvassa 3B raportoitu dot blotting osoitti, että näiden kahden kannan adsorptiotehokkuus oli samanlainen. Uskomme, että tämä ero johtuu fluoresenssin voimakkaasta vähenemisestä, kun mRFP sitoutuu PV361:n itiöihin mutta ei PV361:n PV361:n itiöihin eikä PV361:n PV361:n PV361:n itiöihin (ks. jäljempänä).
Quantitatiivinen arviointi mRFP:n adsorptiosta QM B1551:n itiöihin
Dot blot -kokeet (kuva 3B) osoittivat, että kun 5 μg puhdistettua mRFP:tä käytettiin adsorptioreaktioissa 5,0 × 108 QM B1551 -kannan itiön kanssa, lähes kaikki heterologinen proteiini sitoutui itiöön. Määrittääksemme QM B1551 -kannan itiöihin adsorboituvan mRFP:n enimmäismäärän toistimme reaktiot kasvavilla puhdistetun mRFP:n pitoisuuksilla, eli 5,0 × 108 QM B1551 -kannan itiöihin reagoitiin 5, 10, 20, 40, 80 ja 160 μg:n puhdistetun mRFP:n kanssa. Reaktioiden jälkeen itiöt kerättiin sentrifugoimalla, ja supernatantit, jotka sisälsivät sitoutumatonta mRFP:tä, laimennettiin sarjaan ja analysoitiin pisteblottaamalla (kuva 5A). Kuvassa 5B esitetään dot blotin densitometrisen analyysin tulokset (??), jotka osoittavat, että kun 5-80 μg mRFP:tä reagoi 5 × 108 itiön kanssa, itiöihin sitoutuneen proteiinin osuus oli yli 90 prosenttia. Sitoutuneen mRFP:n määrä väheni, kun reaktiossa käytettiin 160 μg puhdistettua proteiinia. Kuitenkin silloinkin, kun käytettiin 160 μg puhdistettua mRFP:tä, yli 60 % proteiinista absorboitui, mikä osoittaa, että 5,0 × 108 QM B1551:n itiötä voi adsorboida noin 100 μg mRFP:tä.
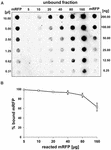
KUVIO 5. QM B1551:n itiöemät. Kvantitatiivinen arviointi mRFP:n adsorptiosta B. megaterium QM B1551:n itiöihin. 5 × 108 itiötä inkuboitiin 5, 10, 20, 40, 80 ja 160 μg:n puhdistetun mRFP:n kanssa. Reaktioseokset sentrifugoitiin tämän jälkeen ja supernatantit laimennettiin sarjaan ja analysoitiin dot blotilla (A). Standardeina käytettiin puhdistetun mRFP:n sarjalaimennoksia. Immunoreaktiot molemmissa paneeleissa tehtiin anti-His-vasta-aineella, joka oli konjugoitu piparjuuriperoksidaasilla. (B) itiöihin adsorboituneen mRFP:n prosenttiosuus sen jälkeen, kun se oli reagoinut määriteltyjen endogeenisten mRFP-määrien kanssa. Virhepalkit kuvaavat kolmen kokeen keskiarvon keskivirheitä, ja P-arvo ei koskaan yli 0,0025.
mRFP lokalisoituu B. megaterium QM B1551:n itiöiden päällysteiden väliseen tilaan
Immunofluoresenssimikroskopialla arvioitiin, oliko adsorboituneita mRFP-molekyylejä alttiina B. megaterium QM B1551:n itiöiden pinnalla. QM B1551:n itiöt, joihin oli adsorboitu erilaisia mRFP-määriä, reagoivat monoklonaalisen anti-His-vasta-aineen kanssa, joka tunnisti rekombinantti mRFP:n, ja sen jälkeen fluoresoivan anti-hiiren sekundäärivasta-aineen (Santa Cruz Biotechnology, Inc.) kanssa, ja niitä havainnoitiin fluoresenssimikroskoopilla (kuva 6). Pienimmällä tässä kokeessa käytetyllä mRFP:n määrällä (2 μg) mRFP:n fluoresenssisignaali (punainen) havaittiin kaikkialla itiön ympärillä, kun taas immunofluoresenssisignaali (vihreä) oli heikko ja keskittyi pääasiassa itiön napoihin, mikä viittaa siihen, että vain näissä kohdissa mRFP oli alttiina itiön pinnalla. Reaktiossa käytetyn mRFP:n määrän kasvaessa vihreiden pisteiden määrä kasvoi (5 ja 10 μg), ja suurimmalla reaktiossa käytetyllä mRFP:n määrällä (20 μg) itiöiden ympärillä havaittiin lähes täydellinen vihreä rengas. Kuvassa 6 esitettyjen tulosten perusteella oletimme, että mRFP-molekyylit tunkeutuvat eksosporiumin läpi ja lokalisoituvat ulkokuoren ja eksosporiumin väliseen tilaan, eli kun käytetään pientä määrää mRFP:tä, lähes kaikki proteiinimolekyylit ovat eksosporiumin sisäisiä ja vasta-aineen saatavilla vain muutamassa paikassa. Adsorptioreaktioissa mRFP:n määrän kasvattaminen johtaa siihen, että päällysteen välinen tila ”täyttyy”, kunnes lopulta vasta-aineen käytettävissä on enemmän mRFP-molekyylejä itiön pinnalla. Tämä hypoteesi merkitsee, että jos eksosporium puuttuu, kaiken mRFP:n pitäisi olla vasta-aineen käytettävissä. Tämän testaamiseksi verrattiin immunofluoresenssimikroskopialla samoja mRFP-määrillä (5 μg) inkuboituja QM B1551:n (exosporiumin kanssa) ja PV361:n (ilman exosporiumia) itiöitä. Kun eksosporium oli läsnä (QM B1551), mRFP oli vain osittain vasta-aineen käytettävissä ja vihreitä täpliä havaittiin (kuva 7 ja täydentävä kuva S2). Kun eksosporiumia ei ollut läsnä (PV361), adsorboitunut mRFP oli vasta-aineen käytettävissä koko itiön ympärillä ja muodostui täydellinen vihreä rengas, mikä tukee hypoteesia, jonka mukaan mRFP on QM B1551:n itiöiden eksosporiumin sisäinen.
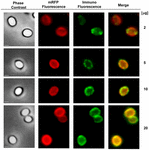
KUVA 6. Immunofluoresenssianalyysi mRFP:n adsorboituneista B. megateriumin QM B1551:n itiöistä. Aliquotteja 5 × 108 QM B1551:n itiötä inkuboitiin vaihtelevilla mRFP-pitoisuuksilla, ja ne analysoitiin sen jälkeen faasikontrasti-, fluoresenssi- ja immunofluoresenssimikroskopialla Materiaalit ja menetelmät -osassa kuvatulla tavalla. Sama mikroskooppikenttä jokaisesta reaktiosta ilmoitetaan yhdessä yhdistelmäpaneelin kanssa. Valotusaika oli 200 ms kaikissa kuvissa. Mittakaavapalkki, 1 μm.
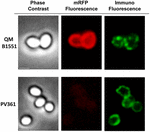
KUVA 7. Aineisto, joka on esitetty kuvissa. B. megaterium QM B1551- ja PV361- itiöihin adsorboituneen mRFP:n immunofluoresenssi. 5 × 108 QM B1551:n ja PV361:n itiötä inkuboitiin 5 μg mRFP:n kanssa, minkä jälkeen ne analysoitiin immunofluoresenssimikroskopialla Materiaalit ja menetelmät -osassa kuvatulla tavalla. Kustakin kentästä esitetään vaihekontrasti ja immunofluoresenssimikroskopia. Valotusaika oli 200 ms kaikissa kuvissa. Mittakaavapalkki, 1 μm.
Ja vaikka kuvan 7 kokeissa käytetyissä QM B1551- itiöissä näkyi täydellinen punainen fluoresoiva rengas kuten kuvassa 2, PV361- itiöissä näkyi hyvin heikko punainen fluoresoiva signaali. PV361:n itiöissä punainen signaali havaittiin vain pitkillä valotusajoilla fluoresenssimikroskoopissa (kuva 4). Koska mRFP:tä esiintyy PV361-alkioiden ympärillä (kuvat 3 ja 7), voimme päätellä, että mRFP:n fluoresenssi heikkenee, kun proteiini adsorboituu PV361-alkioihin. Tarvitaan lisäkokeita tämän seikan täydelliseksi selvittämiseksi.
Keskustelu
Tämän raportin tärkeimmät havainnot ovat, että B. megateriumin itiöt adsorboituvat heterologisen malliproteiinin mRFP:n adsorboimisessa erittäin tehokkaasti, että eksosporiumilla on tärkeä rooli tässä prosessissa ja että mRFP-molekyylit soluttautuvat eksosporiumin läpi lokalisoituen ulomman päällysteen ja eksosporiumin väliin. Nämä tulokset laajentavat aiempaa työtä, joka on tehty B. subtilis -organismin itiöillä, ja osoittavat, että myös eri lajien itiöitä voidaan käyttää heterologisten proteiinien toimittamiseen adsorptiomenetelmällä. B. megateriumin itiöillä havaittu adsorption korkea tehokkuus johtuu osittain sen itiön suuresta koosta verrattuna B. subtiliksen itiöön. B. megateriumin itiön pinta-ala onkin noin 2,5-kertainen B. subtiliksen itiöön verrattuna, sillä sen pinta-ala on 5,33 μm2 (h: 1,60 ± 0,16 w: 0,84 ± 0,07) verrattuna 1,98 μm2 (h: 1,07 ± 0,09 w: 0,48 ± 0,03). Suuret mitat mahdollistavat jopa 100 μg mRFP:n adsorption, kun 160 μg proteiinia reagoi itiöiden kanssa.
Havainto siitä, että mRFP läpäisee eksosporiumin, viittaa siihen, että se on läpäisevä 27 kDa:n proteiinille mRFP:lle. Exosporiumin läpäisevyys ei ole täysin yllättävää, koska ympäristössä olevien itiöiden on ylitettävä itiön ulkoiset kerrokset päästäkseen reseptoreihinsa, vaikkakin itiöt ovat tyypillisesti pieniä molekyylejä, joiden molekyylimassat ovat tyypillisesti <200 Da. Lisäksi mRFP-tiedot ovat pitkälti sopusoinnussa leimatuilla dekstraaneilla ja vastaavilla molekyyleillä tehtyjen aiempien tutkimusten tulosten kanssa (Koshikawa et al., 1984; Nishihara et al., 1989). Näissä tutkimuksissa B. megaterium QM B1551 -eksosporiumin ehdotettiin muodostavan läpäisevyysesteen molekyyleille, joiden molekyylipaino on yli 100 KDa, mutta vaikuttavan sellaisten molekyylien läpipääsyyn, joiden massa on jossakin 2-40 kDa:n välillä (Koshikawa et al., 1984; Nishihara et al., 1989).
Tulevaisuuden työn mielenkiintoinen haaste on selvittää mekanismi tai tunkeutumisreitti, jonka mRFP ja siten myös muut kiinnostavat heterologiset proteiinit kulkevat tunkeutuessaan päällysteiden väliseen tilaan. Leikattujen B. megaterium QM B1551 -itiöiden tutkiminen transmissioelektronimikroskopialla osoittaa, että eksosporium koostuu kahdesta identtisestä ”kuoresta” (Manetsberger et al., 2015a), ja voi olla, että näiden rakenteiden välinen rajapinta (jota varhaisissa artikkeleissa kuvailtiin ”apikaalisiksi aukoiksi”) sallii verrattain suurikokoisten molekyylien sisäänpääsyn. On myös kiinnostavaa selvittää, mihin mRFP:n fluoresenssin näennäinen häviäminen PV361:n itiöihin adsorboitumisen yhteydessä perustuu ja pystyvätkö mRFP-molekyylit tunkeutumaan ulkokuorikerroksiin, kuten havaittiin B. subtilis – itiöiden kohdalla (Donadio ym., 2016).
Tässä tutkimuksessa oletamme, että mRFP-molekyylit kulkevat mieluiten eksosporiumin läpi ja kerääntyvät ulkokuorikerrosten ja eksosporiumin väliseen välikerroksen tilaan. Tässä mallissa mRFP-molekyylit adsorboituvat ja näkyvät itiön pinnalla vasta sitten, kun adsorptiokohdat (tai tilavuuskapasiteetti?) päällysteiden välisessä tilassa on riittävästi varattu. Tämä merkitsee sitä, että adsorptiomenetelmää pintanäyttöön voidaan käyttää B. megaterium QM B1551 -itiöiden kanssa, vaikka järjestelmä on riippuvainen adsorptioreaktioissa käytetystä itiöiden ja proteiinien suhteesta. Koska B. megateriumin eri kantoja on jo pitkään käytetty teollisesti entsyymien, kuten amylaasien ja dehydrogenaasien, vitamiinien ja antimikrobisten molekyylien tuotantoon (Vary et al.,, 2007), tietomme viittaavat uuteen bioteknologiseen sovellukseen B. megateriumin itiölle välineenä heterologisten proteiinien sitomiseksi ja toimittamiseksi.
Author Contributions
ML ja GD – suorittivat suurimman osan kokeista; RA ja AS – osallistuivat työn tietojen tulkintaan; GiC, LB ja GrC – osallistuivat työn laatimiseen ja sen kriittiseen tarkistamiseen; ER – osallistui keskusteluihin ja ehdotuksiin työn aikana ja osallistui käsikirjoituksen kirjoittamiseen; RI – johti työtä ja osallistui käsikirjoituksen kirjoittamiseen. Kaikki kirjoittajat lukivat ja hyväksyivät lopullisen käsikirjoituksen.
Rahoitus
Työtä on tuettu RI:lle myönnetyllä apurahalla (STAR Linea1- 2014), jonka ovat myöntäneet Napolin Federico II -yliopisto ja Compagnia di San Paolo, Italia.
Erittely eturistiriidoista
Tekijät ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Lisäaineisto
Tämän artikkelin liiteaineisto on luettavissa verkossa osoitteessa: https://www.frontiersin.org/article/10.3389/fmicb.2016.01752/full#supplementary-material
KUVA S1 | Kuviossa 4 raportoidun fluoresenssimikroskopia-analyysin koko kentän kuvat. Samaa mikroskooppikenttää havainnoitiin vaihekontrasti- ja fluoresenssimikroskopialla. Mittakaavapalkki 5 μm. Yhdistelmäpaneeli on raportoitu. Valotusaika on merkitty.
KUVA S2 | Kuvassa 7 raportoidut immunofluoresenssianalyysin koko kentän kuvat. Samaa mikroskopointikenttää havainnoitiin vaihekontrasti- ja fluoresenssimikroskopialla. Mittakaavapalkki 5 μm. Valotusaika oli 200 ms kaikissa kuvissa.
TAULUKKO S1 | Densitometrinen analyysi dot blot -kokeista, joissa käytettiin QM B1551:n itiöiden adsorptioreaktion supernatantteja (kuva 1B).
TAULUKKO S2 | Densitometrinen analyysi dot blot -kokeista eri pesujen supernatanteilla adsorptioreaktion jälkeen (kuva 1C).
TAULUKKO S3 | Densitometrinen analyysi dot blot -kokeista kantojen PY79, QM B1551 ja PV361 itiöillä suoritetun adsorptioreaktion supernatanteilla (kuva 3B).
TAULUKKO S4 | Densitometrinen analyysi eri mRFP-määrillä suoritettujen adsorptioreaktioiden supernatanttien dot blot -kokeista.
Baccigalupi, L., Ricca, E., and Ghelardi, E. (2015). ”Non-LAB probiootit: itiönmuodostajat”, teoksessa Probiootit ja prebiootit: Current Research and Future Trends, eds K. Venema and A. P. do Carmo (Norfolk, VA: Caister Academic Press), 93-103. doi: 10.21775/9781910190098.06
CrossRef Full Text | Google Scholar
Campbell, R. E., Tour, O., Palmer, A. E., Steinbach, P. A., Baird, G. S., Zacharias, D. A., et al. (2002). Monomeerinen punainen fluoresoiva proteiini. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882. doi: 10.1073/pnas.082243699
PubMed Abstract | CrossRef Full Text | Google Scholar
Cangiano, G., Sirec, T., Panarella, C., Isticato, R., Baccigalupi, L., De Felice, M., et al. (2014). Sps -geenin tuotteet vaikuttavat Bacillus subtilis -itiöiden itävyyteen, hydrofobisuuteen ja proteiinien adsorptioon. Appl. Environ. Microbiol. 80, 7293-7302. doi: 10.1128/AEM.02893-14
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S. M. (2011). Bacillus probiootit. Food Microbiol. 28, 214-220. doi: 10.1016/j.fm.2010.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S., and Vander Horn, P. B. (1990). ”Genetic analysis,” in Molecular Biological Methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 27-74.
Google Scholar
Díaz-González, F., Milano, M., Olguin-Araneda, V., Pizarro-Cerda, J., Castro-Córdova, P., Tzeng, S. C., et al. (2015). Clostridium difficile 630:n itiöiden uloimman eksosporiumin kaltaisen kerroksen proteiinikoostumus. J. Proteom. 123, 1-13. doi: 10.1016/j.jprot.2015.03.03.035
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Luccia, B., D’Apuzzo, E., Varriale, F., Baccigalupi, L., Ricca, E., ja Pollice, A. (2016). Bacillus megaterium SF185 indusoi stressireittejä ja vaikuttaa ihmisen suoliston epiteelisolujen solusyklijakaumaan. Benef. Microb. 7, 609-620. doi: 10.3920/BM2016.0020
PubMed Abstract | CrossRef Full Text | Google Scholar
Donadio, G., Lanzilli, M., Sirec, T., Ricca, E. ja Isticato, R. (2016) Proteiinien adsorptio ja lokalisaatio Bacillus subtilis -bakteerin villiintyneen tyypin ja mutanttisten itiöiden itiöissä. Microb. Cell Fact. 15:153. doi: 10.1186/s12934-016-0551-2
PubMed Abstract | CrossRef Full Text
Eppinger, M., Bunk, B., Johns, M. A., Edirisinghe, J. N., Kutumbaka, K. K., Koenig, S. S., et al. (2011). Bioteknisesti tärkeiden Bacillus megaterium -kantojen QM B1551 ja DSM319 genomisekvenssit. J. Bacteriol. 193, 4199-4213. doi: 10.1128/JB.00449-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Giglio, R., Fani, R., Isticato, R., De Felice, M., Ricca, E. ja Baccigalupi, L. (2011). Bacillus subtiliksen cotG- ja cotH-geenien organisointi ja evoluutio. J. Bacteriol. 193, 6664-6673. doi: 10.1128/jb.06121-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Harwood, C. R., and Cutting, S. M. (1990). Molecular Biological Methods for Bacillus. Chichester: John Wiley and Sons.
Google Scholar
Huang, J. M., Hong, H. A., Van Tong, H., Hoang, T. H., Brisson, A., and Cutting, S. M. (2010). Antigeenien antaminen limakalvoille käyttämällä adsorptiota bakteerien itiöihin. Vaccine 28, 1021-1030. doi: 10.1016/j.vaccine.2009.10.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., De Felice, M. ja Ricca, E. (2010). CotE sitoutuu CotC:hen ja CotU:hun ja välittää niiden vuorovaikutusta itiökuoren muodostumisen aikana Bacillus subtiliksessa. J. Bacteriol. 192, 949-954. doi: 10.1128/JB.01408-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., Zilhão, R., Baccigalupi, L., Henriques, A. O., De Felice, M., et al. (2008). CotC-CotU-heterodimerisaatio Bacillus subtiliksen itiökuoren kokoamisen aikana. J. Bacteriol. 190, 1267-1275. doi: 10.1128/JB.01425-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., ja Ricca, E. (2014). Itiöiden pintanäyttö. Microbiol. Spectr. 2, 351-366. doi: 10.1128/microbiolspec.TBS-0011-2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Sirec, T., Treppiccione, L., Maurano, F., De Felice, M., Rossi, M., et al. (2013). Escherichia coli -bakteerin lämpöherkän toksiinin B-alayksikön ei-rekombinanttinen esiintyminen Bacillus subtilis -bakteerin villityyppisissä ja mutantti-itiöissä. Microb. Cell Fact. 12:98. doi: 10.1186/1475-2859-12-98
PubMed Abstract | CrossRef Full Text | Google Scholar
Knecht, L. D., Pasini, P., and Daunert, S. (2011). Bakteerien itiöt bioanalyyttisten ja biolääketieteellisten sovellusten alustoina. Anal. Bioanal. Chem. 400, 977-989. doi: 10.1007/s00216-011-4835-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Koshikawa, T., Beaman, T. C., Pankratz, H. S., Nakashio, S., Corner, T. R., and Gerhardt, P. (1984). Bacillus megateriumin itiöiden vastustuskyky, itävyys ja läpäisevyyskorrelaatit, kun itiöistä poistetaan peräkkäin kuorikerrokset. J. Bacteriol. 159, 624-632.
PubMed Abstract | Google Scholar
Manetsberger, J., Hall, E. A. H., and Christie, G. (2015a). Plasmidikoodatut geenit vaikuttavat eksosporiumin kokoonpanoon ja morfologiaan Bacillus megaterium QM B1551 -itiöissä. FEMS Microbiol. Lett. 362:fnv147. doi: 10.1093/femsle/fnv147
PubMed Abstract | CrossRef Full Text | Google Scholar
Manetsberger, J., Manton, J. D., Erdelyi, M. J., Lin, H., Rees, D., Christie, G., ym. et al. (2015b). Ellipsoidinen lokalisaatiomikroskopia päättelee proteiinikerrosten koon ja järjestyksen Bacilluksen itiökuorissa. Biophys. J. 109, 2058-2066. doi: 10.1016/j.bpj.2015.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
McCloy, R., Rogers, S., Caldon, E., Lorca, T., Castro, A. ja Burgess, A. (2014). Cdk1:n osittainen estäminen G2-vaiheessa kumoaa SAC:n ja irrottaa mitoottiset tapahtumat. Cell Cycle 13, 1400-1412. doi: 10.4161/cc.28401
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenney, P. T., Driks, A., and Eichemberger, P. (2012). Bacillus subtilis -endospori: monikerroksisen vaipan kokoaminen ja toiminnot. Nat. Rev. Microbiol. 11, 33-44. doi: 10.1038/nrmicro2921
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicholson, W. L., and Setlow, P. (1990). ”Sporulation, germination and out-growth,” in Molecular biological methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 391-450.
Google Scholar
Nishihara, T., Takubo, Y., Kawamata, E., Koshikawa, T., Ogaki, J. ja Kondo, M. (1989). Ulkokuoren rooli Bacillus megateriumin itiön vastustuskyvyssä. J. Biochem. 106, 270-273.
PubMed Abstract | Google Scholar
Pesce, G., Rusciano, G., Sirec, T., Isticato, R., Sasso, A. ja Ricca, E. (2014). Bacillus subtilis -itiön pintavarauksen ja hydrodynaamisen kertoimen mittaukset optisilla pinseteillä. Colloids Surf. B Biointerfaces 116C, 568-575. doi: 10.1016/j.colsurfb.2014.01.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M. ja Isticato, R. (2014). Limakalvo-rokotteen toimittaminen Bacillus subtilis -bakteerin ei-rekombinanttisten itiöiden avulla. Microb. Cell Fact. 13, 115. doi: 10.1186/s12934-014-0115-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosso, M. L., and Vary, P. S. (2005). Bacillus megaterium QM B1551 -plasmidien jakautuminen muiden B. megaterium -kantojen ja Bacilluslajien kesken. Plasmid 53, 205-217. doi: 10.1016/j.plasmid.2004.10.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rusciano, G. Zito, G., Isticato, R., Sirec, T., Ricca, E., Bailo, E., and Sasso, A. (2014). Bacillus subtilis -itiöiden kemiallinen kuvantaminen nanokokoluokassa yhdistämällä kärkivahvistettu Raman-sironta ja kehittyneet tilastolliset työkalut. ACS Nano 8, 12300-12309. doi: 10.1021/nn504595k
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirec, T., Strazzulli, A., Isticato, R., De Felice, M., Moracci, M. ja Ricca, E. (2012). Alicyclobacillus acidocaldariuksen beeta-galaktosidaasin adsorptio Bacillus subtiliksen villityypin ja mutanttien itiöihin. Microb. Cell Fact. 11:100. doi: 10.1186/1475-2859-11-100
PubMed Abstract | CrossRef Full Text | Google Scholar
Stewart, G. C. (2015). Bakteerien itiöiden eksosporium-kerros: yhteys ympäristöön ja infektoituneeseen isäntään. Microbiol. Mol. Biol. Rev. 79, 437-457. doi: 10.1128/MMBR.00050-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Vary, P. S., Biedendieck, R., Fuerch, T., Meinhardt, F., Rohde, M., Deckwer, W. -D., et al. (2007). Bacillus megaterium – yksinkertaisesta maaperäbakteerista teolliseksi proteiinituotannon isännäksi. Appl. Microbiol. Biotechnol. 76, 957-967 doi: 10.1007/s00253-007-1089-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Youngman, P., Perkins, J. B., and Losick, R. (1984). Uusi menetelmä Bacillus subtilis -kromosomaalisen DNA:n nopeaan kloonaamiseen Escherichia coli:ssa Tn917-insertion vieressä. Mol. Gen. Genet. 195, 424-433. doi: 10.1007/BF00341443
CrossRef Full Text | Google Scholar
.