Introduction
Les bactéries gram-positives des genres Bacillus et Clostridium peuvent se différencier pour former un endospore (spore), une cellule métaboliquement quiescente produite en réponse à des conditions qui ne permettent pas la croissance cellulaire (McKenney et al., 2012). Une fois libérée dans l’environnement, la spore survit dans son état dormant pendant des périodes extrêmement longues, résistant à une vaste gamme de stress tels que des températures élevées, la déshydratation, l’absence de nutriments et la présence de produits chimiques toxiques (McKenney et al., 2012). Cependant, la spore quiescente est capable de surveiller en permanence l’environnement et de répondre à la présence d’eau et de nutriments en germant et en donnant naissance à une cellule végétative capable de croître et de sporuler (McKenney et al., 2012). La résistance aux conditions non-physiologiques est, en partie, due aux structures de surface des spores. Chez Bacillus subtilis, le système modèle pour les formateurs de spores, la surface des spores est organisée en un manteau multicouche et en une croûte, une couche récemment découverte qui entoure le manteau des spores (McKenney et al., 2012). Les spores de B. subtilis sont chargées négativement (Huang et al., 2010 ; Pesce et al., 2014) et ont une hydrophobie relative qui est en partie due à la glycosylation de certaines protéines de surface des spores (Cangiano et al., 2014 ; Rusciano et al., 2014). Chez plusieurs espèces de Bacillus et Clostridium, dont B. cereus, B. anthracis, B. megaterium et C. difficile, la structure la plus externe de la spore est l’exosporium, une couche morphologiquement distincte composée de protéines et de glycoprotéines qui entoure le manteau (Díaz-González et al., 2015 ; Manetsberger et al, 2015b ; Stewart, 2015).
La spore bactérienne a été proposée comme une plateforme pour présenter des protéines hétérologues, avec des applications potentielles allant du développement de vaccins muqueux à des biocatalyseurs réutilisables, des outils de diagnostic et des dispositifs de biorémédiation (Knecht et al., 2011 ; Isticato et Ricca, 2014 ; Ricca et al., 2014). La résistance remarquable et bien documentée de la spore (McKenney et al., 2012), la facilité de plusieurs espèces sporulées à être manipulées génétiquement (Harwood et Cutting, 1990) et l’innocuité de plusieurs espèces (Cutting, 2011 ; Baccigalupi et al., 2015) soutiennent l’utilisation de la spore comme système de présentation et de livraison. Deux stratégies ont été développées pour afficher des protéines hétérologues à la surface des spores. Une stratégie recombinante, basée sur la construction de fusions génétiques entre l’ADN codant pour une protéine de surface de spore sélectionnée et l’ADN codant pour la protéine à afficher, a été utilisée au fil des ans pour afficher une variété de protéines hétérologues (Isticato et Ricca, 2014). Une approche non recombinante, basée sur l’adsorption spontanée entre les spores purifiées et les protéines purifiées, a également été utilisée pour présenter diverses enzymes et antigènes (Ricca et al., 2014). Les détails moléculaires contrôlant l’adsorption des spores n’ont pas été entièrement élucidés. On sait que l’adsorption est plus efficace lorsque le pH du tampon de liaison est acide (pH 4) (Huang et al., 2010 ; Sirec et al., 2012) et qu’une combinaison d’interactions électrostatiques et hydrophobes est probablement impliquée dans l’interaction (Huang et al., 2010 ; Sirec et al., 2012). On sait également que les spores mutantes dont la surface des spores est gravement altérée interagissent plus efficacement que les spores sauvages isogéniques avec des protéines modèles (Sirec et al., 2012 ; Donadio et al, 2016).
Nous avons ici utilisé une protéine fluorescente, la forme monomérique de la protéine fluorescente rouge (mRFP) du corail Discosoma sp. (Campbell et al., 2002), pour évaluer si les spores de B. megaterium sont capables d’interagir avec et d’adsorber une protéine hétérologue modèle. B. megaterium comprend un certain nombre de souches morphologiquement distinctes partageant les grandes dimensions inhabituelles des cellules (longueur jusqu’à 4 μm et diamètre de 1,5 μm) et des spores (longueur jusqu’à 3 μm et diamètre de 1 μm) (Di Luccia et al., 2016). Les spores de certaines souches de B. megaterium sont entourées d’un exosporium, et comme jusqu’à présent seules les spores des espèces dépourvues d’exosporium ont été considérées comme des plateformes d’adsorption, aucune donnée n’est disponible sur l’impact de l’exosporium dans l’interaction avec les protéines hétérologues.
La souche QM B1551 est la souche la mieux caractérisée de B. megaterium. Cette souche porte environ 11 % de son génome sur sept plasmides indigènes (Rosso et Vary, 2005 ; Vary et al., 2007 ; Eppinger et al., 2011), dont deux – pBM500 et pBM600 – ont été identifiés comme portant des gènes essentiels à la formation de l’exosporium » en forme de noix » caractéristique de cette souche (Manetsberger et al., 2015a). La composition protéique de l’exosporium de QM B1551 est encore mal caractérisée, seuls quelques gènes codant pour des orthologues de protéines d’exosporium reconnues dans les spores d’autres espèces ayant été identifiés par des analyses génomiques. Il s’agit notamment des gènes codant pour les protéines BclA nap, qui forment un nap localisé dans les spores de B. megaterium QM B1551, ainsi qu’un orthologue de la protéine BxpB qui forme la couche basale de l’exosporium dans les spores de la famille B. cereus. Cette dernière semble remplir un rôle différent dans les spores de B. megaterium QM B1551, puisqu’une souche mutante nulle a conservé un exosporium apparemment normal (Manetsberger et al…, 2015a).
Dans cet article, nous présentons des données qui démontrent que les spores de B. megaterium QM B1551 peuvent adsorber efficacement la mRFP, et fournissent des preuves que les molécules de protéines sont capables de traverser la barrière de perméabilité présentée par l’exosporium pour se localiser dans l’espace inter-couche.
Matériaux et méthodes
Souches bactériennes, spore, et production de RFP
Les souches de B. megaterium employées dans cette étude sont QM B1551 et son dérivé sans plasmide PV361 (Rosso et Vary, 2005). La souche de B. subtilis utilisée dans cette étude est PY79 (Youngman et al., 1984). La sporulation de toutes les souches de Bacillus a été induite par la méthode d’épuisement (Cutting et Vander Horn, 1990). Après 30 h de croissance dans le milieu Difco Sporulation (DS) à 37°C avec une agitation vigoureuse, les spores ont été collectées et purifiées comme décrit par Nicholson et Setlow (1990) en utilisant une incubation d’une nuit dans H2O à 4°C pour lyser les cellules sporangiales résiduelles. Le nombre de spores purifiées obtenues a été mesuré par comptage direct avec une chambre de Bürker sous un microscope optique (Olympus BH-2 avec un objectif 40×).
Pour la production de mRFP, des cellules de la souche RH161 d’Escherichia coli (Donadio et al…, 2016), portant le vecteur d’expression pRSET-A portant une fusion in-frame de l’extrémité 5′ de la région codante de la rfp à six codons histidine sous le contrôle transcriptionnel d’un promoteur T7, ont été cultivées pendant 18 h à 37°C dans 100 ml de milieu d’autoinduction pour exprimer la protéine hétérologue (Isticato et al., 2010). La protéine RFP étiquetée His6 a été purifiée dans des conditions natives en utilisant une colonne His-Trap selon les recommandations du fabricant (GE Healthcare Life Science). La protéine purifiée a été dessalée à l’aide d’une colonne PD10 (GE Healthcare Life Science) pour éliminer les concentrations élevées de NaCl et d’imidazole.
Réaction d’adsorption
Sans indication contraire, 5 μg de mRFP recombinante purifiée ont été ajoutés à une suspension de spores (5 × 108) dans du citrate de sodium 50 mM pH 4,0 à 25°C dans un volume final de 200 μl. Après 1 h d’incubation, le mélange de liaison a été centrifugé (10 min à 13 000 g) pour fractionner les spores liées à la mRFP dans le culot de la mRFP libre dans le surnageant.
Analyse Western et Dot-Blot
Les culots de spores provenant des réactions d’adsorption ont été remis en suspension dans 40 μl de tampon d’extraction de manteau de spore (Nicholson et Setlow, 1990 ; Giglio et al, 2011), incubés à 68 °C pendant 1 h pour solubiliser les protéines du manteau des spores et chargés sur un gel de SDS-PAGE à 12 %. Les protéines ont ensuite été électrotransférées sur des filtres en nitrocellulose (Amersham Pharmacia Biotech) et utilisées pour une analyse Western blot comme indiqué précédemment (Isticato et al., 2008) en utilisant un anticorps monoclonal anti-His reconnaissant la mRFP (Sigma). Une détermination quantitative de la quantité de mRFP a été obtenue par des expériences de dot blot comparant des dilutions sérielles de mRFP purifiée et de surnageant d’essai de liaison. Les filtres ont ensuite été visualisés par la méthode ECL-prime (Amersham Pharmacia Biotech) et soumis à une analyse densitométrique par le logiciel d’analyse 1-D Quantity One (Bio-Rad). Le dot blot et les analyses densitométriques relatives ont été réalisés trois fois pour vérifier la signification des résultats.
Microscopie par fluorescence et immunofluorescence
Les spores post-adsorption ont été remises en suspension dans 50 μl de 1x PBS pH 4,0 et 5 μl de la suspension placés sur des lames de microscope et recouverts d’une lamelle couvre-objet préalablement traitée pendant 30 s avec de la poly-L-lysine (Sigma). L’immunofluorescence a été réalisée comme décrit par Isticato et al. (2013), avec les modifications suivantes : 2,0 × 106 spores adsorbées par RFP des souches de B. megaterium QM B1551 et PV361 ont été prétraitées avec 1% d’albumine de sérum bovin (BSA) – 1x PBS pH 4,0 pendant 30 min avant une incubation de 2 h à 4°C avec les anticorps anti-polyHistidine (souris ; Sigma) dilués 1:20 dans 1x PBS pH 4,0-1% BSA. Comme contrôle de la spécificité de cette technique, les spores non adsorbées ont été directement traitées avec des anticorps anti-His. Après trois lavages, les échantillons ont été incubés avec un anticorps secondaire anti-souris dilué 64 fois et conjugué avec de l’isothiocyanate de fluorescéine, FITC (Santa Cruz Biotechnology, Inc.) et lavés quatre fois avec 1x PBS pH 4.0. Les échantillons lavés ont été remis en suspension dans 20 μl de 1x PBS pH 4,0 et 10 μl ont été analysés. Tous les échantillons ont été observés avec un microscope à fluorescence Olympus BX51 équipé d’un objectif à huile 100× UPlan F1 ; des filtres cubiques U-MNG ou U-MWIBBP ont été utilisés pour détecter l’émission de fluorescence rouge de la mRFP ou l’émission verte des anticorps conjugués au FITC, respectivement. Les temps d’exposition étaient compris entre 200 et 3000 ms. Les images ont été capturées à l’aide d’un appareil photo numérique Olympus DP70 et traitées avec le logiciel d’analyse d’images (Olympus) pour des ajustements mineurs de la luminosité, du contraste et de la balance des couleurs (McCloy et al., 2014). ImageJ (v1.48, NIH) a été utilisé pour dessiner un contour autour de 80 spores pour chaque souche et les valeurs de fluorescence minimale, maximale et moyenne par pixel ont été enregistrées pour chaque spore. Les valeurs d’intensité de fluorescence ont été affichées par la suite sous forme de diagrammes en boîte avec des intervalles de confiance de 5 à 95 % (McCloy et al., 2014).
Analyse statistique
Les résultats des analyses par dot blot et microscopie à fluorescence sont les moyennes de trois expériences indépendantes. La signification statistique a été déterminée par le test t de Student, et le niveau de signification a été fixé à P < 0,05.
Résultats
la mRFP de Discosoma sp. est adsorbée par les spores de B. megaterium Spores
Pour vérifier si les spores de B. megaterium QM B1551 étaient capables d’adsorber la mRFP, 5 μg de la protéine purifiée (Matériaux et méthodes) ont été incubés avec 5,0 × 108 spores purifiées. La réaction d’adsorption a été réalisée dans du citrate de sodium 50 mM à pH 4,0, comme décrit précédemment (Sirec et al., 2012). Après la réaction, les spores ont été lavées abondamment avec 1x PBS pH 4,0, les protéines de surface des spores ont été extraites comme décrit dans Matériaux et Méthodes et analysées par western blotting avec un anticorps anti-polyHistidine-Peroxydase (Sigma), qui reconnaît l’extrémité N-terminale étiquetée histidine de la mRFP. Comme le montre la figure 1A, la mRFP a été extraite des spores, ce qui indique qu’elle a été absorbée pendant la réaction puis libérée par le traitement d’extraction. Pour évaluer l’efficacité de l’adsorption, nous avons analysé la quantité de mRFP non liée, c’est-à-dire que les spores post-adsorbées ont été collectées par centrifugation et le surnageant dilué en série et analysé par dot blotting (Figure 1B). Une analyse densitométrique du dot blot (tableau supplémentaire 1) a montré que lorsque 5 μg de mRFP ont été utilisés dans la réaction d’adsorption, moins de 1 % est resté non lié, ce qui indique qu’environ 99 % de la protéine hétérologue a été adsorbée sur les spores de B. megaterium.

FIGURE 1. Les spores de Bacillus megaterium QM B1551 adsorbent la mRFP. 5 × 108 spores ont été incubées avec 5 μg de mRFP purifiée, puis les échantillons soumis à une centrifugation. (A) Les protéines de surface des spores ont été extraites de la fraction du culot par traitement au SDS-DTT, fractionnées sur SDS-PAGE et analysées par Western blot. La mRFP purifiée (20 μg) a été utilisée comme marqueur. (B) Le surnageant, contenant la mRFP non liée, a été dilué en série et analysé par dot blot (QM B1551). Des dilutions en série de la mRFP purifiée (mRFP) ont été utilisées comme standard. (C) Les spores adsorbées avec la mRFP ont été lavées deux fois (W1 et W2) avec un tampon PBS à pH 3,0 ou pH 7,0, ou avec une solution de NaCl 1M, 0,1% Triton X-100. Des dilutions en série de mRFP purifiée et de mRFP non liée (UN-mRFP) ont été utilisées comme standards. Les immuno-réactions dans tous les panneaux ont été réalisées avec un anticorps anti-His reconnaissant la mRFP conjugué à la peroxydase de raifort.
Pour analyser si les molécules mRFP adsorbées étaient étroitement liées à la surface des spores, les spores de la réaction post-adsorption ont été lavées deux fois avec un tampon PBS à pH 3,0 ou pH 7,0, ou avec une solution de NaCl 1M, 0,1% de Triton X-100, comme décrit précédemment (Donadio et al., 2016). Comme le montre la figure 1C, et comme le confirme l’analyse densitométrique du dot blot (tableau supplémentaire 2), les lavages à pH 3,0 n’ont entraîné aucune libération de la mRFP adsorbée, tandis que les lavages à pH 7,0 ou avec une solution de NaCl 1M, 0,1 % de Triton X-100 ont provoqué une libération minime, inférieure à 1 %, des molécules mRFP. Par conséquent, les résultats présentés dans la figure 1 suggèrent que la mRFP a été efficacement adsorbée et étroitement liée aux spores de B. megaterium. Pour évaluer si les molécules mRFP adsorbées sur les spores conservaient leurs propriétés fluorescentes, nous avons effectué une analyse par microscopie à fluorescence. Comme le montre la figure 2, les spores de réaction post-adsorption étaient associées à un fort signal de fluorescence visible autour de toute la surface des spores.
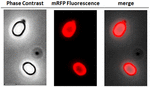
FIGURE 2. Analyse par microscopie à fluorescence de spores de B. megaterium QM B1551-mRFP. Les spores QM B1551 incubées avec la mRFP (5 μg), puis lavées, ont été analysées par microscopie à fluorescence. Le même champ de microscopie a été observé par contraste de phase et par microscopie à fluorescence. Barre d’échelle de 1 μm. Le panneau de fusion est rapporté. Le temps d’exposition était de 200 ms.
L’exosporium a un rôle essentiel dans l’adsorption de la mRFP
La souche QM B1551 de B. megaterium contient sept plasmides indigènes (Rosso et Vary, 2005 ; Eppinger et al., 2011) et les gènes codés par les plasmides sont essentiels à la formation de l’exosporium (Manetsberger et al., 2015a). La souche PV361 est une souche guérie par QM B1551 dépourvue des sept plasmides et, par conséquent, totalement dépourvue d’exosporium (Manetsberger et al., 2015a). Nous avons utilisé des spores de la souche PV361 pour analyser le rôle de l’exosporium dans l’adsorption de la mRFP. En parallèle, nous avons également utilisé des spores de B. subtilis PY79 qui, dans une étude précédente, se sont avérées adsorber la mRFP (Donadio et al., 2016). Pour comparer l’efficacité d’adsorption des spores des souches B. subtilis PY79 et B. megaterium QM B1551 et PV361, nous avons adsorbé 5 μg de mRFP purifiée avec 5,0 × 108 spores de chacune des trois souches. Après les réactions d’adsorption, les spores ont été collectées par centrifugation, les protéines extraites par traitement SDS-DTT et analysées par western blotting avec un anticorps anti-His reconnaissant la mRFP. Comme le montre la figure 3A, la mRFP a apparemment été extraite en plus grande quantité des spores de QM B1551 que des spores des deux autres souches. Pour tenter de quantifier ces différences apparentes, la mRFP non liée provenant des réactions d’adsorption a été diluée en série et analysée par dot blotting (Figure 3B). Une analyse densitométrique du dot blot de la figure 3B (tableau supplémentaire 3) a indiqué que les spores PY79 et PV361 ont adsorbé environ 90 % de la mRFP totale tandis que les spores QM B1551 ont adsorbé presque toute (plus de 99 %) la mRFP purifiée.
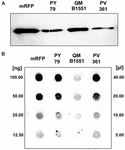
FIGURE 3. Adsorption de la protéine fluorescente rouge monomère sur les spores de B. megaterium QM B1551 et PV361 et de B. subtilis PY79. 5 × 108 spores de chaque souche ont été incubées avec 5 μg de mRFP purifiée, puis les échantillons soumis à une centrifugation. Les spores des fractions de culots ont été utilisées pour extraire les protéines de surface qui ont ensuite été analysées par western blot (A), tandis que les surnageants ont été dilués en série et analysés par dot blot (B). Des dilutions en série de mRFP purifiée ont été utilisées comme standards. Les immuno-réactions dans les deux panneaux ont été réalisées avec un anticorps anti-His conjugué à la peroxydase de raifort.
L’efficacité d’adsorption des spores des trois souches a également été analysée par microscopie à fluorescence (figure 4A et figure supplémentaire S1). Les images de microscopie ont été analysées par le logiciel ImageJ (v1.48, NIH) pour effectuer une analyse quantitative des images de fluorescence et la fluorescence des spores a été calculée comme décrit dans Matériaux et méthodes. L’analyse de 80 spores de chaque souche a indiqué une valeur moyenne de fluorescence par pixel de 52,43 (± 5,94), 20,81 (± 2,71), et 32,33 (± 2.97 ; unités arbitraires) pour QM B1551, PV361, et PY79, respectivement (Figure 4B), conférant une preuve supplémentaire que les spores de QM B1551 ont adsorbé plus de mRFP que les spores des deux autres souches.
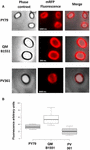
FIGURE 4. Efficacité de l’adsorption de la mRFP sur les spores de B. megaterium QM B1551 et PV361 et de B. subtilis PY79. (A) Images par microscopie à fluorescence des spores de PY79, QM B1551 et PV361 après adsorption de la mRFP et lavage. Les temps d’exposition sont indiqués. Des superpositions de contraste de phase et de fluorescence rouge sont présentées (panneau de fusion). Barres d’échelle de 1 μm. (B) Box plots affichant l’intensité de fluorescence de quatre-vingts spores différentes de chaque souche. Les limites de chaque boîte représentent le premier et le troisième quartile (25 et 75 %) et les valeurs à l’extérieur des boîtes représentent les valeurs maximales et minimales. La ligne qui divise la boîte indique la valeur médiane pour chaque souche. La valeur P est inférieure à 0,0001.
Sur la base des résultats des figures 3 et 4, nous concluons que l’exosporium, présent chez QM B1551 et absent chez PV361 a un rôle pertinent dans l’adsorption de la mRFP.
En outre, les résultats de la figure 4 indiquent que les spores de B. subtilis PY79 sont plus efficaces que les spores de B. megaterium PV361 pour adsorber la mRFP, alors que le dot blotting rapporté dans la figure 3B indique des efficacités d’adsorption similaires pour les deux souches. Nous pensons que cette divergence est due à une forte réduction de la fluorescence lorsque la mRFP est liée aux spores PV361 mais pas aux spores PY79 ou QM B1551 (voir ci-dessous).
Évaluation quantitative de l’adsorption de la mRFP aux spores de QM B1551
Les expériences de transfert de points (figure 3B) ont indiqué que lorsque 5 μg de mRFP purifiée étaient utilisés dans des réactions d’adsorption avec 5,0 × 108 spores de la souche QM B1551, presque toute la protéine hétérologue était liée à la spore. Afin de définir la quantité maximale de mRFP pouvant être adsorbée aux spores de QM B1551, nous avons répété les réactions avec des concentrations croissantes de mRFP purifiée, c’est-à-dire que 5,0 × 108 spores de QM B1551 ont été mises en réaction avec 5, 10, 20, 40, 80 et 160 μg de mRFP purifiée. Après les réactions, les spores ont été recueillies par centrifugation et les surnageants contenant la mRFP non liée ont été dilués en série et analysés par dot blotting (Figure 5A). La figure 5B présente les résultats d’une analyse densitométrique du dot blot ( ??), qui indique que lorsque 5-80 μg de mRFP ont réagi avec 5 × 108 spores, le pourcentage de protéine liée aux spores était supérieur à 90 %. Une diminution de la mRFP liée a été observée lorsque 160 μg de protéine purifiée ont été utilisés dans la réaction. Cependant, même lorsque 160 μg de mRFP purifiée ont été utilisés, plus de 60 % de la protéine a été absorbée, ce qui indique que 5,0 × 108 spores de QM B1551 peuvent adsorber environ 100 μg de mRFP.
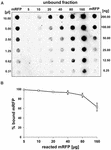
FIGURE 5. Évaluation quantitative de l’adsorption de la mRFP sur les spores de B. megaterium QM B1551. 5 × 108 spores ont été incubées avec 5, 10, 20, 40, 80 et 160 μg de mRFP purifiée. Les mélanges réactionnels ont ensuite été soumis à une centrifugation et les surnageants dilués en série et analysés par dot blot (A). Des dilutions en série de mRFP purifiée ont été utilisées comme standards. Les immuno-réactions dans les deux panneaux ont été réalisées avec un anticorps anti-His conjugué à de la peroxydase de raifort. (B) Pourcentage de mRFP adsorbé sur les spores après réaction avec des quantités définies de mRFP endogène. Les barres d’erreur indiquent les erreurs standard de la moyenne de trois expériences et la valeur P jamais supérieure à 0,0025.
mRFP se localise à l’espace inter-couche dans les spores de B. megaterium QM B1551
Une approche de microscopie à immuno-fluorescence a été employée pour évaluer si les molécules mRFP adsorbées étaient exposées à la surface des spores de B. megaterium QM B1551. Les spores QM B1551 adsorbées avec différentes quantités de mRFP ont été mises en réaction avec un anticorps monoclonal anti-His reconnaissant la mRFP recombinante, puis avec un anticorps secondaire fluorescent anti-souris (Santa Cruz Biotechnology, Inc.) et observées au microscope à fluorescence (Figure 6). Avec la plus faible quantité de mRFP utilisée dans cette expérience (2 μg), le signal de fluorescence mRFP (rouge) a été observé tout autour de la spore alors que le signal d’immunofluorescence (vert) était faible et principalement concentré aux pôles de la spore, ce qui suggère que seulement à ces endroits la mRFP était exposée à la surface de la spore. En augmentant la quantité de mRFP utilisée dans la réaction, le nombre de points verts a augmenté (5 et 10 μg) et avec la plus grande quantité de mRFP utilisée dans la réaction (20 μg), un anneau vert presque complet a été observé autour des spores. Sur la base des résultats présentés dans la Figure 6, nous avons émis l’hypothèse que les molécules mRFP s’infiltrent à travers l’exosporium et se localisent dans l’espace inter-couche entre la couche externe et l’exosporium, c’est-à-dire que lorsqu’une faible quantité de mRFP est utilisée, presque toutes les molécules de protéines sont internes à l’exosporium et ne sont disponibles pour l’anticorps qu’à quelques endroits. L’augmentation des quantités de mRFP dans les réactions d’adsorption entraîne le « remplissage » de l’espace entre les couches, jusqu’à ce qu’en fin de compte, davantage de molécules de mRFP soient disponibles pour l’anticorps à la surface de la spore. Cette hypothèse implique que si l’exosporium est absent, toute la mRFP devrait être disponible pour l’anticorps. Pour tester cela, nous avons comparé par microscopie à immunofluorescence des nombres égaux de spores de QM B1551 (avec exosporium) et de PV361 (sans exosporium) incubées avec la même quantité de mRFP (5 μg). Lorsque l’exosporium était présent (QM B1551), la mRFP n’était que partiellement disponible pour l’anticorps et des taches vertes ont été observées (figure 7 et figure supplémentaire S2). Lorsque l’exosporium n’était pas présent (PV361) la mRFP adsorbée était disponible pour l’anticorps tout autour de la spore et un anneau vert complet était formé, soutenant l’hypothèse que la mRFP est interne à l’exosporium dans les spores QM B1551.
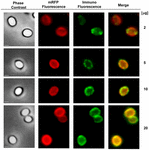
FIGURE 6. Analyse par immunofluorescence des spores B. megaterium QM B1551 adsorbées par la mRFP. Des aliquotes de 5 × 108 spores QM B1551 ont été incubées avec des concentrations variables de mRFP et ont ensuite été analysées par microscopie à contraste de phase, fluorescence et immunofluorescence, comme décrit dans les Matériels et Méthodes. Le même champ de microscopie pour chaque réaction est rapporté avec le panneau de fusion. Le temps d’exposition était de 200 ms pour toutes les images. Barre d’échelle, 1 μm.
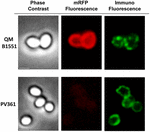
FIGURE 7. Immunofluorescence de la mRFP adsorbée sur les spores de B. megaterium QM B1551 et PV361. 5 × 108 spores QM B1551 et PV361 ont été incubées avec 5 μg de mRFP, puis analysées par microscopie à immunofluorescence, comme décrit dans les matériaux et méthodes. Pour chaque champ, le contraste de phase et la microscopie d’immunofluorescence sont présentés. Le temps d’exposition était de 200 ms pour toutes les images. Barre d’échelle, 1 μm.
Alors que les spores QM B1551 utilisées dans les expériences de la figure 7 ont montré un anneau fluorescent rouge complet comme dans la figure 2, les spores PV361 ont montré un signal fluorescent rouge très faible. Avec les spores PV361, un signal rouge n’a été observé qu’en utilisant de longs temps d’exposition au microscope à fluorescence (Figure 4). Puisque la mRFP est présente autour des spores PV361 (Figures 3 et 7), nous concluons que la fluorescence de la mRFP est affaiblie lorsque la protéine est adsorbée aux spores PV361. D’autres expériences seront nécessaires pour répondre pleinement à ce point.
Discussion
Les principales conclusions de ce rapport sont que les spores de B. megaterium sont extrêmement efficaces pour adsorber la protéine modèle hétérologue mRFP, que l’exosporium a un rôle important dans ce processus, et que les molécules mRFP s’infiltrent à travers l’exosporium en se localisant entre le manteau externe et l’exosporium. Ces résultats élargissent les travaux précédents réalisés sur les spores de B. subtilis et démontrent que les spores d’une espèce différente peuvent également être utilisées pour délivrer des protéines hétérologues par la méthode d’adsorption. La grande efficacité de l’adsorption observée avec les spores de B. megaterium est en partie due à la grande taille de sa spore par rapport à celle de B. subtilis. En effet, la surface de la spore de B. megaterium est environ 2,5 fois plus grande que celle de la spore de B. subtilis, avec une surface de 5,33 μm2 (h : 1,60 ± 0,16 l : 0,84 ± 0,07) contre 1,98 μm2 (h : 1,07 ± 0,09 l : 0,48 ± 0,03). Ces grandes dimensions permettent d’adsorber jusqu’à 100 μg de mRFP lorsque 160 μg de protéines sont mis en réaction avec les spores.
L’observation que la mRFP traverse l’exosporium indique que celui-ci est perméable à la mRFP, une protéine de 27 kDa. La perméabilité de l’exosporium n’est pas totalement surprenante puisque les germinants présents dans l’environnement doivent traverser les couches externes de la spore pour atteindre leurs récepteurs, bien que les germinants soient généralement de petites molécules avec des masses moléculaires typiquement <200 Da. De plus, les données de la mRFP sont largement en accord avec les résultats d’études précédentes menées avec des dextrans marqués et des molécules apparentées (Koshikawa et al., 1984 ; Nishihara et al., 1989). Dans ces études, il a été suggéré que l’exosporium de B. megaterium QM B1551 représentait une barrière de perméabilité aux molécules dont la masse moléculaire est supérieure à 100 KDa, tout en influençant le passage de molécules dont la masse se situe entre 2 et 40 kDa (Koshikawa et al, 1984 ; Nishihara et al., 1989).
Un défi intéressant pour les travaux futurs sera d’établir le mécanisme ou la voie d’infiltration que la mRFP, et par déduction d’autres protéines hétérologues d’intérêt, emprunte pour entrer dans l’espace inter-couches. L’examen par microscopie électronique à transmission de spores B. megaterium QM B1551 sectionnées indique que l’exosporium comprend deux « coquilles » identiques (Manetsberger et al., 2015a), et il se peut que l’interface entre chacune de ces structures (décrites comme des « ouvertures apicales » dans les premiers articles) permette l’entrée de molécules relativement grandes. Discerner la base de la perte apparente de la fluorescence mRFP lors de l’adsorption sur les spores PV361, et savoir si les molécules mRFP sont capables de s’infiltrer dans les couches du manteau externe, comme cela a été observé pour les spores de B. subtilis (Donadio et al., 2016), sera également intéressant.
Dans l’étude actuelle, nous émettons l’hypothèse que les molécules mRFP traversent préférentiellement l’exosporium et s’accumulent dans l’espace inter-couche entre le manteau externe et l’exosporium. Dans ce modèle, les molécules mRFP ne sont adsorbées et affichées sur la surface des spores que lorsque les sites d’adsorption (ou la capacité volumétrique ?) dans l’espace inter-couche sont suffisamment occupés. Cela implique que l’approche de l’adsorption pour l’affichage de surface peut être utilisée avec les spores de B. megaterium QM B1551, bien que le système dépende du rapport spore/protéine utilisé dans les réactions d’adsorption. Puisque diverses souches de B. megaterium sont depuis longtemps utilisées industriellement pour la production d’enzymes telles que les amylases et les déshydrogénases, de vitamines et de molécules antimicrobiennes (Vary et al., 2007), nos données suggèrent une nouvelle application biotechnologique pour la spore de B. megaterium comme véhicule pour lier et délivrer des protéines hétérologues.
Contributions des auteurs
ML et GD – ont réalisé la plupart des expériences ; RA et AS – ont contribué à l’interprétation des données pour le travail ; GiC, LB, et GrC – ont contribué à la rédaction du travail et à sa révision critique ; ER – a contribué aux discussions et suggestions au cours du travail et a contribué à la rédaction du manuscrit ; RI – a dirigé le travail et a contribué à la rédaction du manuscrit. Tous les auteurs ont lu et approuvé le manuscrit final.
Funding
Ce travail a été soutenu par une subvention (STAR Linea1- 2014) de l’Université Federico II de Naples et Compagnia di San Paolo, Italie à RI.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/article/10.3389/fmicb.2016.01752/full#supplementary-material
FIGURE S1 | Images de champ entier de l’analyse par microscopie à fluorescence rapportée à la figure 4. Le même champ de microscopie a été observé par contraste de phase et par microscopie à fluorescence. Barre d’échelle de 5 μm. Le panneau de fusion est rapporté. Le temps d’exposition est indiqué.
FIGURE S2 | Images de champ entier de l’analyse par immunofluorescence rapportée à la figure 7. Le même champ de microscopie a été observé par contraste de phase et par microscopie à fluorescence. Barre d’échelle de 5 μm. Le temps d’exposition était de 200 ms pour toutes les images.
TABLE S1 | Analyse densitométrique des expériences de dot blot avec les surnageants de la réaction d’adsorption avec les spores QM B1551 (Figure 1B).
TABLE S2 | Analyse densitométrique des expériences de dot blot avec les surnageants de divers lavages après la réaction d’adsorption (Figure 1C).
TABLE S3 | Analyse densitométrique des expériences de dot blot avec les surnageants de la réaction d’adsorption réalisée avec les spores des souches PY79, QM B1551, et PV361 (Figure 3B).
TABLE S4 | Analyse densitométrique des expériences de dot blot avec les surnageants de la réaction d’adsorption réalisée avec différentes quantités de mRFP.
Baccigalupi, L., Ricca, E., et Ghelardi, E. (2015). » Probiotiques non-LAB : les formateurs de spores « , in Probiotiques et prébiotiques : Current Research and Future Trends, eds K. Venema et A. P. do Carmo (Norfolk, VA : Caister Academic Press), 93-103. doi : 10.21775/9781910190098.06
CrossRef Full Text | Google Scholar
Campbell, R. E., Tour, O., Palmer, A. E., Steinbach, P. A., Baird, G. S., Zacharias, D. A., et al. (2002). Une protéine fluorescente rouge monomère. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882. doi : 10.1073/pnas.082243699
PubMed Abstract | CrossRef Full Text | Google Scholar
Cangiano, G., Sirec, T., Panarella, C., Isticato, R., Baccigalupi, L., De Felice, M., et al. (2014). Les produits du gène sps affectent la germination, l’hydrophobie et l’adsorption des protéines des spores de Bacillus subtilis. Appl. Environ. Microbiol. 80, 7293-7302. doi : 10.1128/AEM.02893-14
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S. M. (2011). Bacillus probiotiques. Food Microbiol. 28, 214-220. doi : 10.1016/j.fm.2010.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S., et Vander Horn, P. B. (1990). « Analyse génétique », dans Molecular Biological Methods for Bacillus, eds C. Harwood et S. Cutting (Chichester : John Wiley and Sons), 27-74.
Google Scholar
Díaz-González, F., Milano, M., Olguin-Araneda, V., Pizarro-Cerda, J., Castro-Córdova, P., Tzeng, S. C., et al. (2015). Composition protéique de la couche externe de type exosporium des 630 spores de Clostridium difficile. J. Proteom. 123, 1-13. doi : 10.1016/j.jprot.2015.03.035
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Luccia, B., D’Apuzzo, E., Varriale, F., Baccigalupi, L., Ricca, E., et Pollice, A. (2016). Bacillus megaterium SF185 induit des voies de stress et affecte la distribution du cycle cellulaire des cellules épithéliales intestinales humaines. Bénéf. Microb. 7, 609-620. doi : 10.3920/BM2016.0020
PubMed Abstract | CrossRef Full Text | Google Scholar
Donadio, G., Lanzilli, M., Sirec, T., Ricca, E., et Isticato, R. (2016) Adsorption et localisation des protéines sur les spores de type sauvage et mutant de Bacillus subtilis. Microb. Cell Fact. 15:153. doi : 10.1186/s12934-016-0551-2
PubMed Abstract | CrossRef Full Text
Eppinger, M., Bunk, B., Johns, M. A., Edirisinghe, J. N., Kutumbaka, K. K., Koenig, S. S., et al. (2011). Séquences génomiques des souches de Bacillus megaterium QM B1551 et DSM319, importantes sur le plan biotechnologique. J. Bacteriol. 193, 4199-4213. doi : 10.1128/JB.00449-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Giglio, R., Fani, R., Isticato, R., De Felice, M., Ricca, E., et Baccigalupi, L. (2011). Organisation et évolution des gènes cotG et cotH de Bacillus subtilis. J. Bacteriol. 193, 6664-6673. doi : 10.1128/jb.06121-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Harwood, C. R., et Cutting, S. M. (1990). Méthodes de biologie moléculaire pour les Bacillus. Chichester : John Wiley and Sons.
Google Scholar
Huang, J. M., Hong, H. A., Van Tong, H., Hoang, T. H., Brisson, A., et Cutting, S. M. (2010). Administration muqueuse d’antigènes par adsorption sur des spores bactériennes. Vaccine 28, 1021-1030. doi : 10.1016/j.vaccine.2009.10.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., De Felice, M., et Ricca, E. (2010). CotE se lie à CotC et CotU et médiateur de leur interaction pendant la formation du manteau de spore dans Bacillus subtilis. J. Bacteriol. 192, 949-954. doi : 10.1128/JB.01408-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., Zilhão, R., Baccigalupi, L., Henriques, A. O., De Felice, M., et al. (2008). Hétérodimérisation de CotC-CotU pendant l’assemblage de l’enveloppe de la spore de Bacillus subtilis. J. Bacteriol. 190, 1267-1275. doi : 10.1128/JB.01425-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., et Ricca, E. (2014). Affichage de la surface des spores. Microbiol. Spectr. 2, 351-366. doi : 10.1128/microbiolspec.TBS-0011-2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Sirec, T., Treppiccione, L., Maurano, F., De Felice, M., Rossi, M., et al. (2013). Affichage non recombinant de la sous-unité B de la toxine thermolabile d’Escherichia coli sur des spores de type sauvage et mutant de Bacillus subtilis. Microb. Cell Fact. 12:98. doi : 10.1186/1475-2859-12-98
PubMed Abstract | CrossRef Full Text | Google Scholar
Knecht, L. D., Pasini, P., et Daunert, S. (2011). Les spores bactériennes comme plateformes pour des applications bioanalytiques et biomédicales. Anal. Bioanal. Chem. 400, 977-989. doi : 10.1007/s00216-011-4835-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Koshikawa, T., Beaman, T. C., Pankratz, H. S., Nakashio, S., Corner, T. R., et Gerhardt, P. (1984). Résistance, germination, et corrélats de perméabilité des spores de Bacillus megaterium successivement déposées des couches de tégument. J. Bacteriol. 159, 624-632.
PubMed Abstract | Google Scholar
Manetsberger, J., Hall, E. A. H., et Christie, G. (2015a). Les gènes codés par les plasmides influencent l’assemblage et la morphologie de l’exosporium dans les spores de Bacillus megaterium QM B1551. FEMS Microbiol. Lett. 362:fnv147. doi : 10.1093/femsle/fnv147
PubMed Abstract | CrossRef Full Text | Google Scholar
Manetsberger, J., Manton, J. D., Erdelyi, M. J., Lin, H., Rees, D., Christie, G., et al. (2015b). La microscopie de localisation ellipsoïde infère la taille et l’ordre des couches de protéines dans les manteaux de spores de Bacillus. Biophys. J. 109, 2058-2066. doi : 10.1016/j.bpj.2015.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
McCloy, R., Rogers, S., Caldon, E., Lorca, T., Castro, A., et Burgess, A. (2014). L’inhibition partielle de Cdk1 en phase G2 outrepasse le SAC et découple les événements mitotiques. Cell Cycle 13, 1400-1412. doi : 10.4161/cc.28401
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenney, P. T., Driks, A., et Eichemberger, P. (2012). L’endospore de Bacillus subtilis : assemblage et fonctions de l’enveloppe multicouche. Nat. Rev. Microbiol. 11, 33-44. doi : 10.1038/nrmicro2921
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicholson, W. L., et Setlow, P. (1990). « Sporulation, germination et croissance externe », dans Molecular biological methods for Bacillus, eds C. Harwood et S. Cutting (Chichester : John Wiley and Sons), 391-450.
Google Scholar
Nishihara, T., Takubo, Y., Kawamata, E., Koshikawa, T., Ogaki, J., et Kondo, M. (1989). Role of outer coat in resistance of Bacillus megaterium spore. J. Biochem. 106, 270-273.
PubMed Abstract | Google Scholar
Pesce, G., Rusciano, G., Sirec, T., Isticato, R., Sasso, A., et Ricca, E. (2014). Mesures de la charge de surface et du coefficient hydrodynamique de la spore de Bacillus subtilis par pinces optiques. Colloids Surf. B Biointerfaces 116C, 568-575. doi : 10.1016/j.colsurfb.2014.01.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., et Isticato, R. (2014). Administration d’un vaccin muqueux par des spores non recombinantes de Bacillus subtilis. Microb. Cell Fact. 13, 115. doi : 10.1186/s12934-014-0115-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosso, M. L., et Vary, P. S. (2005). Distribution des plasmides de Bacillus megaterium QM B1551 parmi les autres souches de B. megaterium et les espèces de Bacillus. Plasmid 53, 205-217. doi : 10.1016/j.plasmid.2004.10.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rusciano, G. Zito, G., Isticato, R., Sirec, T., Ricca, E., Bailo, E., et Sasso, A. (2014). Imagerie chimique à l’échelle nanométrique des spores de Bacillus subtilis en combinant la diffusion Raman améliorée par la pointe et des outils statistiques avancés. ACS Nano 8, 12300-12309. doi : 10.1021/nn504595k
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirec, T., Strazzulli, A., Isticato, R., De Felice, M., Moracci, M., et Ricca, E. (2012). Adsorption de la bêta-galactosidase d’Alicyclobacillus acidocaldarius sur des spores de type sauvage et mutants de Bacillus subtilis. Microb. Cell Fact. 11:100. doi : 10.1186/1475-2859-11-100
PubMed Abstract | CrossRef Full Text | Google Scholar
Stewart, G. C. (2015). La couche Exosporium des spores bactériennes : une connexion à l’environnement et à l’hôte infecté. Microbiol. Mol. Biol. Rev. 79, 437-457. doi : 10.1128/MMBR.00050-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Vary, P. S., Biedendieck, R., Fuerch, T., Meinhardt, F., Rohde, M., Deckwer, W. -D., et al. (2007). Bacillus megaterium – de la simple bactérie du sol à l’hôte industriel de production de protéines. Appl. Microbiol. Biotechnol. 76, 957-967 doi : 10.1007/s00253-007-1089-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Youngman, P., Perkins, J. B., et Losick, R. (1984). Une nouvelle méthode pour le clonage rapide dans Escherichia coli de l’ADN chromosomique de Bacillus subtilis adjacent à l’insertion Tn917. Mol. Gen. Genet. 195, 424-433. doi : 10.1007/BF00341443
CrossRef Full Text | Google Scholar