Introduction
L’analyse de la variabilité de la fréquence cardiaque (VRC) permet de mieux comprendre la régulation autonome et les interactions entre les systèmes nerveux sympathique et parasympathique. Le VRC décrit les variations de la fréquence cardiaque dans le temps qui se produisent naturellement dans des états sains. Ces variations reflètent la capacité de l’organisme à s’adapter en permanence aux événements internes et externes, afin de maintenir l’homéostasie. Il est intéressant de noter que Chrousos et Gold (1992, p. 1245) ont défini le stress comme un « état d’homéostasie menacée ». Par conséquent, au fil des années, une diminution du VRC a été présumée refléter une élévation du stress et l’analyse du VRC a été de plus en plus reconnue comme l’une des méthodologies pour mesurer le stress.
L’une des mesures les plus simples du VRC (SDNN) quantifie l’écart type de la durée des intervalles RR normaux, c’est-à-dire la façon dont l’intervalle entre les pics R normaux (sinusaux) des QRS consécutifs sur l’électrocardiogramme (ECG) varie dans le temps. Néanmoins, de nombreuses métriques et approches mathématiques de l’analyse du VRC ont été développées au fil des ans pour extraire des informations de plus en plus précises du VRC (Shaffer et Ginsberg, 2017).
L’analyse du VRC dans le domaine temporel est axée sur la variation des intervalles SDNN (c’est-à-dire les intervalles RR normaux) au fil du temps. Outre le SDNN, les études de VRC examinent fréquemment la moyenne quadratique des différences successives (RMSSD) ou le pourcentage d’intervalles qui diffèrent du précédent de plus de 50 ms (pNN50) ou 20 ms (pNN20). Pour toutes ces mesures de la VRC dans le domaine temporel, des valeurs plus élevées reflètent une plus grande variabilité, qui est plus répandue dans les états sains.
Une analyse non linéaire ou géométrique de la VRC peut être réalisée en traçant les intervalles NN sur un graphique de Poincaré, où chaque intervalle NN est tracé par rapport à l’intervalle NN précédent (Golińska, 2013) et l’écart type du principal groupe de points de données est mesuré dans le sens transversal (SD1) ou longitudinal (SD2). Des mesures telles que l’indice sympathique cardiaque (CSI) et l’indice vagal cardiaque (CVI) ont été développées pour refléter les interactions entre SD1 et SD2 (Toichi et al., 1997). Le CSI se comporte en opposition au CVI, donc, contrairement à la plupart des autres mesures de la VRC, un CSI plus élevé est associé à une variabilité plus faible, c’est-à-dire à un stress plus élevé. D’autres métriques géométriques comprennent l’indice triangulaire (SDNN) et l’indice VRC. Comme le SDNN, ces deux paramètres indiquent une mesure de la variabilité globale pendant la période d’enregistrement. Le TINN mesure la largeur normalisée de la base de l’histogramme des intervalles NN (par rapport à la valeur la plus élevée de l’histogramme NN) et l’indice HRV est un rapport entre le nombre de tous les intervalles NN et le nombre d’intervalles NN au point le plus élevé de l’histogramme NN (normalisé à un taux d’échantillonnage de 128 valeurs par seconde).
Dans l’analyse du domaine fréquentiel, différentes bandes du spectre de puissance de l’ECG sont analysées ainsi que leurs interactions (entre les bandes et par rapport à la puissance totale). Chez les adultes, des études antérieures ont défini quatre bandes de fréquences d’intérêt : Ultra-basse fréquence (ULF), très-basse fréquence (VLF), basse fréquence (LF) et haute fréquence (HF), chacune étant réputée avoir des origines physiologiques différentes. L’ULF a été associée aux oscillations circadiennes de la température corporelle centrale et à la régulation rénine-angiotensine ; la VLF a été associée à la régulation à plus long terme de la thermorégulation et aux mécanismes hormonaux ; la LF a été associée à un mélange d’activité sympathique et vagale et à l’activité des barorécepteurs et la HF a été associée à l’activité vagale (Pomeranz et al., 1985). Néanmoins, la définition et la signification de l’ULF et de la VLF chez les bébés sont peu documentées et, par conséquent, ne sont pas incluses dans ce rapport. Bien que les quantifications absolues de la puissance dans les bandes HF et LF puissent augmenter/diminuer, sous une conductivité cardiaque normale, nous nous attendons à ce que LFn et HFn (qui sont LF et HF normalisés à la puissance totale) se comportent dans des directions opposées dans la plupart des cas. Par conséquent, alors que la HFn (représentant l’activité parasympathique) devrait être plus élevée lorsque le stress physiologique est faible, la LFn devrait être plus élevée lorsque le stress est élevé. Ces associations sont néanmoins controversées (von Rosenberg et al., 2017 ; Adjei et al., 2019) et l’interprétation des résultats de LF et HF dans des scénarios de la vie réelle nécessite de la prudence.
L’analyse de la variabilité de la fréquence cardiaque a été largement acceptée comme méthode de mesure de l’atteinte autonome et de plus en plus examinée en ce qui concerne sa valeur dans la stratification des maladies (Ahmad et al., 2009 ; Lees et al., 2018 ; Oliveira et al., 2018). Bien que des études antérieures aient décrit des valeurs de référence normatives de VRC pour les nouveau-nés au cours des premiers jours (Mehta et al., 2002 ; Longin et al., 2005 ; Doyle et al., 2009 ; Makarov et al., 2010 ; Lucchini et al., 2019), les enquêtes sur la VRC au cours des premières heures après la naissance font défaut. Ces études n’ont pour la plupart enregistré que quelques minutes d’ECG pendant le premier jour ou ne commencent qu’au-delà de 12 h d’âge et aucune n’a décrit les tendances continues de la VRC pendant les 24 premières heures de vie.
Néanmoins, pour certaines conditions, en particulier celles qui se produisent en raison de complications de la naissance et qui nécessitent des décisions sensibles au temps, comme l’encéphalopathie néonatale, il est important de décrire les valeurs de référence normales de la VRC immédiatement après la naissance et leurs tendances tout au long des 24 premières heures. Ces tendances précoces peuvent fournir des informations précieuses sur la façon dont un bébé s’est remis de toute complication liée à la naissance. Notre objectif principal était de décrire les valeurs de référence standard pour les tendances du VRC au cours des 24 premières heures de la vie postnatale chez les nourrissons à terme et en bonne santé. Comme objectif secondaire, nous avons cherché à savoir quelles caractéristiques cliniques ou quels facteurs de risque (le cas échéant) exercent un impact plus important sur la VRC.
Matériels et méthodes
Population étudiée
Nous avons recruté de manière prospective et consécutive 150 bébés à terme en bonne santé dans le centre de naissance, la salle de travail ou le service postnatal de l’hôpital Queen Charlotte’s and Chelsea entre août 2017 et janvier 2019. Nous avons inclus les bébés en bonne santé nés à 36 semaines d’âge gestationnel ou plus, suite à des grossesses non compliquées, qui sont nés en bon état avec un poids de naissance compris entre le 9e et le 91e centile. Les bébés étaient exclus s’ils nécessitaient une médication ou une photothérapie, s’il y avait une pyrexie maternelle périnatale pendant ou dans les 48 heures suivant le début du travail, s’ils nécessitaient une réanimation à la naissance ou après (intubation ou compressions cardiaques ou tout médicament) ou s’il y avait une complication intrapartum (hémorragie maternelle, décollement placentaire, pré-éclampsie ou prolapsus du cordon). Notre étude n’a inclus que les bébés qui se portaient bien à la naissance et qui, par conséquent, sont restés avec leur mère à tout moment.
Soins intrapartum et postnatals précoces
Les bébés inclus dans notre étude sont nés soit à la maison de naissance, soit en salle de travail, selon la préférence maternelle. Les femmes qui préféraient un accouchement plus naturel et moins médicalisé ont opté pour des soins dirigés par une sage-femme dans la maison de naissance. Une piscine chaude, l’aromathérapie, la musique, le protoxyde d’azote et divers équipements sont disponibles pour aider ces femmes à faire face à la douleur du travail. Les femmes qui ont opté pour une analgésie péridurale ont reçu des soins dirigés par un obstétricien dans la salle de travail. Dans les deux environnements, la température ambiante était fixée à 24-25°C. Conformément aux directives nationales, les bébés nés en bon état sont remis à leur mère immédiatement après la naissance et placés sur leur poitrine/abdomen pour des soins peau à peau. Ils peuvent être nettoyés délicatement lorsqu’ils sont sur la poitrine de la mère, et l’alimentation au sein ou au biberon est initiée dans l’heure qui suit la naissance.
Acquisition de l’ECG
Les enregistrements de l’électrocardiogramme ont été commencés dès que possible après la naissance, après le consentement écrit éclairé des parents, qui pouvait être obtenu en anténatal ou en postnatal. Cette étude a été approuvée par un comité national d’éthique de la recherche (REC17/LO/0956) et par le département local de recherche &développement. Les enregistrements ont été poursuivis pendant au moins 6 h, mais pouvaient être interrompus plus tôt si les parents le demandaient ou si le bébé sortait de l’hôpital. Nous avons utilisé un enregistreur ECG portable de 2 pouces (Faros 180, Bittium, Oulu, Finlande) avec une configuration thoracique à triple électrode et un taux d’échantillonnage de 500 Hz (figure 1), que nous avions testé précédemment. Une fois l’enregistrement terminé, le fichier ECG a été téléchargé sur le logiciel d’analyse VRC CardiscopeTM (Hasiba Medical, Graz, Autriche) pour l’analyse de l’ECG et du VRC.
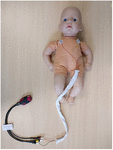
Figure 1. Enregistreur ECG portable et configuration thoracique. Trois électrodes ECG ont été alimentées par un manchon d’alignement pour réduire la distance entre les fils ECG et prévenir les artefacts d’induction magnétique sur le signal ECG brut (500 Hz avec détection automatique des pics R).
Analyse de la VRC
Les métriques de variabilité de la fréquence cardiaque dans les domaines temporel (linéaire et non linéaire) et fréquentiel ont été calculées pour chaque segment de 5 minutes de l’ECG (fenêtres non chevauchantes). Nous avons utilisé une validité minimale des QRS de 90%, ce qui signifie que tous les segments de 5 minutes présentant moins de 90% de QRS consécutifs de bonne qualité ont été exclus de l’analyse. Étant donné l’absence de recommandations internationales pour l’analyse du VRC spécifiquement pour les nouveau-nés, nos méthodes et les métriques choisies étaient basées sur une adaptation des directives internationales disponibles (Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology, 1996 ; Schwartz et al., 2002) plus des recommandations récentes pour la recherche sur le VRC (Laborde et al., 2017) et une revue des études pertinentes sur le VRC chez les nouveau-nés pendant les premiers jours de vie (Doyle et al., 2009 ; Goulding et al., 2015 ; Temko et al., 2015). Les 16 métriques de VRC que nous avons choisi d’analyser étaient basées sur ces références. L’analyse des fréquences a été réalisée avec une transformée de Fourier (périodogramme de Welch) et nous avons utilisé des séries temporelles d’intervalles RR détendues et interpolées (spline cubique). Sur la base de la littérature ci-dessus, nous avons utilisé une bande LF de 0,04-0,20 Hz et une bande HF de 0,20-2,0 Hz. Nous avons ensuite analysé la LF et la HF normalisées, c’est-à-dire la proportion de puissance dans ces plages par rapport à la puissance spectrale totale. La liste des métriques VRC rapportées dans cette étude et leur signification sont décrites dans le tableau 1.

Tableau 1. Métriques de la VRC : abréviations et signification.
Analyse statistique
Nous avons utilisé Stata 15 (StataCorp, Austin, TX, États-Unis) pour l’analyse statistique. Nous avons décrit les tendances temporelles du VRC avec les médianes horaires et les intervalles interquartiles et calculé les moyennes individuelles pour les 6 et 24 premières heures de vie. Étant donné que les enregistrements ECG pouvaient commencer et se terminer à des moments différents, que nos données étaient déséquilibrées, c’est-à-dire que nous n’avions pas exactement le même nombre de mesures pour tous les participants, les changements de VRC dans le temps ont été analysés avec une régression à effets mixtes multiniveaux avec covariance autorégressive ou en utilisant des tests par paires si l’on comparait six moyennes horaires. La pertinence des variables cliniques a également été testée à l’aide d’une régression à effets mixtes multiniveaux avec covariance autorégressive et des comparaisons de sous-groupes ont été effectuées à l’aide de tests de comparaison des proportions/moyennes pour les variables cliniques significatives. Comme la plupart des tendances n’étaient pas linéaires et présentaient au moins une inflexion, nous avons utilisé un terme quadratique pour la variable temps dans le modèle de régression. Nous avons transformé en logarithme les variables VRC qui n’étaient pas normalement distribuées pour garantir des résidus normaux.
Résultats
Entre septembre 2017 et janvier 2019, nous avons dépisté 511 bébés dont 360 étaient éligibles et 151 ne l’étaient pas. Sur ces 360 bébés, 201 mères/pères nous ont demandé de revenir plus tard ou à un autre moment opportun, ce qui a finalement dépassé la fenêtre de recrutement maximale ou est devenu impossible à recruter en raison de l’utilisation de l’équipement. Sur les 159 mères/pères qui ont été pleinement informés de l’étude, 9 ont refusé et 150 ont donné leur consentement écrit. Sur ces 150 participants, 7 ont commencé l’enregistrement de l’ECG après 24 h. Les caractéristiques de l’échantillon sont indiquées dans les tableaux 2, 3. Au total, nous avons obtenu 1858 h et 55 min d’enregistrement ECG à partir d’un âge médian (IQR) de 2 h 46 min (3 h 6 min), minimum 1 min après la naissance, maximum 52 h 23 min. Tous les bébés n’ont pas commencé l’enregistrement ECG au même moment et tous les enregistrements n’ont pas eu la même durée. La figure 2 présente le nombre d’enregistrements valides et de bébés par temps.

Tableau 2. Caractéristiques de l’échantillon I (variables continues).

Tableau 3. Caractéristiques de l’échantillon II (variables catégorielles).
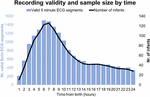
Figure 2. Validité de l’enregistrement et taille de l’échantillon en fonction du temps.
Valeurs du VHR en fonction du temps
Pendant les 6 premières heures de l’âge postnatal, les valeurs médianes (IQR) étaient les suivantes : HR 122 (15,9), SDNN 27,5 (13,2), RMSSD 18,32 (11,42), SD1 13.6 (7,7), SD2 36,2 (17,8), SDSD 18,8 (11,4), CVI 2,7 (0,4), CSI 2,6 (1,2), pNN20 14,8 (15,2), pNN50 1,7 (2.5) HFn 40,4 (16,9) LFn 57,7 (17,8) Puissance totale 751 (835), TINN 226 (144) HRV Index 5,9 (2,3) Parseval 0,7 (0,2). Neuf de ces paramètres VRC (y compris la fréquence cardiaque) ont changé de manière significative au fil du temps (HR p < 0,01 ; SDNN p = 0,01 ; SD2 p < 0,01 ; CSI p < 0,01 ; HFn p = 0,03 ; LFn p < 0,01;Puissance totale p < 0,01 ; Indice VRC p = 0,01 ; Indice Parseval p = 0,03), après ajustement pour les variables cliniques pertinentes. Une variation plus prononcée a été observée au cours des 6 premières heures de vie postnatale. Seuls la fréquence cardiaque et le LFn ont changé entre 6 et 12 h de vie et seule la fréquence cardiaque a changé entre 12 et 18 h de vie (valeurs p ajustées par Bonferroni : 0,03, < 0,01 et < 0,01, respectivement). Ces paramètres ont montré une augmentation de la VRC pendant les 6 premières heures, suivie d’une légère diminution jusqu’à 12 heures, après quoi la VRC est restée stable (tableau 4). Les tendances horaires exprimées par la médiane et les intervalles interquartiles sont présentées dans la figure 3. Les tendances de la VRC au fil du temps ont été affectées de manière indépendante par l’âge gestationnel, les mouvements fœtaux réduits, la classification de la cardiotocographie (CTG), les maladies maternelles chroniques ou induites par la grossesse et les complications de l’accouchement. Nous avons examiné les interdépendances de toutes les métriques de la VRC avec une matrice de corrélation (figure 4), où nous soulignons (a) la similitude entre les métriques du domaine temporel et (b) la tendance à la symétrie entre HFn et LFn et CSI et CVI.
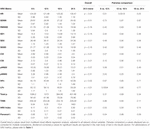
Tableau 4. Moyennes de la VRC sur six heures et comparaisons par paires.
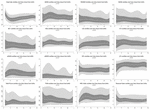
Figure 3. Centiles du VRC pendant les 24 premières heures de l’âge. Zones gris clair : 5e-25e centiles et 75e-95e centiles. Zones gris foncé : 25e-75e centiles. La ligne blanche centrale correspond à la médiane. Les valeurs p rapportées résultent d’une régression à effets mixtes multi-niveaux pour mesurer les changements dans le temps. Tous les centiles sont lissés avec une spline cubique.

Figure 4. Matrice de corrélation : toutes les métriques de la VRC. Pour les abréviations des métriques de la VRC, veuillez vous référer au tableau 1. Nous notons en particulier (a) la concordance entre RMSSD, SDSD et SD1, qui a été décrite précédemment ; (b) le comportement des différentes métriques de la VRC par rapport à la FC qui souligne combien d’informations supplémentaires l’analyse de la VRC peut fournir ; (c) l’interdépendance de HFn et LFn et CVI et CSI, soulignant l’interaction entre les influences sympathiques et parasympathiques.
Effet des facteurs cliniques
En plus de l’âge (time form birth), une régression univariable à effets mixtes multi-niveaux a montré que les métriques de la VRC étaient affectées par l’âge gestationnel, les mouvements fœtaux réduits, le CTG, la maladie maternelle et les complications de l’accouchement. Après ajustement pour ces variables, la variation dans le temps des sept paramètres VRC ci-dessus est restée statistiquement significative. Le HFn et l’indice de Parseval ont également montré des changements significatifs. Bien que la parité n’ait pas été un prédicteur indépendant lors de l’analyse de régression univariable, dans le sous-groupe des accouchements vaginaux spontanés, nous avons observé une tendance cohérente vers une VRC plus élevée pour les primipares par rapport aux multipares.
Mouvements fœtaux réduits
Les mouvements fœtaux réduits étaient systématiquement associés à des valeurs de VRC plus faibles pour toutes les métriques, à l’exception de l’ICS (qui se comporte dans la direction opposée, c’est-à-dire que le résultat est concordant). Ces différences entre les sous-groupes n’étaient statistiquement significatives que pour les tendances du CSI (p = 0,001), du pNN20 (p = 0,045) et de l’indice de Parseval (p = 0,047). La figure 5 présente les tendances de ces trois métriques dans le temps, en comparaison avec la fréquence cardiaque. Ceci malgré l’absence de différences significatives entre les sous-groupes, à l’exception de la gravidité moyenne, qui n’a pas prédit de manière indépendante la VRC (tableau 5). Les associations avec l’ICS et le pNN20 sont restées significatives après ajustement en fonction de l’âge gestationnel, du temps écoulé depuis la naissance, de la classification CTG, de la présence de maladies chroniques maternelles ou de complications à l’accouchement (tableau 6). Le sous-groupe présentant des mouvements fœtaux réduits avait une VRC moyenne plus faible au cours des 6 premières heures, bien que ces différences ne soient pas statistiquement significatives.
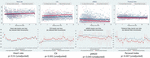
Figure 5. Modifications de la VRC chez les bébés dont les mères ont signalé une réduction des mouvements fœtaux. Pour les abréviations des paramètres de la VRC, veuillez vous référer au tableau 1. Les panneaux supérieurs présentent la dispersion des données VRC dans le temps et les lignes de tendance linéaire pour la fréquence cardiaque (comparative) et les trois paramètres VRC qui étaient significativement associés aux rapports maternels de mouvements foetaux réduits. Les lignes rouges représentent les bébés dont les mères ont signalé une réduction des mouvements fœtaux et les lignes bleues représentent les bébés dont les mères n’ont pas signalé de tels mouvements. Les panneaux inférieurs présentent les moyennes et les intervalles de confiance à 95% pour ces métriques.
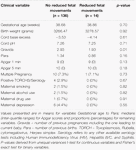
Tableau 5. Comparaison des sous-groupes – bébés avec et sans mouvements foetaux réduits.

Tableau 6. Corrélation non ajustée et ajustée entre les paramètres de VRC et les mouvements fœtaux réduits.
Cardiotocographie
Il y avait une association significative entre les résultats de la CTG et les tendances de la VRC au fil du temps pour le CSI (p = 0,03), le LFn (0,01) et le HFn (p = 0,02), qui restait statistiquement significative après ajustement pour les mouvements fœtaux réduits, l’âge gestationnel, le temps écoulé depuis la naissance, la présence d’une maladie maternelle chronique ou induite par la grossesse ou les complications de l’accouchement. Néanmoins, étant donné le petit nombre d’événements dans chaque classification CTG, nous avons également comparé la moyenne à 6 heures dans ces sous-groupes. L’ICS dans le sous-groupe bradycardie était significativement différent des groupes » normal « , » décélération variable » et » autre » (valeurs p ajustées par Bonferroni : 0,02, 0,03 et 0,04, respectivement) mais aucune autre différence de groupe n’était statistiquement significative. Le HFn était seulement différent entre les sous-groupes « bradycardie » et « décélération variable » (p = 0,03) et le LFn ne variait pas entre les différents sous-groupes CTG.
Maladie maternelle chronique ou acquise pendant la grossesse
Dans notre échantillon, 104 (69%) femmes n’avaient pas de maladie chronique ni de maladie acquise pendant la grossesse, 20 (13%) avaient un diabète sucré isolé ou un diabète gestationnel, 7 (3%) avaient une maladie de la thyroïde, 1 (0,7%) avait une hypertension et le reste avait d’autres conditions, y compris des combinaisons de ce qui précède (tableau 3). La maladie chronique ou induite par la grossesse de la mère était significativement associée aux tendances non ajustées du VRC, bien que cela ne soit resté statistiquement significatif que pour l’indice de Parseval (p = 0,03) après ajustement des facteurs de confusion cliniques. Selon une analyse binaire, les bébés de mères souffrant d’une grossesse ou d’une maladie chronique ne présentaient pas d’indices de Parseval moyens différents, que ce soit au cours des 6 premières heures (p = 0,98) ou au cours de la période de 24 heures (p = 0,29). Le groupe de maladies présentant l’indice de Parseval le plus bas était les maladies thyroïdiennes.
Événements pendant le travail et l’accouchement
Tous les bébés de notre étude sont nés à la suite de grossesses et d’accouchements sans complication et sont nés en bon état. Néanmoins, 13 naissances ont présenté l’un des événements suivants : liqueur souillée de méconium (11), cordon cervical circulaire (1), 2e stade de travail prolongé (1) et dystocie des épaules (1, en plus du méconium). Les tendances de l’ICS sur 24 heures étaient significativement associées à la présence de tout événement lié au travail et à l’accouchement avant (p = 0,04) mais pas après ajustement des facteurs de confusion (p = 0,42).
Bien que le mode d’accouchement n’ait pas prédit indépendamment les valeurs de VRC, les bébés nés par accouchement instrumental présentaient une HFn sur 24 heures plus faible et un ICS sur 24 heures plus élevé que les bébés nés par accouchement vaginal naturel. Ceci malgré l’absence de différences significatives entre les autres variables cliniques pertinentes, à l’exception du score d’Apgar à 1 minute et de la multiplicité de la gestation qui ne prédisaient pas indépendamment la VRC (tableau 7).
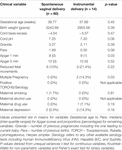
Tableau 7. Comparaison des sous-groupes – bébés nés par voie vaginale normale par rapport à l’accouchement instrumental.
Discussion
C’est la première étude à décrire les tendances de la VRC continue postnatale précoce chez les bébés à terme en bonne santé dans la période postnatale immédiate. L’identification de ces seuils et tendances était importante car nous savons maintenant que l’analyse et l’interprétation de la VRC dans la période postnatale précoce dépendent du temps, c’est-à-dire que ce qui est normal à 1-6 h d’âge peut ne pas l’être à 12-18 h d’âge. Cela permettra aux cliniciens et aux chercheurs d’examiner avec plus de précision les différences de VRC entre les nourrissons en bonne santé et les nourrissons malades dans la période postnatale immédiate. Disposer de valeurs de référence précises pour la période postnatale immédiate signifie également que nous sommes désormais mieux équipés pour développer des systèmes d’alerte précoce basés sur l’analyse de la VRC.
Il existe quelques raisons possibles pour les changements que nous avons observés dans les 6 premières heures après la naissance. La naissance ayant été précédemment décrite comme un événement stressant pour les bébés (Peebles et al., 1994 ; Aldrich et al., 1996), il est possible que l’amélioration de la VRC au cours des premières heures reflète la fin de l’effet stresseur (c’est-à-dire la fin de la naissance). Ce rebond parasympathique pourrait se produire parce que le système nerveux sympathique peut temporairement supprimer l’activité parasympathique qui cesse une fois la période de stress terminée. Dans une perspective différente, Reyes-Lagos et al. 2015 ont rapporté une VRC maternelle plus élevée pendant le travail que pendant le troisième trimestre et Musa et al. 2017 ont décrit une augmentation de la LFn et de la HFn par la dilatation cervicale pendant le travail. Si la VRC fœtale suit la VRC maternelle, cela suggérerait plutôt que la naissance puisse représenter une période de VRC particulièrement élevée reflétant la bonne adaptation aux défis physiologiques, chez les bébés en bonne santé. Enfin, il est également possible que les changements de VRC observés au cours des premières heures soient une expression partielle de la maturation du VRC qui se produit avec l’âge (Fyfe et al., 2015).
Nous avons examiné les résultats de VRC rapportés dans d’autres études néonatales et fœtales avec l’intention de comparer ces valeurs avec celles de notre étude, mais étant donné les différences de métriques et d’acquisition et de durée pour les enregistrements, cela a été très difficile. Les valeurs de VRC que nous avons observées au cours des 6 à 12 premières heures étaient comparables (légèrement supérieures) à celles rapportées par Doyle et al. (2009) dans le sommeil actif au cours des 12 premières heures de vie et par Lucchini et al. (2019) à l’âge de 12 à 84 heures, et inférieures à celles rapportées à des âges plus avancés, c’est-à-dire de 24 à 168 heures (par Mehta et al., 2002 ; Longin et al., 2005 ; Makarov et al., 2010). Les bébés de notre étude présentaient des valeurs de SDNN pendant les 6 premières heures d’âge comparables (légèrement supérieures) à celles des fœtus à terme (Brändle et al., 2015 ; Schneider et al., 2018), ce qui était attendu, compte tenu de la durée d’enregistrement plus longue et de l’âge gestationnel croissant. Le fait d’avoir une VRC similaire avant et après la naissance soutient la théorie selon laquelle la naissance, chez les bébés en bonne santé, est associée à une bonne stabilité de la VRC.
Nous avons observé plus de variabilité inter-sujet que de variabilité intra-sujet pour toutes les métriques de la VRC. Cela souligne le fait que l’analyse de la VRC doit être interprétée non seulement en fonction des valeurs de référence, mais aussi en tenant compte des changements et des progrès par rapport aux valeurs de référence individuelles. En fait, alors que nous avons pu observer des changements horaires du VRC pendant les 6 premières heures de l’âge, nous n’aurions peut-être pas pu détecter une telle variation si nous nous étions engagés à analyser un seul point temporel ou une seule moyenne. L’observation de ces tendances pourrait permettre de mieux comprendre comment un nourrisson se remet de sa naissance en cas d’accouchement compliqué ou d’intervention d’urgence. En effet, le fait que les métriques de la VRC étaient significativement associées à une réduction des mouvements fœtaux, à un CTG anormal, à une maladie maternelle chronique ou induite par la grossesse et à des complications de l’accouchement souligne la valeur de l’analyse de la VRC en tant que mesure du bien-être global.
L’association entre la VRC et les mouvements fœtaux a été précédemment rapportée par Brändle et al. (2015) en utilisant la biomagnétographie fœtale. Dans leur étude évaluant l’état de comportement basé sur les mouvements qui comprenait des fœtus en bonne santé de 24 à 41 semaines, les métriques de la VRC (mais pas l’Entropie) augmentaient du sommeil calme au sommeil actif et du sommeil actif à l’état d’éveil, pour tous les âges gestationnels. En fait, Nijhuis et al. (1982) avaient déjà proposé une classification des mouvements fœtaux basée sur la VRC fœtale, les mouvements oculaires et les mouvements corporels.
Des auteurs précédents ont trouvé des différences dans les valeurs de VRC selon les différents modes d’accouchement. Kozar et al. (2018) ont signalé une HFn plus faible et une LFn plus élevée chez les bébés nés par césarienne que chez les bébés nés par voie vaginale. Il est possible que leurs résultats soient liés à l’utilisation de Thiopental pour l’anesthésie générale (AG) dans toutes leurs sections électives (Riznyk et al., 2005 ; Tsuchiya et al., 2006) plutôt qu’au mode d’accouchement, alors que dans notre étude, aucune AG n’a été utilisée. Notre interprétation est que la VRC indiquera une différence entre les modes d’accouchement s’il y a une différence de bien-être, donc, dans notre étude, cela aurait été associé à l’utilisation d’instruments pendant l’accouchement en raison d’une extraction difficile.
Limitations
Nous n’avons pas examiné les états de sommeil des nourrissons recrutés pendant les 24 premières heures après la naissance. Il est peu probable que les bébés aient établi un circadien dans les quelques heures suivant la naissance et souvent les nouveau-nés suivent plutôt des rythmes ultradiens (Mirmiran et al., 2003). Néanmoins, il est possible que la tendance légèrement à la baisse que nous avons observée dans la seconde moitié des enregistrements de 24 heures reflète une plus grande proportion de bébés dormant ou dans un état plus calme. Nous avons inclus dans notre étude quelques bébés en bonne santé dont les mères souffraient de maladies chroniques ou induites par la grossesse. On pourrait arguer que l’inclusion de ces cas compromet notre définition du nouveau-né sain et du VRC néonatal sain. Le fait qu’il n’y ait pas eu d’association significative entre une mesure de la VRC et le pH, l’excès de bases ou le score d’Apgar montre que notre échantillon était effectivement sain, car tous les bébés de notre étude sont nés en bonne santé et n’ont pas nécessité d’examens ou de traitements. Notre objectif était de représenter l’ensemble des accouchements qui sont considérés et pris en charge cliniquement comme » sains » d’un point de vue pragmatique (c’est-à-dire tous les accouchements » à faible risque » et » sans complication « ). Ainsi, l’inclusion de ces bébés était une étape importante pour aborder les éventuelles « variations de la normale » et enrichir notre ensemble de données. De même, nous avons exploré les différences possibles de VRC dans plusieurs sous-groupes (en fonction des variables cliniques telles que décrites dans le tableau 2). Il est important de préciser que notre étude n’avait pas pour objectif ni pour puissance d’examiner en détail les différences possibles entre ces sous-groupes et qu’il convient d’interpréter nos résultats avec prudence. Néanmoins, nous pensons que l’examen de ces associations sera intéressant pour les équipes de soins de santé en obstétrique et en périnatalité/néonatalité.
Conclusion
Nous avons décrit les valeurs de référence postnatales précoces pour les métriques de la VRC chez les nourrissons à terme en bonne santé, ce qui n’avait pas été réalisé auparavant. La VRC change de manière significative au cours du premier jour de vie, en particulier au cours des 6 premières heures, pendant lesquelles elle semble présenter une brève augmentation suivie d’une normalisation. Les corrélations significatives entre la VRC et les variables de risque clinique soutiennent l’hypothèse selon laquelle la VRC est un bon indicateur du bien-être général d’un bébé et est sensible pour capter le stress lié à la naissance et suivre sa résolution dans le temps.
Data Availability
Les données brutes soutenant les conclusions de ce manuscrit seront mises à disposition par les auteurs, sans réserve indue, à tout chercheur qualifié.
Ethics Statement
Cette étude a été réalisée conformément aux recommandations de la United Kingdom Health Research Authority et des BPC ICH avec le consentement éclairé écrit de tous les sujets. Tous les sujets ont donné leur consentement éclairé écrit conformément à la Déclaration d’Helsinki. Le protocole a été approuvé par le comité d’éthique de la recherche de London Chelsea.
Contributions des auteurs
VO a conçu l’étude, collecté, analysé et interprété les données, rédigé le premier projet et dirigé le développement du manuscrit. WvR a contribué à l’analyse et à l’interprétation des données et a apporté des contributions essentielles à l’élaboration du manuscrit. PM et TA ont contribué à l’interprétation des données et ont apporté des contributions essentielles à l’élaboration du manuscrit. JM a contribué à la conception de l’étude et à l’interprétation des données, a recruté les patients et acquis les données. VS a contribué à la gestion de l’étude et au recrutement. DM a supervisé tous les aspects de l’analyse et de l’interprétation du VRC et a apporté une contribution essentielle à l’élaboration du manuscrit. ST a conçu l’idée et conçu l’étude, a supervisé tous les aspects de l’étude et a dirigé l’élaboration du manuscrit.
Funding
VO a été financé par la bourse de recherche doctorale NIHR ICA. PM a été financé par la bourse de recherche doctorale du MRC. Les opinions exprimées sont celles de l’auteur ou des auteurs et pas nécessairement celles des NIHR ou du ministère de la Santé.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous souhaitons remercier tous les parents qui ont consenti à la participation de leur bébé à cette étude et M. Paul Basset (statisticien médical) pour son soutien dans l’analyse statistique des données incluses dans ce manuscrit.
Adjei, T., Rosenberg, W., Von, Nakamura, T., et Chanwimalueang, T. (2019). The classA framework : HRV based assessment of SNS and PNS dynamics without LF-HF controversies. Front. Physiol. 10:505. doi : 10.3389/fphys.2019.00505
PubMed Abstract | CrossRef Full Text | Google Scholar
Ahmad, S., Tejuja, A., Newman, K. D., Zarychanski, R., et Seely, A. J. E. (2009). Examen clinique : examen et analyse de la variabilité de la fréquence cardiaque et du diagnostic et du pronostic de l’infection. Crit. Care 13, 1-7. doi : 10.1186/cc8132
PubMed Abstract | CrossRef Full Text | Google Scholar
Aldrich, C. J., D’Antona, D., Spencer, J. A. D., Delpy, D. T., Reynolds, E. O. R., and Wyatt, J. S. (1996). Fetal heart rate changes and cerebral oxygenation measured by near-infrared spectroscopy during the first stage of labour. Eur. J. Obstet. Gynecol. Reprod. Biol. 64, 189-195. doi : 10.1016/0301-2115(95)02284-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Brändle, J., Preissl, H., Draganova, R., Ortiz, E., Kagan, K. O., Abele, H., et al. (2015). Les paramètres de variabilité de la fréquence cardiaque et les mouvements fœtaux complètent la détection des états comportementaux fœtaux via la magnétographie pour surveiller le développement neurovégétatif. Front. Hum. Neurosci. 9:147. doi : 10.3389/fnhum.2015.00147
PubMed Abstract | CrossRef Full Text | Google Scholar
Chrousos, G., et Gold, P. (1992). Les concepts de stress et de troubles du système de stress – aperçu de l’homéostasie physique et comportementale. JAMA 267, 1244-1252. doi : 10.1001/jama.267.9.1244
PubMed Abstract | CrossRef Full Text | Google Scholar
Doyle, O. M., Korotchikova, I., Lightbody, G., Marnane, W., Kerins, D., et Boylan, G. B. (2009). Variabilité de la fréquence cardiaque pendant le sommeil chez les nouveau-nés à terme en bonne santé au début de la période postnatale. Physiol. Meas. 30, 847-860. doi : 10.1088/0967-3334/30/8/009
PubMed Abstract | CrossRef Full Text | Google Scholar
Fyfe, K. L., Yiallourou, S. R., Wong, F. Y., Odoi, A., Walker, A. M., and Horne, R. S. C. (2015). L’effet de l’âge gestationnel à la naissance sur la maturation post-terme de la variabilité de la fréquence cardiaque. Sleep 38, 1635-1644. doi : 10.5665/sleep.5064
PubMed Abstract | CrossRef Full Text | Google Scholar
Golińska, A. K. (2013). Tracés de Poincaré dans l’analyse de signaux biomédicaux sélectionnés. Stud. Logique Gramm. Rhetor. 35, 117-127. doi : 10.2478/slgr-2013-0031
CrossRef Full Text | Google Scholar
Goulding, R. M., Stevenson, N. J., Murray, D. M., Livingstone, V., Filan, P. M., et Boylan, G. B. (2015). Variabilité de la fréquence cardiaque dans l’encéphalopathie ischémique hypoxique : corrélation avec le grade EEG et le résultat neurodéveloppemental à 2 ans. Pediatr. Res. 77, 681-687. doi : 10.1038/pr.2015.28
PubMed Abstract | CrossRef Full Text | Google Scholar
Kozar, M., Tonhajzerova, I., Mestanik, M., Matasova, K., Zibolen, M., Calkovska, A., et al. (2018). La variabilité de la fréquence cardiaque chez les nouveau-nés à terme en bonne santé est liée au mode d’accouchement : une étude observationnelle prospective. BMC Pregnancy Childbirth 18:264. doi : 10.1186/s12884-018-1900-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Laborde, S., Mosley, E., et Thayer, J. F. (2017). La variabilité de la fréquence cardiaque et le tonus vagal cardiaque dans la recherche psychophysiologique – recommandations pour la planification des expériences, l’analyse des données et le rapport des données. Front. Psychol. 8:1-18. doi : 10.3389/fpsyg.2017.00213
PubMed Abstract | CrossRef Full Text | Google Scholar
Lees, T., Shad-Kaneez, F., Simpson, A. M., Nassif, N. T., Lin, Y., et Lal, S. (2018). La variabilité de la fréquence cardiaque comme biomarqueur pour prédire l’accident vasculaire cérébral, les complications post-AVC et la fonctionnalité. Biomark. Insights 13:117727191878693. doi : 10.1177/1177271918786931
PubMed Abstract | CrossRef Full Text | Google Scholar
Longin, E., Schaible, T., Lenz, T., et König, S. (2005). Variabilité de la fréquence cardiaque à court terme chez les nouveau-nés en bonne santé : données normatives et observations physiologiques. Early Hum. Dev. 81, 663-671. doi : 10.1016/j.earlhumdev.2005.03.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Lucchini, M., Burtchen, N., Fifer, W., et Signorini, M. (2019). Analyse cardiorespiratoire multiparamétrique chez les nourrissons à terme tardif, à terme précoce et à terme complet à la naissance. Med. Biol. Eng. Comput. 57, 99-106. doi : 10.1007/s11517-018-1866-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Makarov, L., Komoliatova, V., Zevald, S., Schmidt, G., Muller, A., et Serebruany, V. (2010). Dynamique du QT, alternances d’ondes T microvoltaires et variabilité de la fréquence cardiaque pendant la surveillance ambulatoire de 24 heures par électrocardiogramme chez le nouveau-né en bonne santé du premier au quatrième jour de vie. J. Electrocardiol. 43, 8-14. doi : 10.1016/j.jelectrocard.2009.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mehta, S. K., Super, D. M., Connuck, D., Salvator, A., Singer, L., Fradley, L. G., et al. (2002). Heart rate variability in healthy newborn infants. Am. J. Cardiol. 89, 50-53. doi : 10.1016/S0002-9149(01)02162-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mirmiran, M., Maas, Y. G. H., et Ariagno, R. L. (2003). Développement du sommeil fœtal et néonatal et des rythmes circadiens. Sleep Med. Rev. 7, 321-334. doi : 10.1053/smrv.2002.0243
CrossRef Full Text | Google Scholar
Musa, S. M., Adam, I., Hassan, N. G., Rayis, D. A., et Lutfi, M. F. (2017). La variabilité de la fréquence cardiaque maternelle pendant la première étape du travail. Front. Physiol. 8:1-6. doi : 10.3389/fphys.2017.00774
CrossRef Full Text | Google Scholar
Nijhuis, J., Prescht’l, H., et Martin, C. (1982). Existe-t-il des états comportementaux chez le fœtus humain ? Early Hum. Dev. 6, 177-195. doi : 10.1016/0378-3782(82)90106-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, V., Martins, R., Liow, N., Teiserskas, J., Von Rosenberg, W., Adjei, T., et al. (2018). Précision pronostique de l’analyse de la variabilité de la fréquence cardiaque dans l’encéphalopathie néonatale : une revue systématique. Neonatology 115, 59-67. doi : 10.1159/000493002
PubMed Abstract | CrossRef Full Text | Google Scholar
Peebles, D. M., Spencer, J. A. D., Edwards, A. D., Wyatt, J. S., Reynolds, E. O., Cope, M., et al. (1994). Relation entre la fréquence des contractions utérines et la saturation cérébrale en oxygène du fœtus humain étudiée pendant le travail par spectroscopie dans le proche infrarouge. Br. J. Obstet. Gynaecol. 101, 44-48. doi : 10.1111/j.1471-0528.1994.tb13008.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pomeranz, B., Macaulay, R. J., Caudill, M. A., Kutz, I., Adam, D., Gordon, D., et al. (1985). Évaluation de la fonction autonome chez l’homme par l’analyse spectrale de la fréquence cardiaque. Am. J. Physiol. 248, H151-H153. doi : 10.1152/ajpheart.1985.248.1.H151
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes-Lagos, J. J., Echeverría-Arjonilla, J. C., Peña-Castillo, M. Á, García-González, M. T., Ortiz-Pedroza Mdel, R., Pacheco-López, G., et al. (2015). Une comparaison de la variabilité de la fréquence cardiaque chez les femmes au troisième trimestre de la grossesse et pendant le travail à faible risque. Physiol. Behav. 149, 255-261. doi : 10.1016/j.physbeh.2015.05.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Riznyk, L., Fijałkowska, M., et Przesmycki, K. (2005). Effets du thiopental et du propofol sur la variabilité de la fréquence cardiaque pendant l’induction de l’anesthésie générale à base de fentanyl. Pharmacol. Rep. 57, 128-134. doi : 10.1103/PhysRevB.69.052404
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, U., Bode, F., Schmidt, A., Nowack, S., Rudolph, A., Doelcker, E. M., et al. (2018). Jalons de développement du système nerveux autonome révélés via le suivi longitudinal de la variabilité de la fréquence cardiaque fœtale. PLoS One 13:1-13. doi : 10.1371/journal.pone.0200799
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwartz, P. J., Garson, A., Paul, T., Stramba-Badiale, M., Vetter, V. L., Villain, E., et al. (2002). Directives pour l’interprétation de l’électrocardiogramme néonatal : un groupe de travail de la société européenne de cardiologie. Eur. Heart J. 23, 1329-1344. doi : 10.1053/euhj.2002.3274
PubMed Abstract | CrossRef Full Text | Google Scholar
Shaffer, F., et Ginsberg, J. P. (2017). Un aperçu des métriques et des normes de variabilité de la fréquence cardiaque. Front. Public Heal. 5:1-17. doi : 10.3389/fpubh.2017.00258
PubMed Abstract | CrossRef Full Text | Google Scholar
Task Force of the European Society of Cardiology, and the North American Society of Pacing and Electrophysiology. (1996). Variabilité de la fréquence cardiaque – normes de mesure, interprétation physiologique et utilisation clinique. Eur. Heart J. 17, 354-381. doi : 10.1161/01.CIR.93.5.1043
CrossRef Full Text | Google Scholar
Temko, A., Doyle, O., Murray, D., Lightbody, G., Boylan, G., et Marnane, W. (2015). Prédicteur multimodal du résultat neurodéveloppemental chez les nouveau-nés atteints d’encéphalopathie hypoxique-ischémique. Comput. Biol. Med. 63, 169-177. doi : 10.1016/j.compbiomed.2015.05.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Toichi, M., Sugiura, T., Murai, T., et Sengoku, A. (1997). Une nouvelle méthode d’évaluation de la fonction autonome cardiaque et sa comparaison avec l’analyse spectrale et le coefficient de variation de l’intervalle R-R. J. Auton. Nerv. Syst. 62, 79-84. doi : 10.1016/S0165-1838(96)00112-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsuchiya, S., Kanaya, N., Hirata, N., Kurosawa, S., Kamada, N., Edanaga, M., et al. (2006). Effets du thiopental sur l’indice bispectral et la variabilité de la fréquence cardiaque. Eur. J. Anaesthesiol. 23, 454-459. doi : 10.1017/S0265021506000159
PubMed Abstract | CrossRef Full Text | Google Scholar
von Rosenberg, W., Chanwimalueang, T., Adjei, T., Jaffer, U., Goverdovsky, V., et Mandic, D. P. (2017). Résolution des ambiguïtés du rapport LF/HF : Diagrammes de dispersion LF-HF pour la catégorisation du stress mental et physique à partir du VRC. Front. Physiol. 8:360. doi : 10.3389/fphys.2017.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
.