Algemene inleiding
De meesten van ons weten dat gist een zeer nuttig organisme is, vooral met betrekking tot bakken, wijn maken, en brouwen. Maar wat zijn gist en waarom wordt er zoveel onderzoek naar gedaan?

Gisten zijn schimmels
Gisten zijn eencellige micro-organismen die, samen met schimmels en paddestoelen, tot het koninkrijk der schimmels worden gerekend. Gisten zijn evolutionair divers en worden daarom ingedeeld in twee afzonderlijke phyla, Ascomycota of zakschimmels en Basidiomycota of hogere schimmels, die samen het subkoninkrijk Dikarya vormen. Kiemgisten, ook wel “echte gisten” genoemd, behoren tot het phylum Ascomycota en de orde Saccharomycetales. Dergelijke classificaties zijn gebaseerd op kenmerken van de cel, ascospore, en kolonie, evenals cellulaire fysiologie.
Gisten zijn eencellig, maar met cellulaire organisatie vergelijkbaar met hogere organismen
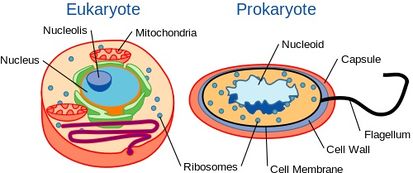
Hoewel gist eencellige organismen zijn, bezitten zij een cellulaire organisatie die vergelijkbaar is met die van hogere organismen, waaronder de mens. Hun genetische inhoud bevindt zich namelijk in een celkern. Dit classificeert hen als eukaryote organismen, in tegenstelling tot hun eencellige tegenhangers, bacteriën, die geen kern hebben en worden beschouwd als prokaryoten.
Natuurlijke habitats
Gisten zijn wijdverspreid in de natuur met een grote verscheidenheid aan habitats. Zij worden algemeen gevonden op plantenbladeren, bloemen, en vruchten, evenals in grond. Gisten worden ook aangetroffen op het huidoppervlak en in het darmkanaal van warmbloedige dieren, waar ze symbiotisch of als parasieten kunnen leven. De gewone “gistinfectie” wordt meestal veroorzaakt door Candida albicans. Candida is niet alleen de veroorzaker van vaginale gistinfecties, maar ook van luieruitslag en spruw in de mond en keel.
Waarom gist bestuderen?
Stelt u zich een organisme voor dat snel groeit in een kolf en waarvan het DNA gemakkelijk kan worden gemanipuleerd, maar dat ook inzicht verschaft in fundamentele menselijke biologische processen, waaronder ziekte. Gist voldoet aan die beschrijving en is het onderwerp van studie voor onderzoekers over de hele wereld, resulterend in meer dan 50.000 gepubliceerde wetenschappelijke artikelen die gistonderzoek beschrijven!

Welke specifieke eigenschappen van gist maken het tot een “modelorganisme” voor studie en de focus van zoveel onderzoek? Gist is een eencellig organisme, waardoor het eenvoudig te bestuderen is, maar het heeft een cellulaire organisatie die vergelijkbaar is met die van hogere, meercellige organismen zoals de mens – dat wil zeggen dat het een kern heeft en dus eukaryoten zijn, zoals hierboven beschreven. Het belangrijkste is dat de overeenkomst in cellulaire organisatie tussen gist en hogere eukaryoten zich vertaalt in overeenkomsten in hun fundamentele cellulaire processen, zodat ontdekkingen in gist vaak directe of indirecte aanwijzingen geven over hoe biologische processen in mensen werken.

Een andere belangrijke eigenschap van gist die essentieel is voor hun rol als “modelorganisme” is het feit dat ze relatief gemakkelijk te bewerken zijn. Gisten vermenigvuldigen zich snel en zijn gemakkelijk genetisch te manipuleren. De verdubbelingstijd van gist (de tijd die een cel nodig heeft om zich te vermenigvuldigen en te delen) bedraagt ongeveer 90 minuten. Menselijke cellen in kweek daarentegen hebben ongeveer 24 uur nodig om te verdubbelen. Er bestaan ook welomschreven genetische methoden voor gist waarmee onderzoekers gemakkelijk mutanten kunnen isoleren, deze met andere mutanten of met andere genetische achtergronden kunnen kruisen, en de locaties van genen in kaart kunnen brengen. Genetische kaarten op basis van de genetische afstand tussen genen gaven onderzoekers voor het eerst een beeld van het genoom en de organisatie ervan, en vormden het hoogtepunt van genetische studies die dateren van de eerste helft van de twintigste eeuw.
Het ontdekkingsproces werd versneld nadat in 1996 het genoom van bakkersgist (S. cerevisiae), dat de volledige set genetisch materiaal bevat, als eerste eukaryotisch genoom werd gesequeneerd. Het is kleiner en compacter dan het menselijke genoom (12 miljoen basenparen en ~6.000 genen, vergeleken met 3 miljard basenparen en ~20-25.000 eiwitcoderende genen). Toch blijkt uit vergelijkingen van de genomen dat ~31% van de gistgenen sterk lijkt op menselijke genen en dat 20% van de menselijke ziektegenen een tegenhanger in gist heeft. Bovendien kunnen gistcellen bestaan als haploïden (één set chromosomen) of diploïden (twee sets chromosomen). Aangezien haploïden slechts één kopie van elk gen hebben en DNA-strengen efficiënt worden gebroken en weer samengevoegd (recombinatie), is het heel gemakkelijk om een specifiek gen in een haploïde te verwijderen en de effecten op de cel, of het “fenotype” van de verwijderingsmutant, waar te nemen. Diploïde cellen daarentegen maken het mogelijk essentiële genen (die welke nodig zijn voor groei en levensvatbaarheid) te bestuderen door één kopie van het gen te deleten en subtiele veranderingen aan te brengen in de andere kopie. Tenslotte is met de informatie uit de genoomsequentie een uitgebreide gereedschapskist van moleculaire reagentia en genoombrede verzamelingen aangelegd, waardoor onderzoekers over krachtige middelen beschikken om biologische problemen te bestuderen. Als van een gistgen bekend is dat het qua DNA-sequentie lijkt op een menselijk gen, kunnen studies in gist krachtige aanwijzingen geven over de rol van het (de) verwante gen(en) in de mens. De relatieve eenvoud van het bestuderen van celfuncties in gist, gecombineerd met de relevantie voor hogere organismen, maakt het tot een zeer krachtig “modelorganisme” voor studie.
Gistleven en celcycli
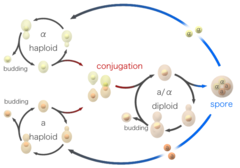
Gisten groeien gewoonlijk ongeslachtelijk door knopvorming. Een kleine knop die de dochtercel zal worden, wordt gevormd op de oudercel (moedercel), en wordt groter naarmate de cel blijft groeien. Terwijl de dochtercel groeit, vermenigvuldigt de moedercel zich en scheidt vervolgens haar DNA. De kern deelt zich en migreert in de dochtercel. Zodra de kiem een kern bevat en een bepaalde grootte heeft bereikt, scheidt hij zich af van de moedercel. De reeks gebeurtenissen die in een cel plaatsvinden en leiden tot verdubbeling en deling worden de celcyclus genoemd. De celcyclus bestaat uit vier verschillende fasen (G1, S, G2 en M) en wordt op soortgelijke wijze gereguleerd als de celcyclus bij grotere eukaryoten. Zolang er voldoende voedingsstoffen zoals suiker, stikstof en fosfaat aanwezig zijn, zullen gistcellen zich ongeslachtelijk blijven delen.
Gistcellen kunnen zich ook geslachtelijk voortplanten. Gistcellen bestaan als een van de twee verschillende paringstypen, a-cellen en alfacellen. Wanneer cellen van tegengestelde paringstypen in het laboratorium met elkaar worden gemengd of in de natuur willekeurig met elkaar in contact komen, kunnen ze paren (conjugeren). Alvorens te paren veranderen de cellen van vorm in een proces dat shmooing wordt genoemd. De term “shmoo” is bedacht omdat de vorm ervan lijkt op die van een fictief stripfiguur met dezelfde naam die eind jaren 40 door Al Capp werd bedacht en voor het eerst verscheen in zijn stripverhaal L’il Abner. Tijdens de conjugatie versmelten de haploïde cellen eerst en vervolgens versmelten hun kernen, wat resulteert in de vorming van een diploïde cel met twee exemplaren van elk chromosoom. Eenmaal gevormd, kunnen diploïde cellen zich ongeslachtelijk voortplanten door knopvorming, vergelijkbaar met haploïden. Wanneer diploïde cellen echter een tekort aan voedingsstoffen hebben, ondergaan zij sporulatie. Tijdens de sporulatie ondergaan diploïde cellen meiose, een speciale vorm van celdeling waarbij het aantal chromosomen van twee exemplaren wordt teruggebracht tot één exemplaar. Na de meiose worden de haploïde kernen die bij de meiose zijn gevormd, verpakt in vier sporen die gewijzigde celwanden bevatten, waardoor structuren ontstaan die zeer goed bestand zijn tegen omgevingsstress. Deze sporen kunnen lange tijd overleven totdat de omstandigheden gunstiger worden, bijvoorbeeld door de aanwezigheid van betere voedingsstoffen, waarna zij kunnen ontkiemen en zich ongeslachtelijk kunnen voortplanten. Deze verschillende toestanden, knopvorming, conjugatie en sporulatie vormen samen de levenscyclus van gist.

Gistgroei en metabolisme
Wanneer gistcellen worden gekweekt in rijke koolstofbronnen zoals glucose, geven zij de voorkeur aan groei door gisting. Tijdens de gisting wordt glucose omgezet in kooldioxide en ethanol. Over het algemeen vindt gisting plaats in afwezigheid van zuurstof, en is dus van nature anaeroob. Zelfs in aanwezigheid van zuurstof geven gistcellen er de voorkeur aan fermentatief te groeien en dit wordt het Crabtree-effect genoemd, naar de bioloog die deze voorkeur ontdekte. Deze vorm van groei wordt benut bij het maken van brood, bier, wijn en andere alcoholische dranken. Hoewel ontluikende gistcellen bij voorkeur groeien door middel van fermentatie, zijn zij bij een tekort aan voedingsstoffen ook in staat te groeien door cellulaire ademhaling. Tijdens de ademhaling zetten de cellen glucose om in kooldioxide en water, waarbij ze zuurstof verbruiken, wat resulteert in de productie van veel grotere hoeveelheden energie in de vorm van ATP.
Historische ontdekkingen

Gist wordt al 1000’en jaren gebruikt als industrieel micro-organisme. De oude Egyptenaren gebruikten gistfermentatie om brood te laten rijzen. Er zijn bewijzen van maalstenen, bakkamers en tekeningen van 4000 jaar oude bakkerijen. Archeologische opgravingen hebben bewijzen aan het licht gebracht in de vorm van kruiken met resten van wijn die 7000 jaar oud is.
Gist werd in 1680 voor het eerst zichtbaar gemaakt door Antoni van Leeuwenhoek met behulp van lenzen van hoge kwaliteit. Hij dacht echter dat deze bolletjes zetmeelhoudende deeltjes waren van het graan dat wordt gebruikt om wort te maken, het vloeibare extract dat bij het brouwen wordt gebruikt, in plaats van gistcellen die gisten. In 1789 droeg Antoine Lavoisier, een Franse scheikundige, bij tot ons begrip van de chemische basisreacties die nodig zijn om alcohol te produceren uit suikerriet. Door een schatting te maken van de verhouding tussen het uitgangsmateriaal en de producten (ethanol en kooldioxide) na toevoeging van gistpasta, concludeerde hij dat er twee chemische routes werden gebruikt, waarbij tweederde van de suiker werd gereduceerd tot alcohol en éénderde kooldioxide vormde. Destijds dacht men echter dat de gist slechts diende om de reactie op gang te brengen en niet gedurende het gehele proces nodig was.
In 1815 ontwikkelde Joseph-Louis Gay-Lussac, een Franse chemicus, methoden om druivensap in ongegiste toestand te houden en ontdekte hij dat de introductie van ‘ferment’ (dat gist bevat) nodig was om ongegiste wort om te zetten, waarmee hij het belang van gist voor alcoholische gisting aantoonde. In 1835 gebruikte Charles Cagniard de la Tour een sterkere microscoop om aan te tonen dat gist uit één cel bestond en zich vermenigvuldigde door knopvorming. In de jaren 1850 ontdekte Louis Pasteur dat gegiste dranken het resultaat waren van de omzetting van glucose in ethanol door gist en definieerde hij gisting als “ademhaling zonder lucht”. Tegen het einde van de jaren 1800 gebruikte Eduard Buchner celvrije extracten, verkregen door het malen van gistcellen, om zymase op te sporen, de verzameling enzymen die gisting bevorderen of katalyseren, en hiervoor kreeg hij in 1907 de Nobelprijs.
Veel van het pionierswerk op het gebied van gistgenetica werd verricht door Øjvind Winge. Hij ontdekte dat gist afwisselend haploïd en diploïd is en dat gist heterothallisch is, aangezien er twee stammen nodig zijn om haploïd om te zetten in diploïd (conjugatie). Hij en zijn collega Otto Laustsen bedachten technieken om gist te micromanipuleren zodat deze genetisch konden worden onderzocht. Bij deze techniek, die bekend staat als “tetradanalyse”, wordt een fijne naald en een microscoop gebruikt om een structuur te isoleren die ascus wordt genoemd en die de vier sporenproducten of tetrad bevat die het resultaat zijn van de sporulatie van een diploïde. Zodra de ascus geïsoleerd is, worden de sporen in de tetrad uit elkaar gehaald en tot kolonies laten uitgroeien voor genetische analyse. Dit pionierswerk leverde hem de titel “De vader van de gistgenetica” op. Een deel van dit werk werd verder verduidelijkt door Carl Lindegren, die het paringstype-systeem in budding yeast ophelderde, het bestaan van Mat a- en Mat alfacellen aantoonde, methoden ontwikkelde om massale paringen uit te voeren tussen cellen van deze paringstypen en deze kennis gebruikte om de genetica van suikergebruik te bestuderen.
Sinds die tijd hebben vele andere onderzoekers baanbrekend onderzoek verricht met budding yeast. Sommige van deze onderzoekers hebben de Nobelprijs gekregen voor belangrijke ontdekkingen die zij tijdens deze studies hebben gedaan, waaronder: Dr. Leland Hartwell (2001) voor de ontdekking van genen die de celcyclus reguleren (co-winnaar met Paul Nurse en Tim Hunt); Roger Kornberg (2006) voor zijn onderzoek naar de eerste stap van genexpressie, de manier waarop een genen DNA-sequentie wordt gekopieerd naar boodschapper-RNA (mRNA); Drs. Elizabeth Blackburn, Carol Greider en Jack Szostak (2009) voor het ontdekken en ophelderen van de genen en de middelen waarmee cellen de chromosoomuiteinden of telomeren beschermen tegen afbraak; en aan Drs. Randy Schekman, James Rothman en Thomas Südhof (2013) voor onderzoek naar de machinerie die het vesiculaire verkeer regelt. Onlangs kreeg Dr. Yoshinori Ohsumi de prijs voor zijn werk aan autofagie, dat begon met studies in gist.
Commerciële toepassingen

Gist wordt al lang beschouwd als het organisme bij uitstek voor de productie van alcoholische dranken, brood, en een grote verscheidenheid aan industriële producten. Dit is gebaseerd op het gemak waarmee het metabolisme van gist kan worden gemanipuleerd met behulp van genetische technieken, de snelheid waarmee het kan worden opgekweekt tot hoge celopbrengsten (biomassa), het gemak waarmee deze biomassa kan worden gescheiden van producten en de wetenschap dat het algemeen als veilig wordt erkend (GRAS).
De brouwgist S. cerevisiae en andere gistsoorten worden al lang gebruikt om de suikers van rijst, tarwe, gerst en maïs te fermenteren tot alcoholische dranken zoals bier en wijn. Er zijn twee hoofdtypen brouwgist: bovengistende biergist en ondergistende lagerbiergist. Bovengistende gist zoals S. cerevisiae komt tijdens de gisting naar boven en wordt gebruikt voor het brouwen van ales, porters, stouts en witbieren. S. pastorianus daarentegen (vroeger bekend als S. carlsbergensis) is een ondergistende gist die gebruikt wordt om pilsbier te brouwen. Biergisten groeien het best bij lagere temperaturen. Als gevolg daarvan groeien ze langzamer, produceren ze minder schuim aan de oppervlakte en bezinken ze meestal op de bodem van de gistkuip. Pils, Märzen, Bocks, en Amerikaanse moutlikeuren zijn allemaal stijlen van pilsbier. In het moderne brouwen zijn veel van de oorspronkelijke bovengistende stammen gemodificeerd om ondergisters te worden.
Gist produceert wijn door suikers uit druivensap (most) te vergisten tot ethanol. Hoewel de gisting van wijn op gang kan worden gebracht door natuurlijk voorkomende gist die in de wijngaarden aanwezig is, kiezen veel wijnmakerijen ervoor een pure gistcultuur toe te voegen om de gisting te domineren en te controleren. De bubbels in champagne en mousserende wijn worden geproduceerd door een tweede gisting, meestal in de fles, die het koolzuurgas vasthoudt. Kooldioxide dat bij de wijnproductie ontstaat, komt als bijproduct vrij. Eén gistcel kan per uur ongeveer zijn eigen gewicht aan glucose vergisten. Onder optimale omstandigheden kan S. cerevisiae tot 18 volumeprocent ethanol produceren, waarbij 15 – 16% de norm is. Het zwaveldioxide dat in commercieel geproduceerde wijn aanwezig is, wordt toegevoegd net nadat de druiven gekneusd zijn om de natuurlijk aanwezige bacteriën, schimmels en gisten te doden.

Saccharomyces cerevisiae of bakkersgist wordt al lang gebruikt als rijsmiddel bij het bakken. Bakkersgist fermenteert de suikers in het deeg, waarbij kooldioxide en ethanol worden geproduceerd. De kooldioxide wordt opgesloten in kleine belletjes in het deeg, waardoor het deeg rijst. Zuurdesembrood is een uitzondering, omdat het niet met bakkersgist wordt gemaakt, maar met een combinatie van wilde gist en bacteriën. De gist Candida milleri wordt gebruikt om de gluten te versterken, en een zuurproducerende bacterie “Lactobacillus sanfranciscensis”, wordt gebruikt om de maltose te fermenteren.
Naast deze traditionele toepassingen wordt gist ook voor tal van andere commerciële toepassingen gebruikt. Veganisten gebruiken gist vaak als kaasvervanger en het wordt vaak gebruikt als topping voor producten zoals popcorn. Het wordt gebruikt in de petrochemische industrie, waar het is ontwikkeld voor de productie van biobrandstoffen zoals ethanol en farneseen, een precursor van diesel en vliegtuigbrandstof. Het wordt ook gebruikt bij de productie van smeermiddelen en detergenten. Gist wordt in de levensmiddelenindustrie gebruikt voor de productie van levensmiddelenadditieven, waaronder kleurstoffen, antioxidanten en smaakversterkers. Het wordt vaak gebruikt bij de productie van farmaceutische producten, waaronder antiparasitaire middelen, antikankerverbindingen, biofarmaceutische producten zoals insuline, vaccins en nutraceutische middelen. Gist wordt vaak gebruikt bij de productie van industriële enzymen en chemicaliën. Op het gebied van bioremediëring van het milieu zijn stammen zelfs geëxploiteerd voor de verwijdering van metalen uit mijnafval.
Toepassing op menselijke ziekten en onderzoek

Omwille van de hoge mate van gelijkenis tussen gistgenen en hun menselijke tegenhangers, en geconserveerde fundamentele cellulaire biologie, is gist een populair modelsysteem geworden voor de studie van menselijke ziektegenen. Verschillende benaderingen zijn gebruikt om meer te weten te komen over menselijke genen zodra een verband tussen een menselijk gen en een gistgen is gelegd. Bij één benadering wordt, nadat een menselijk ziektegen is ontdekt, de sequentie vergeleken met de sequentie van alle genen in het gistgenoom om het (de) meest vergelijkbare gistgen(en) te identificeren. Om te bestuderen of de genen functioneel verwant zijn, wordt het menselijke gen vervolgens tot expressie gebracht in een gistvlek waarbij het gistgen eerst door mutatie is geïnactiveerd. Dit stelt onderzoekers in staat te bepalen of het menselijke gen al dan niet in staat is levensvatbaarheid, groei, of meer specifieke defecten geassocieerd met het verlies van het gistgen te redden, een methode die functionele complementatie wordt genoemd. Als de paden en/of processen waarbij een gistgen betrokken is geconserveerd zijn, kan veel geleerd worden over de functie van het menselijke gen op basis van wat al bekend is over het verwante gistgen. Zodra functionele complementatie is vastgesteld, kunnen onderzoekers dit systeem gebruiken om de functie van het verwante menselijke genproduct verder te karakteriseren. Minder gerichte benaderingen die vaak gebruik maken van high-throughput (HTP) technieken om willekeurig duizenden menselijke genen in één keer te screenen om gen of genen met complementaire activiteit te identificeren. Dergelijke benaderingen zijn met succes gebruikt om geconserveerde celcyclusregulatoren (CDC2), genen betrokken bij kanker en genen betrokken bij neurodegeneratieve ziekten te identificeren.
Er zijn veel scenario’s waarin studies waardevolle informatie kunnen opleveren voor onderzoekers over de cellulaire routes en/of processen waarbij een menselijk gen betrokken is wanneer een gerelateerd gistgen niet aanwezig is. Sommige neurodegeneratieve ziekten zoals Alzheimer en Parkinson doen zich bijvoorbeeld voor wanneer eiwitaggregaten, amyloïde genaamd, zich ophopen als gevolg van verkeerde eiwitvouwing en dit is giftig voor neuronen. Het bestuderen van verkeerd gevouwen eiwitten uit gist met een vergelijkbaar amyloïdvormend vermogen, prionen genaamd, heeft onderzoekers inzicht verschaft in deze neurodegeneratieve ziekten. Een andere mogelijkheid is dat een verhoogde expressie van een ziekte-geassocieerd gen in gist tot een fenotype leidt. Zo is alfa-synucleïne, een gen dat in verband wordt gebracht met de ziekte van Parkinson, toxisch wanneer het op een voldoende hoog niveau tot expressie wordt gebracht. Een dergelijke stam kan dan worden gebruikt om te zoeken naar gistgenen of kleine moleculen die de synucleïne-geïnduceerde toxiciteit onderdrukken of versterken, hetgeen vaak aanwijzingen oplevert over de relevante cellulaire routes. Patiënten met Amyotrofische Laterale Sclerose (ALS) of de ziekte van Lou Gehrig hebben vaak mutaties in een aantal RNA-bindende eiwitten, waardoor zij geneigd zijn aggregaten te vormen die interfereren met het RNA-metabolisme. Een screening in gist is met succes gebruikt om een aantal gistgenen met soortgelijke eigenschappen (vorming van toxische aggregaten) te identificeren, waardoor onderzoekers nieuwe kandidaat-genen hebben om te bestuderen. Omgekeerd vormen de menselijke RNA-bindende proteïnen toxische aggregaten wanneer zij in gist tot expressie worden gebracht en deze stam werd gebruikt om een gistgen te identificeren dat, wanneer gemuteerd, de productie van deze aggregaten blokkeert.
Gist wordt steeds meer het favoriete organisme bij studies die gericht zijn op de identificatie van aangrijpingspunten voor geneesmiddelen en het werkingsmechanisme van diverse geneesmiddelen. Chemogenomics of chemische-genomica verwijst naar de screenings waarbij een combinatie van chemicaliën en genomica wordt gebruikt om drug targets te onderzoeken en mogelijk nieuwe geneesmiddelen te identificeren. Bij deze chemisch-genomische studies zijn twee belangrijke benaderingen gebruikt. Bij de eerste wordt een genoombrede verzameling diploïde stammen geconstrueerd waarbij één van de twee identieke kopieën van een gen wordt verwijderd, waardoor de niveaus van een bepaald genproduct worden verlaagd. Doelgenen en genen die betrokken zijn bij de doelroute worden gevoeliger voor de verbinding en worden bij voorkeur geïdentificeerd in dit soort screening. Bij een tweede benadering worden niet-essentiële genen systematisch geschrapt en wordt de collectie gescreend met een geneesmiddel om te zoeken naar genen die de doelwitroute van het geneesmiddel bufferen. Verwacht wordt dat bij deze aanpak genen worden geïdentificeerd die nodig zijn voor groei in aanwezigheid van het geneesmiddel. Aanvullende benaderingen waarbij gebruik wordt gemaakt van overexpressiescreens zijn gebruikt om genen te identificeren die betrokken zijn bij resistentie tegen geneesmiddelen, met inbegrip van het potentiële doelwit van het geneesmiddel. Het vergelijken van het expressieprofiel van gistcellen waarin een gen is verwijderd, met dat van wilde gistcellen die met een bepaald geneesmiddel zijn behandeld, kan ook een effectieve manier zijn om genen te identificeren die de onderzoekers iets kunnen vertellen over de werking van het geneesmiddel in de cellen.
Dit zijn slechts enkele voorbeelden van de manier waarop gist kan worden gebruikt bij het bestuderen van ziekten bij de mens. Studies in gist kunnen onderzoekers helpen meer te leren over de onderliggende biologie met behulp van dit modelsysteem, of om hen te helpen bij het identificeren van drug targets of het werkingsmechanisme van geneesmiddelen.
Bronnen
- Saccharomyces Genome Database (SGD) biedt uitgebreide geïntegreerde biologische informatie voor de ontluikende gist Saccharomyces cerevisiae, samen met zoek- en analyse-instrumenten om deze gegevens te verkennen.
- MIPS Comprehensive Yeast Genome Database (CYPD) bevat informatie over de moleculaire structuur en het functionele netwerk van de volledig gesequenteerde, goed bestudeerde modeleukaryoot Saccharomyces cerevisiae.
- Candida Genome Database (CGD), een bron van genomische sequentiegegevens en gen- en eiwitinformatie voor Candida albicans.
- PomBase, een uitgebreide databank voor de splijtgist Schizosaccharomyces pombe, die structurele en functionele annotatie, literatuur curatie en toegang tot grootschalige datasets biedt.
- Fungal genome resources at NCBI, een gids voor fungal genome resources bij het National Center for Biotechnology Information (NCBI).
- Een uitgebreide lijst van gist-gerelateerde bronnen over onderwerpen variërend van algemene informatie over gist tot nucleïnezuren, genomen en eiwitten, expressiegegevens, lokalisatie, fenotypen en meer.
Suggested Reading
Books
- YeastBook. (2011) Een uitgebreid overzichtswerk dat de huidige stand van de kennis van de moleculaire biologie, cellulaire biologie en genetica van de gist Saccharomyces cerevisiae weergeeft, Genetics
- From a to alpha: Gist als model voor cellulaire differentiatie. (2007) Hiten D. Madhani, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Landmark Papers in Yeast Biology. (2006), edited by Patrick Linder, David Shore, and Michael N. Hall, Cold Spring Harbor Press, Cold Spring Harbor, New York.
- Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual. (2005) David C. Amberg, Daniel J. Burke, and Jeffrey N. Strathern. Cold Spring Laboratory Press, Cold Spring Harbor, New York.
- The Early Days of Yeast Genetica. (1993) onder redactie van Michael N. Hall en Patrick Linder. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Volume I: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Genoomdynamica, eiwitsynthese en energetica. (1991) onder redactie van James R. Broach, John R. Pringle, en Elizabeth W. Jones. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Volume II: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Genexpressie. (1992) onder redactie van Elizabeth W. Jones, John R. Pringle en James R. Broach. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Volume III: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Celcyclus en celbiologie. (1997) onder redactie van John R. Pringle, James R. Broach en Elizabeth W. Jones. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Yeast: A Practical Approach. (1988) edited by I. Campbell and , and John H. Duffus, IRL Press, Ithaca, New York.
Journal Articles
- Duina A.A., Miller M.E., and J.B. Keeney (2014) Budding Yeast for Budding Geneticists: A Primer on the Saccharomyces cerevisiae Model System. Genetica. 197:33-48.
- Botstein D. and G.R. Fink (2011) Yeast: Een experimenteel organisme voor de biologie van de 21e eeuw. Genetics. 189:695-704.
- Cherry J.M., Hong E.L., Amundsen C., Balakrishnan R., Binkley G., Chan E.T., Christie K.R., Costanzo M.C., Dwight S.S., Engel S.R., Fisk D.G., Hirschman J.E., Hitz B.C., Karra K., Krieger C.J., Miyasato S.R., Nash R.S., Park J., Skrzypek M.S., Simison M., Weng S., and E.D. Wong (2011) Saccharomyces Genome Database: the genomics resource of budding yeast. Nucleic Acids Res. 40:D700-D705.
- Altman T.J., Boone C., Churchill G.A., Hengartner M.O., Mackay T.F., and D.L. Stemple (2011) The future of model organisms in human disease research. Nat. Rev. Genet. 18:575-582.
- Ho C.H., Piotrowski J., Dixon S.J., Baryshnikova A., Costanzo M., and C. Boone (2011) Combining functional genomics and chemical biology to identify targets of bioactive compounds. Curr Opin Chem Biol. 15:66-78.
- Smith A.M., Ammar R., Nislow C., and G. Giaever (2010) A survey of yeast genomic assays for drug and target discovery. Pharmacol Ther. 127:156-164.
- Dolinski K., and D. Botstein (2007) Orthology and functional conservation in eukaryotes. Annu. Rev. Genet. 41:465-507.
- Barnett J.A. (2007) A history of research on yeasts 10: foundations of yeast genetics. Yeast 24:799-845.
- Spradling A., Ganetsky B., Hieter P., Johnston M., Olson M., Orr-Weaver T., Rossant J., Sanchez A., and R. Waterston (2006) New roles for model genetic organisms in understanding and treating human disease: report from the 2006 Genetics Society of America meeting. Genetics 172:2025-2032.
- Sherman F. (2002) Getting started with yeast Methods Enzymol. 350:3-41.