Libertação hormonalEditar
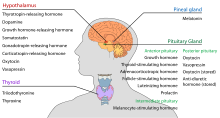
O hipotálamo tem uma função neuroendócrina central, principalmente por seu controle da hipófise anterior, que por sua vez regula várias glândulas endócrinas e órgãos. Os hormônios liberadores (também chamados fatores liberadores) são produzidos em núcleos hipotalâmicos e transportados ao longo dos axônios até a eminência mediana ou a hipófise posterior, onde são armazenados e liberados conforme necessário.
Hipófise anterior
No eixo hipotalâmico-adenotifisário, os hormônios liberadores, também conhecidos como hormônios hipofisiotrópicos ou hipotalâmicos, são liberados da eminência mediana, um prolongamento do hipotálamo, para o sistema portal hipofisário, que os transporta para a hipófise anterior, onde exercem suas funções reguladoras sobre a secreção dos hormônios adenotipofisários. Estes hormônios hipofisiotrópicos são estimulados por células neurosecretoras parvocelulares localizadas na área periventricular do hipotálamo. Após sua liberação nos capilares do terceiro ventrículo, os hormônios hipofisiotrópicos viajam através do que é conhecido como circulação hipotálamo-pituitária portal. Uma vez que chegam ao seu destino na hipófise anterior, estes hormônios se ligam a receptores específicos localizados na superfície das células hipofisárias. Dependendo de quais células são ativadas através desta ligação, a hipófise começará a secretar ou deixará de secretar hormônios no resto da corrente sanguínea.
| Hormônio segregado | Sigla | Produzido por | Efeito |
|---|---|---|---|
| Hormônio liberador de tirotropina (Hormônio liberador de prolactina) |
TRH, TRF, ou PRH | Estimular a libertação de hormona estimulante da tiróide (TSH) da hipófise anterior (principalmente) Estimular a libertação de prolactina da hipófise anterior |
|
| Corticotropina…hormônio liberador | CRH ou CRF | Células neurosecretoras paravocelulares do núcleo paraventricular | Hormônio estimulante adrenocorticotrópico (ACTH) liberação da pituitária anterior |
| Dopamina (Prolactina-hormônio inibidor) |
DA ou PIH | Neurões dopaminérgicos do núcleo arqueado | Inibir a liberação de prolactina da pituitária anterior |
| Crescimento-hormona libertadora de hormonas | GHRH | Neurónios neuroendócrinos do núcleo Arcuate | Estimular o crescimento-libertação de hormona (GH) da hipófise anterior |
| Hormona libertadora de gonadotropina | GnRH ou LHRH | Células neuroendócrinas da área pré-óptica | Estimular o folículo…liberação de hormônio estimulante (FSH) da hipófise anterior Hormônio luteinizante estimulante (LH) liberação da hipófise anterior |
| Somatostatina (hormônio inibidor do crescimento-hormônio) |
SS, GHIH, ou SRIF | Células neuroendócrinas do núcleo periventricular | Inibir a libertação de hormonas de crescimento (GH) da hipófise anterior Inibir (moderadamente) a libertação de hormonas estimulantes da tiróide (TSH) da hipófise anterior |
Outros hormonas segregados da eminência mediana incluem a vasopressina, oxitocina, e neurotensina.
Hipófise posterior
No eixo hipotálamo-neurohipofisário, os hormônios neurohipofisários são liberados da hipófise posterior, que é na verdade um prolongamento do hipotálamo, para a circulação.
| Hormônio decretado | Sigla | Produzido por | Efeito |
|---|---|---|---|
| Oxitocina | OXY ou OXT | Células neurosecretoras magnocelulares do núcleo paraventricular e supraópticas núcleo | Contracção uterina Lactação (reflexo de desaparecimento) |
| Vasopressina (hormona antidiurética) |
ADH ou AVP | Células magnocelulares e parvocelulares neurosecretoras do núcleo paraventricular, células magnocelulares no núcleo supra-óptico | Incremento da permeabilidade à água das células do túbulo distal e do ducto colector no rim e assim permite a reabsorção da água e a excreção da urina concentrada |
É também conhecido que as hormonas hipotalâmico-hipófise-adrenal (HPA) estão relacionadas com certas doenças de pele e homeostase cutânea. Há evidências ligando a hiperatividade dos hormônios HPA a doenças de pele relacionadas ao estresse e tumores cutâneos.
EstimulaçãoEditar
O hipotálamo coordena muitos ritmos circadianos hormonais e comportamentais, padrões complexos de saídas neuroendócrinas, mecanismos homeostáticos complexos, e comportamentos importantes. O hipotálamo deve, portanto, responder a muitos sinais diferentes, alguns dos quais são gerados externamente e outros internamente. Os sinais de ondas delta que surgem no tálamo ou no córtex influenciam a secreção de hormônios liberadores; GHRH e prolactina são estimulados enquanto o TRH é inibido.
O hipotálamo é responsivo a:
- Luz: duração do dia e fotoperíodo para regular ritmos circadianos e sazonais
- Estímulos olfactivos, incluindo feromonas
- Esteróides, incluindo esteróides gónadas e corticosteróides
- Informações transmitidas por via oral, em particular do coração, do sistema nervoso entérico (do tracto gastrointestinal), e do tracto reprodutivo.
- Informações autónomas
- Estímulos de transmissão oral, incluindo leptina, ghrelin, angiotensina, insulina, hormonas pituitárias, citocinas, concentrações plasmáticas de glicose e osmolaridade, etc.
- Stress
- Invading microorganisms by increasing body temperature, resetting the body’s thermostat up.
Olfactory stimuliEdit
Olfactory stimuli are important for sexual reproduction and neuroendocrine function in many species. Por exemplo, se um rato grávido é exposto à urina de um macho ‘estranho’ durante um período crítico após o coito, então a gravidez falha (o efeito Bruce). Assim, durante o coito, uma ratazana fêmea forma uma “memória olfativa” precisa do seu parceiro que persiste durante vários dias. Os sinais feromonais ajudam a sincronizar o cio em muitas espécies; nas mulheres, a menstruação sincronizada também pode surgir de sinais feromonais, embora o papel das feromonas no ser humano seja disputado.
Estímulos transmitidos pelo sangueEditar
Hormônios peptídeos têm importantes influências sobre o hipotálamo, e para isso devem passar pela barreira hematoencefálica. O hipotálamo é limitado em parte por regiões especializadas do cérebro que não possuem uma barreira hematoencefálica efetiva; o endotélio capilar nesses locais é fenestrado para permitir a passagem livre até mesmo de grandes proteínas e outras moléculas. Alguns desses locais são os locais de neurosecreção – a neuro-hipófise e a eminência mediana. No entanto, outros são locais em que o cérebro colhe amostras da composição do sangue. Dois desses locais, o OVLT (órgão subfornical) e o OVLT (organum vasculosum da lâmina terminal) são os chamados órgãos circunventriculares, onde os neurônios estão em contato íntimo tanto com o sangue quanto com o LCR. Essas estruturas são densamente vascularizadas e contêm neurônios osmoreceptivos e receptores de sódio que controlam o consumo de álcool, a liberação de vasopressina, a excreção de sódio e o apetite por sódio. Eles também contêm neurônios com receptores para angiotensina, fator natriurético atrial, endotelina e relaxina, cada qual importante na regulação do equilíbrio de fluidos e eletrólitos. Neurônios no projeto OVLT e OVSF projetam para o núcleo supraóptico e paraventricular, e também para áreas hipotalâmicas pré-ópticas. Os órgãos circunventriculares também podem ser o local de ação das interleucinas para provocar febre e secreção do ACTH, via efeitos sobre os neurônios paraventriculares.
Não está claro como todos os peptídeos que influenciam a atividade hipotalâmica ganham o acesso necessário. No caso da prolactina e leptina, há evidência de captação ativa no plexo coróide do sangue para o líquido cefalorraquidiano (LCR). Alguns hormônios hipofisários têm uma influência negativa na secreção hipotalâmica; por exemplo, o hormônio de crescimento se alimenta do hipotálamo, mas como ele entra no cérebro não é claro. Há também evidências de ações centrais de prolactina.
Os achados sugerem que o hormônio tiroidiano (T4) é absorvido pelas células glial hipotalâmicas no núcleo infundibular/eminência mediana, e que ele é aqui convertido em T3 pela deiodinase tipo 2 (D2). Em seguida, T3 é transportado para o hormônio libertador de tirotropina (TRH) – neurônios produtores no núcleo paraventricular. Foram encontrados receptores de hormônio tiroidiano nesses neurônios, indicando que eles são de fato sensíveis a estímulos T3. Além disso, esses neurônios expressaram MCT8, um transportador do hormônio tireoidiano, apoiando a teoria de que o T3 é transportado para dentro deles. O T3 poderia então ligar-se ao receptor do hormônio tiroidiano nesses neurônios e afetar a produção do hormônio liberador de tirotropina, regulando assim a produção do hormônio tiroidiano.
O hipotálamo funciona como um tipo de termostato para o corpo. Ele define uma temperatura corporal desejada, e estimula a produção e retenção de calor para elevar a temperatura do sangue a uma temperatura mais alta ou o suor e vasodilatação para resfriar o sangue a uma temperatura mais baixa. Todas as febres resultam de um ajuste elevado no hipotálamo; temperaturas corporais elevadas devido a qualquer outra causa são classificadas como hipertermia. Raramente, danos diretos no hipotálamo, como por exemplo, de um derrame, causarão febre; isto é às vezes chamado de febre hipotalâmica. Entretanto, é mais comum que tais danos causem temperaturas corporais anormalmente baixas.
EsteróidesEditar
O hipotálamo contém neurônios que reagem fortemente aos esteróides e glicocorticóides – (os hormônios esteróides da glândula adrenal, liberados em resposta ao ACTH). Também contém neurônios sensíveis ao glucose-sensitive (no núcleo arcuate e no hipotálamo ventromedial), que são importantes para o apetite. A área pré-óptica contém neurônios termossensíveis; estes são importantes para a secreção de TRH.
NeuralEdit
A secreção de oxitocina em resposta ao estímulo vagino-cervical é mediada por algumas dessas vias; a secreção de vasopressina em resposta a estímulos cardiovasculares decorrentes de quimiorreceptores no corpo carotídeo e arco aórtico, e de receptores de volume atrial de baixa pressão, é mediada por outros. No rato, a estimulação da vagina também causa secreção de prolactina, o que resulta em pseudo-pregnação após um acasalamento estéril. No coelho, o coito elicita a ovulação reflexa. Nas ovelhas, a estimulação cervical na presença de altos níveis de estrogênio pode induzir o comportamento materno em uma ovelha virgem. Estes efeitos são todos mediados pelo hipotálamo, e a informação é levada principalmente pelas vias espinhais que se transmitem no tronco encefálico. A estimulação dos mamilos estimula a liberação de oxitocina e prolactina e suprime a liberação de LH e FSH.
Estímulos cardiovasculares são transportados pelo nervo vago. O nervo vago também transmite uma variedade de informações viscerais, incluindo, por exemplo, sinais decorrentes da distensão gástrica ou esvaziamento, para suprimir ou promover a alimentação, sinalizando a liberação de leptina ou gastrina, respectivamente. Novamente esta informação atinge o hipotálamo através de relés no tronco cerebral.
Além disso, a função hipotalâmica é responsiva a – e regulada por níveis de todos os três neurotransmissores clássicos da monoamina, noradrenalina, dopamina e serotonina (5-hidroxitriptamina), naquelas vias das quais recebe inervação. Por exemplo, as entradas noradrenérgicas decorrentes do locus coeruleus têm importantes efeitos reguladores sobre os níveis de hormônio liberador de corticotropina (CRH).
Controlo da ingestão de alimentosEditar
| Peptídeos que aumentam alimentação comportamento |
Peptídeos que diminuem comportamento alimentar |
|
|---|---|---|
| Ghrelin | Leptídeo | |
| Neuropeptídeo Y | (α,β,γ)-Hormônios estimulante dos melanócitos | |
| Peptídeo relacionado ao agouti | Peptídeos transcritos de cocaína e anfetamina | |
| Orexinas (A,B) | Hormônio libertador de corticotropina | |
| Hormônio concentrador de melanina | Cholecystokinin | |
| Galanina | Insulina | |
| Glucagon-como peptídeo 1 |
A parte lateral extrema do núcleo ventromedial do hipotálamo é responsável pelo controle da ingestão de alimentos. A estimulação desta área causa o aumento da ingestão de alimentos. A lesão bilateral desta área causa a completa cessação da ingestão de alimentos. As partes mediais do núcleo têm um efeito de controle na parte lateral. A lesão bilateral da parte medial do núcleo ventromedial causa hiperfagia e obesidade do animal. Outras lesões da parte lateral do núcleo ventromedial no mesmo animal produzem cessação completa da ingestão de alimentos.
Existem diferentes hipóteses relacionadas a esta regulação:
- Hipótese lipostática: Esta hipótese sustenta que o tecido adiposo produz um sinal humoral que é proporcional à quantidade de gordura e age no hipotálamo para diminuir a ingestão de alimentos e aumentar a produção de energia. Tem sido evidente que uma leptina hormonal age sobre o hipotálamo para diminuir a ingestão de alimentos e aumentar a produção de energia.
- Hipótese Gutpeptide: hormônios gastrointestinais como Grp, glucagons, CCK e outros afirmam inibir a ingestão de alimentos. Os alimentos que entram no trato gastrointestinal provocam a liberação desses hormônios, que atuam no cérebro para produzir saciedade. O cérebro contém ambos os receptores CCK-A e CCK-B.
- Hipótese Glucostática: A atividade do centro de saciedade nos núcleos ventromediais é provavelmente governada pela utilização de glicose nos neurônios. Tem sido postulado que quando a utilização da glicose é baixa e consequentemente quando a diferença de glicose no sangue arteriovenoso entre eles é baixa, a atividade entre os neurônios diminui. Nessas condições, a atividade do centro de alimentação é descontrolada e o indivíduo sente fome. O consumo alimentar é rapidamente aumentado pela administração intraventricular de 2-deoxiglicose, diminuindo assim a utilização de glicose nas células.
- Hipótese termostática: De acordo com esta hipótese, uma diminuição da temperatura corporal abaixo de um determinado set-point estimula o apetite, enquanto que um aumento acima do set-point inibe o apetite.
Processamento do medoEditar
A zona medial do hipotálamo faz parte de um circuito que controla os comportamentos motivados, como os comportamentos defensivos. Análises de Fos-labeling mostraram que uma série de núcleos na “coluna de controle comportamental” é importante para regular a expressão de comportamentos defensivos inatos e condicionados.
Comportamento defensivo antipredatório
Exposição a um predador (como um gato) elicita comportamentos defensivos em roedores de laboratório, mesmo quando o animal nunca foi exposto a um gato. No hipotálamo, esta exposição causa um aumento das células rotuladas de Fos no núcleo hipotalâmico anterior, na parte dorsomedial do núcleo ventromedial e na parte ventrolateral do núcleo pré-mamilar (PMDvl). O núcleo pré-mamilar tem um papel importante na expressão de comportamentos defensivos para com um predador, uma vez que as lesões neste núcleo abolem comportamentos defensivos, como o congelamento e o voo. O PMDvl não modula o comportamento defensivo em outras situações, uma vez que as lesões deste núcleo tiveram efeitos mínimos nos escores de congelamento pós-choque. O PMD tem ligações importantes com o periaqueduto dorsal cinza, uma estrutura importante na expressão do medo. Além disso, os animais apresentam comportamentos de avaliação de risco para o ambiente previamente associado ao gato. A análise de células marcadas com Fos mostrou que o PMDvl é a estrutura mais ativada no hipotálamo, e a inativação com muscimol antes da exposição ao contexto abole o comportamento defensivo. Portanto, o hipotálamo, principalmente o PMDvl, tem um papel importante na expressão de comportamentos defensivos inatos e condicionados a um predador.
Derrota social
Likewise, o hipotálamo tem um papel na derrota social: Os núcleos na zona medial também são mobilizados durante um encontro com um conspecífico agressivo. O animal derrotado tem um aumento nos níveis de Fos em estruturas sexualmente dimórficas, tais como o núcleo pré-óptico medial, a parte ventrolateral do núcleo ventromedial, e o núcleo pré-militar ventral. Tais estruturas são importantes em outros comportamentos sociais, tais como os comportamentos sexuais e agressivos. Além disso, o núcleo pré-mamilar também é mobilizado, a parte dorsomedial, mas não a parte ventrolateral. As lesões neste núcleo abolem o comportamento defensivo passivo, como o congelamento e a postura “on-the-back”.