Introduktion
Patienter som läggs in på intensivvårdsavdelningar (ICU) måste ofta få flera läkemedel intravenöst. Vasoaktiva läkemedel, analgetika och sedativa är bland de mest använda terapeutiska grupperna och administreras vanligen i kontinuerlig infusion.
Enligt den systematiska genomgång som utfördes av Moyen et al. finns det i genomsnitt 1,7 fel/dag förknippade med processen för läkemedelsadministration på intensivvårdsavdelningar.1 Å andra sidan är de uppgifter som Merino et al. rapporterade i en studie som genomfördes bland spanska sjukhusens intensivvårdsavdelningar lite bättre (1,13 läkemedelsfel per 100 patienter/dag).2 Trots detta är läkemedelsfel vanliga på intensivvårdsavdelningar och kräver omsorg från vårdpersonalen för att minimera dem.
Fel vid administrering av läkemedel på intensivvårdsavdelningar beror på flera faktorer: användning av högriskläkemedel (vasoaktiva läkemedel, inotropa läkemedel, lugnande medel etc.) som ofta administreras i låga doser på grund av sin höga läkemedelsstyrka, vilket kräver utspädning och en förhandsbedömning innan de administreras. En annan faktor är att doser förskrivs i olika måttenheter eller att ett stort antal läkemedel används för varje patient. Även om det är ett viktigt framsteg när det gäller säkerhet har användningen av intelligenta infusionspumpar förknippats med ett stort antal läkemedelsfel på grund av programmeringsproblem.3
Kombinationen av dessa riskfaktorer ökar risken för att misstag begås hos de mest sårbara patienterna på grund av deras allvarlighetsgrad. Kritiskt sjuka patienter har ofta begränsad venös tillgång. Detta innebär att olika läkemedel levereras via samma administreringsväg, vilket ökar riskerna när inkompatibla läkemedel blandas. Blandning av inkompatibla läkemedel är ett läkemedelsfel som kan få allvarliga konsekvenser för patienten, t.ex. terapeutiska misslyckanden, mikroembolism eller toxicitet.4
För Y-site infusion av 2 läkemedel krävs att båda läkemedlen är fysiskt kompatibla.5 Denna samadministrering sker när läkemedel blandas i förhållandet 1:1 och i avsaknad av synliga tecken på inkompatibilitet, som utfällning eller färgförändring. För säker samadministrering av 2 läkemedel i samma spädningsmedel måste däremot blandningen vara kemiskt stabil. Detta innebär att det behövs en föregående bekräftelse på att ingen betydande förändring har skett i koncentrationen av något av de läkemedel som finns i blandningen.6
Standardisering av koncentrationen av infusionslösningar är en av de mest användbara åtgärderna för att förhindra medicineringsfel på intensivvårdsavdelningen, särskilt när det gäller högriskläkemedel på grund av deras potential att orsaka allvarlig skada och för att de har den högsta incidensen av medicineringsfel.
En annan starkt rekommenderad åtgärd för en säker administrering av läkemedel är att ha tillgång till tillförlitlig information om läkemedelsförenlighet vid administrering av vanliga läkemedel till kritiskt sjuka patienter. Informationen om läkemedelskompatibilitet är dock knapphändig och i många fall svår att tolka på grund av de olika koncentrationer som används, bristen på information om de bedömningsmetoder som används eller källornas tveksamma tekniska kvalitet. Bristen på information om en säker blandning av två läkemedel skapar problem i det dagliga arbetet för sjukskötersketeamen på intensivvårdsavdelningen. Förutom risken för komplikationer i samband med administrering av två inkompatibla molekyler kan bristen på information göra att sjuksköterskan måste leta efter nya venösa accesser för att administrera läkemedlen separat, vilket ökar risken för infektiösa eller tromboemboliska komplikationer.
Syftet med denna genomgång är att samla in den information som har publicerats om den fysikaliska och kemiska kompatibiliteten hos de vanligaste läkemedlen på en intensivvårdsavdelning när de infunderas via en och samma linje via en Y-plats. Dessutom att bedöma kvaliteten på den information som publicerats och generera ett kompatibilitetsschema med tillförlitlig och uppdaterad information för att förbättra säkerheten vid administrering av läkemedel till kritiskt sjuka patienter.
MetodikSökstrategi
En systematisk sökning i databaserna Medline, Stabilis, Handbook on Injectable Drugs och Micromedex genomfördes för att identifiera originalartiklar, översiktsartiklar och metaanalyser om läkemedlens fysikaliska och kemiska kompatibilitet. På grund av deras kliniska tillvägagångssätt och brist på metodik för att fastställa fysisk och kemisk stabilitet valdes fallstudier bort. De översikter som publicerats av Kanji et al. och López-Cabezas et al.5,7 användes som referenspunkt. Sökningen inriktades på läkemedelskombinationer om vilka dessa författare inte hade någon information eller inte hade sökt information. Årtalen för publicering av studierna gick från 1990-talet till december 2017 och de språk som inkluderades var engelska, spanska och franska. Sökstrategin bestod av att använda flera termer som beskriver informationen av intresse för att kombinera dem med den booleska operatören ”OR” följt av att förfina sökningen med hjälp av operatören ”AND”. Termerna som användes var fysisk kompatibilitet, läkemedelsstabilitet, y-site, y-injektion, intravenöst läkemedel samt namn och synonymer för de aktuella läkemedlen.
Läkemedlen som användes i granskningen används rutinmässigt på intensivvårdsavdelningar och administreras ofta genom kontinuerlig infusion. De koncentrationer som används som referens är de som standardiserats i vårt centrum7 för dessa läkemedel och överensstämmer med de koncentrationer som vanligen används på de flesta intensivvårdsavdelningar (tabell 1). All information om kompatibilitet som hittats för en viss molekyl om ett annat koncentrationsintervall visas i tabell 2. Referenssökningsprocessen för varje läkemedel utfördes samtidigt av 2 oberoende forskare.
Studiemediciner och koncentrationer som användes som referens för den bibliografiska sökningen.
| Läkemedel | Standardkoncentration | Läkemedel | Standardkoncentration | |
|---|---|---|---|---|
| Adrenalin | 40mcg/mL | Isoproterenol | 4mcg/mL | |
| Amiodaron | 3.6mg/mL | Ketamin | 50mg/mL | |
| Argatroban | 1mg/mL | Labetalol | 2mg/mL | |
| Bikarbonat | 1mmol/L | Magnesium sulfat | 15mg/mL | |
| Calciumklorid | 10mg/mL | Meropenem | 30mg/mL | |
| Kalciumglukonat | 10mg/mL | Metadon | 0.2mg/mL | |
| Ceftazidim | 24mg/mL | Midazolam | 4mg/mL | |
| Cisatracurium | 2mg/mL | Milrinon | 0.2mg/mL | |
| Clonidin | 7.5mcg/mL | N-acetylcystein | 50mg/mL | |
| Morfinklorid | 1mg/mL | Naloxon | 8mcg/mL | |
| Dexmedetomidin | 4mcg/mL | Nitroglycerin | 0.2mg/mL | |
| Diltiazem | 1mg/mL | Nitroprussid | 0.2mg/mL | |
| Dobutamin | 8mg/mL | Noradrenalin | 0.32mg/mL | |
| Dopamin | 8mg/mL | Pantoprazol | 0.32mg/mL | |
| Esomeprazol | 0.32mg/mL | Piperacillin-tazobaktam | 64mg/mL | |
| Phenylefrin | 0.2mg/mL | Kaliumklorid | 120mEq/L | |
| Fentanyl | 30mcg/mL | Propofol | 10mg/mL | |
| Flumazenil | 40mcg/mL | Remifentanil | 20mcg/mL | |
| Furosemid | 2mg/mL | Somatostatin | 24mcg/mL | |
| Natriumheparin | 50IU/mL | Vecuronium | 0.2mg/mL | |
| Insulin | 1IU/mL | Verapamil | 0.1mg/mL |
Kombinationer av fysikaliskt och kemiskt kompatibla läkemedel med koncentrationer under referensmärket.
| Läkemedel#1 | Maximal kompatibel koncentration | Läkemedel#2 | Maximal kompatibel koncentration |
|---|---|---|---|
| Adrenalin | 32mcg/mL | Pantoprazol | 0.8mg/mL |
| 2mcg/mL | Verapamil | 0.08mg/mL | |
| Amiodaron | 4mg/mL | Phenylefrin | 0.04mg/mL |
| 6mg/mL | Furosemid | 1mg/mL | |
| 15mg/mL | Nitroprussid | 0.3mg/mL | |
| Kalciumklorid | 4mg/mL | Dobutamin | 4mg/mL |
| Calciumglukonat | 4mg/mL | Dobutamin | 4mg/mL |
| Ceftazidim | 120mg/mL | Dobutamin | 1mg/mL |
| 120mg/mL | Dopamin | 0.4mg/mL | |
| 125mg/mL | Ketamin | 10mg/mL | |
| Dobutamin | 1mg/mL | Heparin | 50IU/mL |
| 4mg/mL | Magnesiumsulfat | 40mg/mL | |
| 4mg/mL | Kaliumklorid | 60mEq/L | |
| Dopamin | 3.2mg/mL | Midazolam | 2mg/mL |
| Fentanyl | 12.5mcg/mL | Remifentanil | 0.25mg/mL |
| Heparin | 20IU/mL | Verapamil | 0.08mg/mL |
| Isoproterenol | 4mcg/mL | Magnesiumsulfat | 1mg/mL |
| 200mcg/mL | Kaliumklorid | 40mEq/L | |
| 4mcg/mL | Vecuronium | 0.1mg/mL | |
| 10mcg/mL | Verapamil | 0.08mg/mL | |
| Meropenem | 22mg/mL | Kaliumklorid | 40mEq/L |
| Naloxon | 0.8mcg/mL | Verapamil | 0.08mg/mL |
| Nitroglycerin | 0.1mg/mL | Verapamil | 0.08mg/mL |
| Nitroprussid | 0.2mg/mL | Vecuronium | 0.1mg/mL |
| 0.1mg/mL | Verapamil | 0.08mg/mL | |
| Noradrenalin | 0.008mg/mL | Verapamil | 0.08mg/mL |
| Piperacillin-tazobaktam | 40mg/mL | Dexmedetomidin | 4mcg/mL |
| 40mg/mL | Remifentanil | 250mcg/mL | |
| Kalium klorid | 100mEq/L | Remifentanil | 250mcg/mL |
Det stämmer överens med de grå rutorna som anges som I/C enligt fig. 2.
Studieurval
Efter referenssökningen bedömde två oberoende granskare studiernas kvalitet med hjälp av en peer-review-process. Denna granskning genomfördes enligt kvalitetskriterier baserade på expertutlåtanden och enligt riktlinjer för klinisk praxis8-11:
-
Studiernas reproducerbarhet: beskrivning av aktiv substans och utspädningsmedel, studieförhållanden och metodik.
-
Antal tester som utförts (minst i tre exemplar)
-
Tid som förflutit när proverna togs i stabilitetsanalysen: en provtagningstid på fem gånger rekommenderas, inklusive en provtagningstid på 0,
-
Studier som utförts för att bedöma blandningens stabilitet: (a) Transparens: för synliga partiklar, observation med en matt svart panel, automatisk partikelräkning eller turbidimetri; för osynliga partiklar, användning av optisk mikroskopi, spektrofotometri eller turbidimetri. b) Färgförändring: visuell inspektion eller spektrofotometri. c) Gasbildning: visuell inspektion. d) pH. e) Kemisk stabilitet: mätning av variationen i koncentrationen av de två läkemedlen.
Skapande av resultatdiagram
Ett diagram skapades med alla möjliga kombinationer av de aktuella läkemedlen. Rutorna benämndes med ett ”C” om blandningen var kompatibel, med ett ”I” om den var oförenlig och med ”I/C” om stabiliteten berodde på särskilda förhållanden. Läkemedelskombinationer utan uppgifter om kompatibilitet lämnades utan kryss.
ResultatPrestationer av referenssökningen
Totalt 48 artiklar identifierades. Fig. 1 visar urvalsprocessen. Av de 29 artiklar som ingick i granskningen var 4 skrivna på spanska, 3 på franska och 22 på engelska. När det gäller publiceringsdatum publicerades 8 artiklar mellan 1990 och 1999, 10 mellan 2000 och 2009 och de återstående 11 artiklarna publicerades mellan 2010 och 2017.
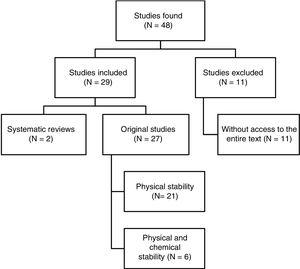
Strukturerad sammanfattning av resultaten av referenssökningen.
Kvalitet på de funna studierna
Ingen av de studerade artiklarna uppfyllde alla de kvalitetskriterier som fastställts i denna granskning. 93 % av artiklarna beskrev dock studiens villkor och metodik tillräckligt detaljerat för att garantera dess reproducerbarhet.
Testerna utfördes i tre exemplar endast i 26 % av fallen. Tvärtom följde 81 % av studierna rekommendationen att ta prover vid tidpunkt 0, även om endast 10 erhöll ett prov vid 5 olika tidpunkter.
När det gäller de försök som utfördes för att bedöma provernas stabilitet bedömde alla studier transparens medan 93 % av studierna rapporterade en färgförändring genom visuell inspektion. Andra metoder användes i 16 studier (59 %) för att se osynliga partiklar. 67 % av studierna bedömde gasbildning och endast 12 mätte pH-förändringar i tid. Endast 6 studier bedömde den kemiska stabiliteten hos blandningarna var högupplöst vätskekromatografi den metod som användes i 5 studier för att mäta koncentrationen av de aktiva ingredienserna i blandningen.
Resultaten på detta avsnitt sammanfattas i tabell 3.
Kursivering av kvalitetskriterierna för de publicerade artiklarna.
| Kvalitetsindikator | Antal studier (%) | ||
|---|---|---|---|
| Bedömning av utfällningsbildning | 27 (100) | 12,13,16-40 | |
| Bedömning av färgförändring | 25 (93) | 12,13,16-27,30-40 | |
| Mätning av pH-ändring | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 | |
| Bedömning av gasbildning | 18 (67) | 12,13,17,19-21,24-26,31,33-40 | |
| Analys utförd i tre exemplar | 7 (26) | 18,21,22,29,34,35,38 | |
| Beskrivning av den metod som använts (inkluderar antal och frekvens av observationer och undersökningsförhållanden) | 24 (89) | 12,13,17-24,26-33,35-40 | |
| Beskrivning av spädningsmedel för alla undersökningsläkemedel | 21 (78) | 13,17-29,33,35-40 | |
| Beskrivning av materialet för undersökningsreceptorerna | 22 (81) | 12,13,17-31,33,36-39 | |
| Kemisk stabilitet | 6 (22) | 16,18,19,22,29,38 |
Resultat av fysikalisk och kemisk kompatibilitet
Fyrtiofyra läkemedel som används vid kontinuerlig perfusion på intensivvårdsavdelningen valdes ut, inklusive en lösning för parenteral näring med och utan lipider och tre beta-laktam antibiotika. Kompatibiliteten mellan dessa visas i figur 2. De uppgifter som erhållits genom de granskningar som utförts av Kanji et al. och López-Cabezas et al. gav kompatibilitetsinformation om 393 av 945 möjliga kombinationer.5,7 Efter att ha slutfört den systematiska granskningen lades nya stabilitetsuppgifter för 82 läkemedelskombinationer till. De nya resultaten visade på 29 kompatibla kombinationer, 27 oförenliga kombinationer och 26 kompatibla kombinationer under specifika förhållanden. Den slutliga tabellen visar därför kompatibilitetsdata för 475 av 945 möjliga kombinationer av två läkemedel (50,3 %). Av dessa är 366 kompatibla (77,1 %), 80 är inkompatibla (16,8 %) och 29 är kompatibla under specifika förhållanden (6,1 %) enligt tabell 2.

Sammanfattning av fysisk och kemisk kompatibilitet. C, kompatibel; I, inkompatibel; I/C, kompatibel under särskilda förhållanden. Streckade rutor visar att blandningen endast är kompatibel med glykosylerat serum. Rutor med diagonala linjer visar att den endast är kompatibel med fysiologiskt serum.
Diskussion
Att se till att läkemedelsanvändningen är säker är ett av de viktigaste åtagandena som vårdgivarna gör gentemot sina patienter. På intensivvårdsavdelningar och med tanke på den enorma mängden intravenöst administrerade läkemedel och patienternas begränsade antal administreringsvägar, äventyras denna säkerhet ibland på grund av de risker som är förknippade med samtidig administrering av inkompatibla läkemedel till särskilt sårbara patienter.
Onlinedatabaser som Stabilis 4.0 är mycket användbara för att leta efter information om läkemedelskompatibilitet. Personalen som administrerar läkemedlen tycker dock att tabeller är mycket mer användbara eftersom de snabbt kan titta på den information de behöver vid en viss tidpunkt. Detta är särskilt intressant i brådskande situationer då eventuella förseningar som orsakas av vårdpersonalen kan få konsekvenser för patienten.
Denna genomgång fokuserade på att analysera den fysikaliska och kemiska kompatibiliteten hos de IV-läkemedel som oftast används genom Y-site infusion på intensivvårdsavdelningen och att sammanfatta den information som erhållits i ett dubbelregistrerat diagram. Studier av fysisk kompatibilitet är de vanligaste av alla eftersom de är lätta att genomföra. Kemiska stabilitetsstudier är dock inte det eftersom de kräver mer sofistikerade analystekniker för att bestämma läkemedlens initiala och slutliga koncentration.
Trots detta är antalet studerade läkemedelskombinationer fortfarande otillräckligt. Som figur 2 visar kunde vi inte hitta någon information om den fysikaliska och kemiska kompatibiliteten för alla föreslagna kombinationer; till exempel när det gäller flumazenil och piperacillin-tazobaktam kunde vi bara bestämma stabiliteten med fyra läkemedel och i båda fallen förblev de 39 återstående kombinationerna utan information.
Även om vi tog hänsyn till alla möjliga kombinationer som föreslagits och lade till de nya uppgifter som hittats, skulle vi fortfarande ha noll information om den fysikaliska och kemiska kompatibiliteten för 470 kombinationer. Detta innebär att vi endast har uppgifter tillgängliga för 50,3 % av alla möjliga kombinationer som föreslagits.
De mest problematiska kombinationerna när det gäller inkompatibilitet är läkemedel vars stabilitet är nära kopplad till pH-intervallet; detta är fallet med natriumbikarbonat, furosemid eller pantoprazol. Furosemid kräver till exempel ett basiskt pH för att garantera molekylens stabilitet i lösning, vilket är anledningen till att blandningen med sura läkemedel (pH
4) orsakar turbiditet och utfällning.12
Närvaron av adjuvans i den farmaceutiska formuleringen, koncentrationen och exponering för extrema temperaturer eller ljusstyrka är andra faktorer som är förknippade med läkemedelsinkompatibilitet.13
Närvaron av adjuvans i den farmaceutiska formuleringen, koncentrationen och exponering för extrema temperaturer eller ljusstyrka är andra faktorer som är förknippade med läkemedelsinkompatibilitet.13 Det finns tillfällen då en viss läkemedelskombination kan vara stabil i en viss spädningsvätska och inkompatibel i en annan; till exempel är dopamin endast kompatibelt med amiodaron när båda löses upp i glykosylerat serum på 5 % eftersom det senare är instabilt i saltlösningar på 0,9 %. Om denna påstådda kompatibla blandning utförs i fysiologiskt serum kan således en koncentrationsförlust av amiodaron uppstå med motsvarande risk för bristande terapeutiskt svar.
Å andra sidan kan kvaliteten på de hittills publicerade studierna i många fall vara bättre. Det skulle vara bra med en större enhetlighet i kvalitetsstandarderna för denna typ av studier. Till exempel, även om pH är en kritisk faktor för stabiliteten hos läkemedel i lösning, verifierades det bara i 12 av de 27 artiklarna. På samma sätt är turbidimetri eller mikroskopi – mer exakta tekniker än visuell observation för att upptäcka partiklar och färgförändringar – underutnyttjade. Under de senaste åren har flera experter publicerat riktlinjer för utformningen av läkemedelsstabilitetsstudier.8-11 Vi kan bara hoppas att detta kommer att förbättra den övergripande kvaliteten på denna typ av studier i framtiden.
Förre författare har publicerat granskningar av dessa egenskaper. Flamein et al.14 studerade till exempel detta problem på neonatala intensivvårdsavdelningar; Knudsen et al.15 belyste kompatibiliteten mellan analgetika och sedativa läkemedel. Vår översikt bygger på tidigare arbete som utförts av Kanji et al.5 i Kanada och López-Cabezas.7 i Spanien. Den har kompletterats med den nya information som finns tillgänglig om läkemedel i vår miljö och uppgifter om de mest använda koncentrationerna av läkemedel.
Totalt hittade vi information om 82 nya läkemedelskombinationer från 27 olika referenser, inklusive kombinationer av 3 beta-laktamantibiotika (ceftazidim, meropenem och piperacillin-tazobactam) som används allmänt på intensivvårdsavdelningar. Under de senaste åren har de farmakokinetiska fördelarna med en förlängd perfusion vid administrering av dessa tre antibiotika bekräftats.16-19
Perfusioner med läkemedelskoncentrationer som överstiger de vanliga används ofta hos kritiskt sjuka patienter. I denna mening kunde vi inte hitta uppgifter om alla läkemedelskombinationer när det gäller de höga koncentrationer som används på intensivvårdsavdelningar (tabell 1); i vissa fall fick vi dock information om lägre koncentrationer än de som rapporteras i denna översikt. Dessa fall visas på kompatibilitetsdiagrammet (fig. 2) som villkorad kompatibilitet (I/C), det vill säga att kombinationen hade studerats vid en annan koncentration än standardkoncentrationen.
Stabilitetsdata som rapporteras i denna översikt kan inte generaliseras till andra läkemedelskombinationer eller koncentrationer som skiljer sig från de beskrivna. Dessutom gäller informationen som tillhandahålls 2 läkemedelskombinationer, och inkompatibiliteter kan förekomma med>2 läkemedelskombinationer åt gången, vilket är högst olämpligt. Trots detta är de läkemedel och koncentrationer som valts ut de mest använda på intensivvårdsavdelningar för vuxna på de flesta sjukhus.
I väntan på nya och bättre kompatibilitetsstudier som belyser denna fråga kan denna översikt vara en lättläst uppdatering av de bevis som finns tillgängliga om kompatibiliteten hos de läkemedel som oftast används på intensivvårdsavdelningar. Målet är att bidra till säker administrering av läkemedel till patienter som kan drabbas av allvarligare konsekvenser på grund av sin skröplighet.
Författarnas bidrag
Genís Castells Lao: studiedesign och idé, datautvinning, analys och tolkning av data; pappersutkast eller kritisk granskning av det intellektuella materialet; och slutligt godkännande av denna version.
Montse Rodríguez Reyes: studiedesign och idé, datautvinning, analys och tolkning av data, pappersutkast eller kritisk granskning av det intellektuella materialet samt slutligt godkännande av denna version.
Judit Roura Turet: datautvinning, analys och tolkning av data, pappersutkast eller kritisk granskning av det intellektuella materialet samt slutligt godkännande av denna version.
Marta Prat Dot: datautvinning, analys och tolkning av data, pappersutkast eller kritisk granskning av det intellektuella materialet och slutligt godkännande av denna version.
Dolors Soy Muner: studiedesign och idé, pappersutkast eller kritisk granskning av det intellektuella materialet och slutligt godkännande av denna version.
Carmen López Cabezas: studiedesign och idé, datautvinning, analys och tolkning av data, pappersutkast eller kritisk granskning av det intellektuella materialet samt slutligt godkännande av denna version.
Intressekonflikter
Författarna förklarade att de inte hade några som helst intressekonflikter.