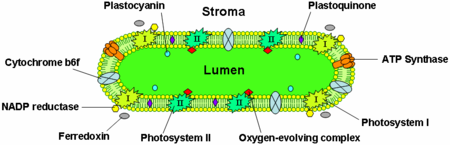
Los tilacoides contienen muchas proteínas integrales y periféricas de la membrana, así como proteínas del lumen. Recientes estudios proteómicos de fracciones de tilacoides han proporcionado más detalles sobre la composición proteica de los tilacoides. Estos datos se han resumido en varias bases de datos de proteínas de los plastos que están disponibles en línea.
Según estos estudios, el proteoma de los tilacoides consta de al menos 335 proteínas diferentes. De ellas, 89 están en el lumen, 116 son proteínas integrales de la membrana, 62 son proteínas periféricas en el lado del estroma y 68 proteínas periféricas en el lado del lumen. Se pueden predecir otras proteínas lumenales de baja abundancia mediante métodos computacionales. De las proteínas del tilacoide con funciones conocidas, el 42% están implicadas en la fotosíntesis. Los siguientes grupos funcionales más grandes incluyen proteínas implicadas en la orientación, el procesamiento y el plegado de proteínas con un 11%, la respuesta al estrés oxidativo (9%) y la traducción (8%).
Proteínas integrales de membranaEditar
Las membranas de los tilacoides contienen proteínas integrales de membrana que desempeñan un papel importante en la recolección de la luz y en las reacciones dependientes de la luz de la fotosíntesis. Hay cuatro complejos proteicos principales en la membrana de los tilacoides:
- Fotosistemas I y II
- Complejo del citocromo b6f
- ATP sintasa
El fotosistema II se localiza principalmente en los tilacoides de la grana, mientras que el fotosistema I y la ATP sintasa se localizan principalmente en los tilacoides del estroma y en las capas externas de la grana. El complejo del citocromo b6f está distribuido uniformemente en las membranas de los tilacoides. Debido a la ubicación separada de los dos fotosistemas en el sistema de membranas de los tilacoides, se requieren portadores de electrones móviles para intercambiar electrones entre ellos. Estos portadores son la plastoquinona y la plastocianina. La plastoquinona transporta electrones del fotosistema II al complejo del citocromo b6f, mientras que la plastocianina transporta electrones del complejo del citocromo b6f al fotosistema I.
Juntos, estas proteínas utilizan la energía de la luz para impulsar las cadenas de transporte de electrones que generan un potencial quimiosmótico a través de la membrana del tilacoide y el NADPH, un producto de la reacción redox terminal. La ATP sintasa utiliza el potencial quimiosmótico para fabricar ATP durante la fotofosforilación.
FotosistemasEditar
Estos fotosistemas son centros redox impulsados por la luz, cada uno de los cuales consiste en un complejo de antenas que utiliza clorofilas y pigmentos fotosintéticos accesorios como carotenoides y ficobiliproteínas para cosechar luz en una variedad de longitudes de onda. Cada complejo de antena tiene entre 250 y 400 moléculas de pigmento y la energía que absorben se traslada por transferencia de energía de resonancia a una clorofila a especializada en el centro de reacción de cada fotosistema. Cuando cualquiera de las dos moléculas de clorofila a del centro de reacción absorbe energía, se excita un electrón y se transfiere a una molécula receptora de electrones. El fotosistema I contiene un par de moléculas de clorofila a, denominadas P700, en su centro de reacción que absorbe al máximo la luz de 700 nm. El fotosistema II contiene clorofila P680 que absorbe mejor la luz de 680 nm (nótese que estas longitudes de onda corresponden al rojo intenso – véase el espectro visible). La P es la abreviatura de pigmento y el número es el pico de absorción específico en nanómetros para las moléculas de clorofila en cada centro de reacción. Este es el pigmento verde presente en las plantas que no es visible a simple vista.
Complejo del citocromo b6fEditar
El complejo del citocromo b6f forma parte de la cadena de transporte de electrones del tilacoide y acopla la transferencia de electrones al bombeo de protones al lumen del tilacoide. Energéticamente, se sitúa entre los dos fotosistemas y transfiere electrones del fotosistema II-plastoquinona al plastocianina-fotosistema I.
ATP sintasaEditar
La ATP sintasa del tilacoide es una CF1FO-ATP sintasa similar a la ATPasa mitocondrial. Está integrada en la membrana del tilacoide con la parte CF1 pegada al estroma. Así, la síntesis de ATP se produce en el lado del estroma de los tilacoides, donde el ATP es necesario para las reacciones independientes de la luz de la fotosíntesis.
Proteínas del lumenEditar
La proteína transportadora de electrones plastocianina está presente en el lumen y transporta electrones desde el complejo proteico citocromo b6f al fotosistema I. Mientras que las plastoquinonas son solubles en lípidos y, por lo tanto, se mueven dentro de la membrana del tilacoide, la plastocianina se mueve a través del lumen del tilacoide.
El lumen de los tilacoides es también el sitio de oxidación del agua por el complejo de evolución del oxígeno asociado con el lado lumen del fotosistema II.
Las proteínas del lumen pueden predecirse computacionalmente basándose en sus señales de orientación. En Arabidopsis, de las proteínas lumenales predichas que poseen la señal Tat, los grupos más grandes con funciones conocidas son el 19% que participan en el procesamiento de proteínas (proteólisis y plegamiento), el 18% en la fotosíntesis, el 11% en el metabolismo y el 7% en los portadores redox y la defensa.
Expresión de proteínasEditar
Los cloroplastos tienen su propio genoma, que codifica una serie de proteínas del tilacoide. Sin embargo, durante el curso de la evolución de los plastos a partir de sus ancestros endosimbióticos cianobacterianos, se produjo una amplia transferencia de genes del genoma del cloroplasto al núcleo celular. El resultado es que los cuatro principales complejos proteicos del tilacoide están codificados en parte por el genoma del cloroplasto y en parte por el genoma nuclear. Las plantas han desarrollado varios mecanismos para co-regular la expresión de las diferentes subunidades codificadas en los dos diferentes orgánulos para asegurar la estequiometría y el ensamblaje adecuados de estos complejos proteicos. Por ejemplo, la transcripción de los genes nucleares que codifican partes del aparato fotosintético está regulada por la luz. La biogénesis, la estabilidad y el recambio de los complejos proteicos del tilacoide están regulados por la fosforilación a través de quinasas sensibles al redox en las membranas del tilacoide. La tasa de traducción de las proteínas codificadas por el cloroplasto está controlada por la presencia o ausencia de socios de ensamblaje (control por epistasia de la síntesis). Este mecanismo implica una retroalimentación negativa a través de la unión del exceso de proteína a la región no traducida 5′ del ARNm del cloroplasto. Los cloroplastos también necesitan equilibrar las proporciones del fotosistema I y II para la cadena de transferencia de electrones. El estado redox del portador de electrones plastoquinona en la membrana del tilacoide afecta directamente a la transcripción de los genes del cloroplasto que codifican las proteínas de los centros de reacción de los fotosistemas, contrarrestando así los desequilibrios en la cadena de transferencia de electrones.
Orientación de proteínas a los tilacoidesEditar
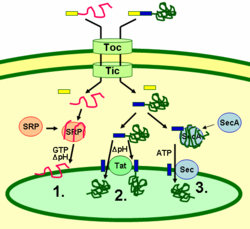
Las proteínas del tilacoide se dirigen a su destino a través de péptidos señal y vías de secreción de tipo procariota dentro del cloroplasto. La mayoría de las proteínas del tilacoide codificadas por el genoma nuclear de una planta necesitan dos señales de orientación para su correcta localización: Un péptido N-terminal de orientación al cloroplasto (mostrado en amarillo en la figura), seguido de un péptido de orientación al tilacoide (mostrado en azul). Las proteínas se importan a través del translocon de los complejos de membrana externa e interna (Toc y Tic). Tras entrar en el cloroplasto, el primer péptido de orientación es escindido por una proteasa que procesa las proteínas importadas. Esto desenmascara la segunda señal de orientación y la proteína se exporta desde el estroma al tilacoide en un segundo paso de orientación. Este segundo paso requiere la acción de los componentes de translocación de proteínas de los tilacoides y depende de la energía. Las proteínas se insertan en la membrana a través de la vía dependiente de SRP (1), de la vía dependiente de Tat (2) o espontáneamente a través de sus dominios transmembrana (no se muestra en la figura). Las proteínas lumenales se exportan a través de la membrana del tilacoide al lumen por la vía dependiente de Tat (2) o por la vía dependiente de Sec (3) y se liberan por escisión de la señal de orientación del tilacoide. Las diferentes vías utilizan diferentes señales y fuentes de energía. La vía Sec (secretoria) requiere ATP como fuente de energía y consta de SecA, que se une a la proteína importada y de un complejo de membrana Sec para transportar la proteína. Las proteínas con un motivo de arginina gemela en su péptido señal del tilacoide se transportan a través de la vía Tat (translocación de arginina gemela), que requiere un complejo Tat unido a la membrana y el gradiente de pH como fuente de energía. Algunas otras proteínas se insertan en la membrana a través de la vía SRP (partícula de reconocimiento de señales). La SRP del cloroplasto puede interactuar con sus proteínas objetivo de forma postraduccional o cotraduccional, transportando así las proteínas importadas así como las que se traducen dentro del cloroplasto. La vía SRP requiere GTP y el gradiente de pH como fuentes de energía. Algunas proteínas transmembrana también pueden insertarse espontáneamente en la membrana desde el lado del estroma sin necesidad de energía.