Einführung
Patienten, die in die Intensivstation aufgenommen werden, benötigen häufig die intravenöse Verabreichung mehrerer Medikamente. Vasoaktive Medikamente, Analgetika und Sedativa gehören zu den am häufigsten verwendeten therapeutischen Gruppen und werden in der Regel als Dauerinfusion verabreicht.
Nach der systematischen Übersichtsarbeit von Moyen et al. gibt es durchschnittlich 1,7 Fehler pro Tag im Zusammenhang mit der Verabreichung von Medikamenten auf der Intensivstation.1 Andererseits sind die von Merino et al. in einer Studie unter spanischen Krankenhaus-Intensivstationen gemeldeten Daten etwas besser (1,13 Medikationsfehler pro 100 Patienten/Tag).2 Dennoch sind Medikationsfehler auf Intensivstationen häufig und erfordern die Aufmerksamkeit der Gesundheitsdienstleister, um sie zu minimieren.
Fehler bei der Verabreichung von Medikamenten auf Intensivstationen sind auf mehrere Faktoren zurückzuführen: die Verwendung von Hochrisikomedikamenten (vasoaktive Medikamente, Inotropika, Beruhigungsmittel usw.), die aufgrund ihrer hohen Wirkstoffstärke häufig in niedrigen Dosen verabreicht werden, was eine Verdünnung und eine vorherige Bewertung ihrer Verabreichung erfordert. Ein weiterer Faktor ist die Verschreibung von Dosen in verschiedenen Maßeinheiten oder die große Anzahl von Medikamenten, die bei jedem Patienten verwendet werden. Obwohl es sich um einen wichtigen Fortschritt im Hinblick auf die Sicherheit handelt, wurde die Verwendung intelligenter Infusionspumpen mit einer großen Anzahl von Medikationsfehlern aufgrund von Programmierproblemen in Verbindung gebracht.3
Die Kombination dieser Risikofaktoren erhöht die Wahrscheinlichkeit von Fehlern bei den am meisten gefährdeten Patienten aufgrund ihrer Schwere. Schwer kranke Patienten haben oft nur begrenzte venöse Zugänge. Das bedeutet, dass verschiedene Medikamente über denselben Verabreichungsweg verabreicht werden, was die Risiken beim Mischen unverträglicher Medikamente erhöht. Die Mischung inkompatibler Medikamente ist ein Medikationsfehler, der schwerwiegende Folgen für den Patienten haben kann, wie z. B. Therapieversagen, Mikroembolien oder Toxizität.4
Die Y-Site-Infusion von zwei Medikamenten setzt voraus, dass beide Medikamente physikalisch kompatibel sind.5 Diese Koadministration ist gegeben, wenn die Medikamente im Verhältnis 1:1 gemischt werden und keine sichtbaren Anzeichen einer Inkompatibilität wie Ausfällungen oder Farbveränderungen auftreten. Für die sichere gleichzeitige Verabreichung von zwei Arzneimitteln in demselben Verdünnungsmittel muss die Mischung hingegen chemisch stabil sein. Das bedeutet, dass vorher bestätigt werden muss, dass sich die Konzentration eines der beiden in der Mischung enthaltenen Medikamente nicht signifikant verändert hat.6
Die Standardisierung der Konzentration von Infusionslösungen ist eine der nützlichsten Maßnahmen zur Vermeidung von Medikationsfehlern auf der Intensivstation, insbesondere bei Hochrisikomedikamenten, da diese schwerwiegende Schäden verursachen können und die Häufigkeit von Medikationsfehlern bei diesen Medikamenten am höchsten ist.
Eine weitere sehr empfehlenswerte Maßnahme für die sichere Verabreichung von Medikamenten ist die Verfügbarkeit zuverlässiger Informationen über die Medikamentenkompatibilität bei der Verabreichung von gängigen Medikamenten an schwerkranke Patienten. Informationen über die Kompatibilität von Arzneimitteln sind jedoch rar und in vielen Fällen schwer zu interpretieren, da unterschiedliche Konzentrationen verwendet werden, keine Informationen über die verwendeten Bewertungsmethoden vorliegen oder die technische Qualität der Quellen fragwürdig ist. Das Fehlen von Informationen über die sichere Mischung von 2 Medikamenten führt zu Problemen bei der täglichen Arbeit der Pflegeteams auf der Intensivstation. Neben dem Risiko von Komplikationen, die mit der Verabreichung von zwei inkompatiblen Molekülen verbunden sind, kann dieser Mangel an Informationen dazu führen, dass das Pflegepersonal nach neuen venösen Zugängen suchen muss, um die Medikamente getrennt zu verabreichen, was das Risiko infektiöser oder thromboembolischer Komplikationen erhöht.
Das Ziel dieser Übersichtsarbeit ist es, die veröffentlichten Informationen über die physikalische und chemische Kompatibilität der am häufigsten auf einer Intensivstation verwendeten Medikamente zu sammeln, wenn sie über dieselbe Leitung über eine Y-Stelle infundiert werden. Außerdem soll die Qualität der veröffentlichten Informationen bewertet und eine Kompatibilitätstabelle mit zuverlässigen und aktuellen Informationen erstellt werden, um die Sicherheit bei der Verabreichung von Arzneimitteln an schwerkranke Patienten zu verbessern.
MethodikSuchstrategie
Eine systematische Suche in den Datenbanken Medline, Stabilis, Handbook on Injectable Drugs und Micromedex wurde durchgeführt, um Originalarbeiten, Übersichtsartikel und Metaanalysen zur physikalischen und chemischen Kompatibilität von Arzneimitteln zu ermitteln. Aufgrund ihres klinischen Ansatzes und der fehlenden Methodik zur Bestimmung der physikalischen und chemischen Stabilität wurden die Fallstudien verworfen. Die von Kanji et al. und López-Cabezas et al.5,7 veröffentlichten Übersichtsarbeiten wurden als Referenz herangezogen. Die Suche konzentrierte sich auf Arzneimittelkombinationen, zu denen diese Autoren keine Informationen hatten oder nicht nach Informationen gesucht hatten. Die Veröffentlichungsjahre der Studien reichten von den 1990er Jahren bis Dezember 2017, und die einbezogenen Sprachen waren Englisch, Spanisch und Französisch. Die Suchstrategie bestand darin, mehrere Begriffe, die die interessierenden Informationen beschreiben, mit dem Booleschen Operator „OR“ zu kombinieren und die Suche anschließend mit dem Operator „AND“ zu verfeinern. Die verwendeten Begriffe waren physikalische Kompatibilität, Medikamentenstabilität, Y-Site, Y-Injektion, intravenöses Medikament sowie die Namen und Synonyme der interessierenden Medikamente.
Die bei der Überprüfung verwendeten Medikamente werden routinemäßig auf der Intensivstation eingesetzt und häufig als Dauerinfusion verabreicht. Die als Referenz verwendeten Konzentrationen sind die in unserem Zentrum7 für diese Medikamente standardisierten Konzentrationen, die mit denen übereinstimmen, die in den meisten Intensivstationen verwendet werden (Tabelle 1). Alle Informationen zur Kompatibilität, die für ein bestimmtes Molekül in einem anderen Konzentrationsintervall gefunden wurden, sind in Tabelle 2 aufgeführt. Die Referenzrecherche für jedes Medikament wurde gleichzeitig von zwei unabhängigen Forschern durchgeführt.
Studienmedikamente und Konzentrationen, die als Referenz für die bibliographische Suche verwendet wurden.
| Droge | Standardkonzentration | Droge | Standardkonzentration |
|---|---|---|---|
| Adrenalin | 40mcg/mL | Isoproterenol | 4mcg/mL |
| Amiodaron | 3.6mg/mL | Ketamin | 50mg/mL |
| Argatroban | 1mg/mL | Labetalol | 2mg/mL |
| Bikarbonat | 1mmol/L | Magnesium Sulfat | 15mg/mL |
| Calciumchlorid | 10mg/mL | Meropenem | 30mg/mL |
| Calciumgluconat | 10mg/mL | Methadon | 0.2mg/mL |
| Ceftazidim | 24mg/mL | Midazolam | 4mg/mL |
| Cisatracurium | 2mg/mL | Milrinon | 0.2mg/mL |
| Clonidin | 7.5mcg/mL | N-Acetylcystein | 50mg/mL |
| Morphinchlorid | 1mg/mL | Naloxon | 8mcg/mL |
| Dexmedetomidin | 4mcg/mL | Nitroglycerin | 0.2mg/mL |
| Diltiazem | 1mg/mL | Nitroprussid | 0.2mg/mL |
| Dobutamin | 8mg/mL | Noradrenalin | 0.32mg/mL |
| Dopamin | 8mg/mL | Pantoprazol | 0.32mg/mL |
| Esomeprazol | 0.32mg/mL | Piperacillin-Tazobactam | 64mg/mL |
| Phenylephrin | 0.2mg/mL | Kaliumchlorid | 120mEq/L |
| Fentanyl | 30mcg/mL | Propofol | 10mg/mL |
| Flumazenil | 40mcg/mL | Remifentanil | 20mcg/mL |
| Furosemid | 2mg/mL | Somatostatin | 24mcg/mL |
| Natriumheparin | 50IU/mL | Vecuronium | 0.2mg/mL |
| Insulin | 1IU/mL | Verapamil | 0,1mg/mL |
Kombinationen von physikalisch und chemisch verträglichen Arzneimitteln mit Konzentrationen unterhalb der Referenzmarke.
| Droge#1 | Maximal verträgliche Konzentration | Droge#2 | Maximal verträgliche Konzentration |
|---|---|---|---|
| Adrenalin | 32mcg/mL | Pantoprazol | 0.8mg/mL |
| 2mcg/mL | Verapamil | 0.08mg/mL | |
| Amiodaron | 4mg/mL | Phenylephrin | 0.04mg/mL |
| 6mg/mL | Furosemid | 1mg/mL | |
| 15mg/mL | Nitroprussid | 0.3mg/mL | |
| Calciumchlorid | 4mg/mL | Dobutamin | 4mg/mL |
| Calciumgluconat | 4mg/mL | Dobutamin | 4mg/mL |
| Ceftazidim | 120mg/mL | Dobutamin | 1mg/mL |
| 120mg/mL | Dopamin | 0.4mg/mL | |
| 125mg/mL | Ketamin | 10mg/mL | |
| Dobutamin | 1mg/mL | Heparin | 50IU/mL |
| 4mg/mL | Magnesiumsulfat | 40mg/mL | |
| 4mg/mL | Kaliumchlorid | 60mEq/L | |
| Dopamin | 3.2mg/mL | Midazolam | 2mg/mL |
| Fentanyl | 12.5mcg/mL | Remifentanil | 0.25mg/mL |
| Heparin | 20IU/mL | Verapamil | 0.08mg/mL |
| Isoproterenol | 4mcg/mL | Magnesiumsulfat | 1mg/mL |
| 200mcg/mL | Kaliumchlorid | 40mEq/L | |
| 4mcg/mL | Vecuronium | 0.1mg/mL | |
| 10mcg/mL | Verapamil | 0.08mg/mL | |
| Meropenem | 22mg/mL | Kaliumchlorid | 40mEq/L |
| Naloxon | 0.8mcg/mL | Verapamil | 0.08mg/mL |
| Nitroglycerin | 0.1mg/mL | Verapamil | 0.08mg/mL |
| Nitroprussid | 0.2mg/mL | Vecuronium | 0.1mg/mL |
| 0.1mg/mL | Verapamil | 0.08mg/mL | |
| Noradrenalin | 0.008mg/mL | Verapamil | 0.08mg/mL |
| Piperacillin-tazobactam | 40mg/mL | Dexmedetomidin | 4mcg/mL |
| 40mg/mL | Remifentanil | 250mcg/mL | |
| Kalium Chlorid | 100mEq/L | Remifentanil | 250mcg/mL |
Es stimmt mit den grauen Kästchen überein, die als I/C wie in Abb. 2.
Studienauswahl
Nach der Referenzrecherche bewerteten 2 unabhängige Gutachter die Qualität der Studien anhand eines Peer-Review-Verfahrens. Diese Überprüfung erfolgte anhand von Qualitätskriterien, die auf der Meinung von Experten beruhen und den Leitlinien für die klinische Praxis8-11 entsprechen:
-
Studienreproduzierbarkeit: Beschreibung von Wirkstoff und Verdünnungsmittel, Studienbedingungen und Methodik.
-
Anzahl der durchgeführten Tests (mindestens in dreifacher Ausfertigung).
-
Zeitaufwand für die Probenahme bei der Stabilitätsanalyse: empfohlen wird ein 5-facher Probenahmezeitraum einschließlich einer Probenahmezeit von 0,
-
Untersuchungen zur Bewertung der Stabilität der Mischung: (a) Transparenz: bei sichtbaren Partikeln Beobachtung mit einer mattschwarzen Tafel, automatische Partikelzählung oder Trübungsmessung; bei nicht sichtbaren Partikeln Verwendung von Lichtmikroskopie, Spektralphotometrie oder Trübungsmessung; (b) Farbveränderung: visuelle Inspektion oder Spektralphotometrie; (c) Gasbildung: visuelle Inspektion; (d) pH-Wert; und (e) chemische Stabilität: Messung der Konzentrationsschwankungen der beiden Arzneimittel.
Erstellung der Ergebnistabelle
Eine Tabelle wurde mit allen möglichen Kombinationen der interessierenden Drogen erstellt. Die Kästchen wurden mit einem „C“ bezeichnet, wenn die Mischung kompatibel war, mit einem „I“, wenn sie inkompatibel war, und mit „I/C“, wenn die Stabilität von besonderen Bedingungen abhing. Die Arzneimittelkombinationen ohne Kompatibilitätsangaben wurden nicht angekreuzt.
ErgebnisseDurchführung der Referenzsuche
Insgesamt wurden 48 Arbeiten identifiziert. Abb. 1 zeigt den Auswahlprozess. Von den 29 Arbeiten, die in die Untersuchung einbezogen wurden, waren 4 auf Spanisch, 3 auf Französisch und 22 auf Englisch verfasst. Was das Veröffentlichungsdatum betrifft, so wurden 8 Arbeiten zwischen 1990 und 1999, 10 zwischen 2000 und 2009 und die restlichen 11 Arbeiten zwischen 2010 und 2017 veröffentlicht.
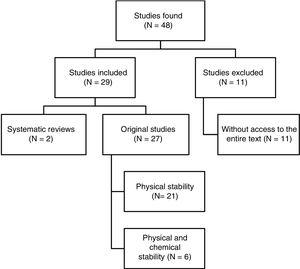
Strukturierte Zusammenfassung der Ergebnisse der Literaturrecherche.
Qualität der gefundenen Studien
Keine der untersuchten Arbeiten erfüllte alle in dieser Überprüfung festgelegten Qualitätskriterien. Allerdings beschrieben 93 % der Arbeiten die Bedingungen und die Methodik der Studie ausreichend detailliert, um ihre Reproduzierbarkeit zu gewährleisten.
Nur in 26 % der Fälle wurden die Tests in dreifacher Ausführung durchgeführt. Im Gegenteil, 81 % der Studien folgten der Empfehlung, die Proben zum Zeitpunkt 0 zu entnehmen, obwohl nur 10 Studien eine Probe zu fünf verschiedenen Zeitpunkten entnahmen.
Bei den Versuchen, die zur Bewertung der Stabilität der Proben durchgeführt wurden, bewerteten alle Studien die Transparenz, während 93 % der Studien eine Farbveränderung durch visuelle Inspektion meldeten. In 16 Studien (59 %) wurden andere Methoden verwendet, um unsichtbare Partikel zu erkennen. 67 % der Studien bewerteten die Gasbildung, und nur in 12 Studien wurden pH-Änderungen im Zeitverlauf gemessen. Nur 6 Studien bewerteten die chemische Stabilität der Mischungen, wobei in 5 Studien die hochauflösende Flüssigkeitschromatographie zur Messung der Wirkstoffkonzentration der Mischung verwendet wurde.
Die Ergebnisse zu diesem Abschnitt sind in Tabelle 3 zusammengefasst.
Zusammenfassung der Qualitätskriterien der veröffentlichten Arbeiten.
| Qualitätsindikator | Anzahl der Studien (%) | |
|---|---|---|
| Bewertung der Niederschlagsbildung | 27 (100) | 12,13,16-40 |
| Bewertung der Farbveränderung | 25 (93) | 12,13,16-27,30-40 |
| Messung der pH-Veränderung | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 |
| Bewertung der Gasbildung | 18 (67) | 12,13,17,19-21,24-26,31,33-40 |
| Analyse in dreifacher Ausführung | 7 (26) | 18,21,22,29,34,35,38 |
| Beschreibung der verwendeten Methodik (einschließlich Anzahl und Häufigkeit der Beobachtungen und Studienbedingungen) | 24 (89) | 12,13,17-24,26-33,35-40 |
| Beschreibung der Verdünnungsmittel aller Studienmedikamente | 21 (78) | 13,17-29,33,35-40 |
| Beschreibung des Materials der Studienempfänger | 22 (81) | 12,13,17-31,33,36-39 |
| Chemische Stabilität | 6 (22) | 16,18,19,22,29,38 |
Ergebnisse der physikalischen und chemischen Kompatibilität
Vierundvierzig Medikamente, die in der kontinuierlichen Perfusion auf der Intensivstation verwendet werden, wurden ausgewählt, darunter eine Lösung für parenterale Ernährung mit und ohne Lipide und 3 Beta-Lactam-Antibiotika. Die Kompatibilität dieser Medikamente ist in Abb. 2 dargestellt. Die Daten aus den Übersichten von Kanji et al. und López-Cabezas et al. lieferten Kompatibilitätsinformationen zu 393 von 945 möglichen Kombinationen.5,7 Nach Abschluss der systematischen Überprüfung wurden neue Stabilitätsdaten für 82 Arzneimittelkombinationen hinzugefügt. Die neuen Erkenntnisse ergaben 29 kompatible Kombinationen, 27 inkompatible Kombinationen und 26 kompatible Kombinationen unter bestimmten Bedingungen. Die endgültige Tabelle zeigt daher die Kompatibilitätsdaten von 475 der 945 möglichen Kombinationen von 2 Arzneimitteln (50,3 %). Davon sind 366 kompatibel (77,1 %), 80 inkompatibel (16,8 %) und 29 unter bestimmten Bedingungen kompatibel (6,1 %), wie in Tabelle 2 dargestellt.

Zusammenfassung der physikalischen und chemischen Kompatibilitäten. C, kompatibel; I, inkompatibel; I/C, kompatibel unter besonderen Bedingungen. Gestrichelte Kästchen zeigen, dass die Mischung nur mit glykosyliertem Serum kompatibel ist. Kästchen mit diagonalen Linien zeigen an, dass die Mischung nur mit physiologischem Serum kompatibel ist.
Diskussion
Die Gewährleistung der Sicherheit bei der Anwendung von Arzneimitteln ist eine der wichtigsten Verpflichtungen, die Gesundheitsdienstleister gegenüber ihren Patienten eingehen. Auf der Intensivstation und angesichts der riesigen Menge an intravenös verabreichten Arzneimitteln und der begrenzten Anzahl von Verabreichungswegen für die Patienten ist diese Sicherheit manchmal gefährdet, da die gleichzeitige Verabreichung von inkompatiblen Arzneimitteln bei besonders gefährdeten Patienten Risiken birgt.
Online-Datenbanken wie Stabilis 4.0 sind sehr nützlich, um Informationen über die Arzneimittelkompatibilität zu finden. Für das Personal, das die Medikamente verabreicht, sind Tabellen jedoch viel nützlicher, weil sie schnell die Informationen abrufen können, die sie zu einem bestimmten Zeitpunkt benötigen. Dies ist vor allem in dringenden Situationen interessant, in denen jede Verzögerung, die von den Gesundheitsdienstleistern verursacht wird, Folgen für den Patienten haben kann.
Diese Untersuchung konzentrierte sich auf die Analyse der physikalischen und chemischen Kompatibilität der am häufigsten durch Y-Site-Infusion auf der Intensivstation verwendeten IV-Medikamente und die Zusammenfassung der erhaltenen Informationen in einer Tabelle mit doppelter Eintragung. Physikalische Kompatibilitätsstudien werden am häufigsten durchgeführt, da sie einfach zu bewerkstelligen sind. Chemische Stabilitätsstudien hingegen nicht, da sie anspruchsvollere Analysetechniken zur Bestimmung der Anfangs- und Endkonzentration von Arzneimitteln erfordern.
Trotz dessen ist die Zahl der untersuchten Arzneimittelkombinationen immer noch unzureichend. Wie Abb. 2 zeigt, konnten wir keine Informationen über die physikalische und chemische Kompatibilität aller vorgeschlagenen Kombinationen finden; beispielsweise konnten wir im Fall von Flumazenil und Piperacillin-Tazobactam nur die Stabilität mit 4 Arzneimitteln bestimmen, und in beiden Fällen blieben die 39 verbleibenden Kombinationen ohne Informationen.
Selbst wenn wir alle vorgeschlagenen möglichen Kombinationen in Betracht ziehen und die neu gefundenen Daten hinzufügen würden, hätten wir immer noch null Informationen über die physikalische und chemische Kompatibilität von 470 Kombinationen. Das bedeutet, dass wir nur für 50,3 % aller vorgeschlagenen Kombinationen Daten zur Verfügung haben.
Die problematischsten Kombinationen in Bezug auf die Unverträglichkeit sind Arzneimittel, deren Stabilität eng mit dem pH-Intervall verbunden ist; dies ist der Fall bei Natriumbicarbonat, Furosemid oder Pantoprazol. Furosemid beispielsweise benötigt einen basischen pH-Wert, um die Stabilität des Moleküls in Lösung zu gewährleisten, weshalb die Mischung mit sauren Arzneimitteln (pH
4) zu Trübungen und Ausfällungen führt.12
Das Vorhandensein von Hilfsstoffen in der pharmazeutischen Formulierung, die Konzentration und die Exposition gegenüber extremen Temperaturen oder Helligkeit sind weitere Faktoren, die mit Arzneimittelunverträglichkeiten in Verbindung gebracht werden.13 Es kann vorkommen, dass eine bestimmte Arzneimittelkombination in einem bestimmten Verdünnungsmittel stabil und in einem anderen inkompatibel ist; so ist beispielsweise Dopamin nur dann mit Amiodaron kompatibel, wenn beide in 5 %igem glykosyliertem Serum gelöst sind, da letzteres in 0,9 %iger Kochsalzlösung instabil ist. Wenn also diese angeblich kompatible Mischung in physiologischem Serum durchgeführt wird, kann es zu einem Konzentrationsverlust von Amiodaron kommen, mit dem entsprechenden Risiko, dass die therapeutische Reaktion ausbleibt.
Andererseits könnte die Qualität der bisher veröffentlichten Studien in vielen Fällen besser sein. Es wäre gut, wenn die Qualitätsstandards für diese Art von Studien einheitlicher wären. Obwohl zum Beispiel der pH-Wert ein kritischer Faktor für die Stabilität von Arzneimitteln in Lösung ist, wurde er nur in 12 der 27 Arbeiten überprüft. Auch die Trübungsmessung oder die Mikroskopie – genauere Verfahren als die visuelle Beobachtung zum Nachweis von Partikeln und Farbveränderungen – werden nicht ausreichend genutzt. In den letzten Jahren haben mehrere Experten Leitlinien für die Gestaltung von Arzneimittelstabilitätsstudien veröffentlicht.8-11 Wir können nur hoffen, dass dies die Gesamtqualität dieser Art von Studien in Zukunft verbessern wird.
Vorherige Autoren haben Übersichten über diese Merkmale veröffentlicht. So untersuchten Flamein et al.14 dieses Problem in neonatalen Intensivstationen; Knudsen et al.15 beleuchteten die Verträglichkeit von Analgetika und Sedativa. Unsere Übersicht basiert auf den früheren Arbeiten von Kanji et al.5 in Kanada und López-Cabezas.7 in Spanien. Sie wurde mit den neuen Informationen über Medikamente in unserem Umfeld und Daten über die am häufigsten verwendeten Medikamentenkonzentrationen ergänzt.
Insgesamt fanden wir Informationen über 82 neue Medikamentenkombinationen aus 27 verschiedenen Quellen, einschließlich Kombinationen von drei Beta-Lactam-Antibiotika (Ceftazidim, Meropenem und Piperacillin-Tazobactam), die auf der Intensivstation weit verbreitet sind. In den letzten Jahren wurden die pharmakokinetischen Vorteile einer verlängerten Perfusionsverabreichung dieser drei Antibiotika bestätigt.16-19
Perfusionen mit Medikamentenkonzentrationen, die über die üblichen hinausgehen, werden häufig bei kritisch kranken Patienten eingesetzt. In diesem Sinne konnten wir nicht zu allen Medikamentenkombinationen Daten über die hohen Konzentrationen finden, die auf der Intensivstation verwendet werden (Tabelle 1); in einigen Fällen erhielten wir jedoch Informationen über niedrigere Konzentrationen als die in dieser Übersicht genannten. Diese Fälle sind in der Kompatibilitätskarte (Abb. 2) als konditionierte Kompatibilität (I/C) dargestellt, d. h. die Kombination wurde bei einer anderen Konzentration als der Standardkonzentration untersucht.
Die in dieser Übersichtsarbeit berichteten Stabilitätsdaten können nicht auf andere Arzneimittelkombinationen oder andere Konzentrationen als die beschriebenen verallgemeinert werden. Außerdem beziehen sich die Angaben auf zwei Arzneimittelkombinationen, und es kann zu Unverträglichkeiten bei>zwei Arzneimittelkombinationen gleichzeitig kommen, was nicht unbedingt ratsam ist. Nichtsdestotrotz sind die ausgewählten Medikamente und Konzentrationen die am häufigsten auf den Intensivstationen für Erwachsene in den meisten Krankenhäusern verwendeten.
Solange wir keine neuen und besseren Kompatibilitätsstudien haben, die Licht in diese Angelegenheit bringen, kann diese Übersicht eine leicht zu lesende Aktualisierung der verfügbaren Erkenntnisse über die Kompatibilität der am häufigsten auf der Intensivstation verwendeten Medikamente sein. Ziel ist es, einen Beitrag zur sicheren Verabreichung von Medikamenten an Patienten zu leisten, die aufgrund ihrer Gebrechlichkeit mit schwerwiegenderen Folgen konfrontiert sein können.
Beitrag der Autoren
Genís Castells Lao: Studiendesign und -idee, Datenerhebung, Analyse und Interpretation der Daten; Entwurf des Papiers oder kritische Überprüfung des geistigen Materials; und endgültige Genehmigung dieser Version.
Montse Rodríguez Reyes: Studiendesign und Idee, Data Mining, Analyse und Interpretation der Daten; Entwurf des Papiers oder kritische Durchsicht des geistigen Materials; und endgültige Genehmigung dieser Version.
Judit Roura Turet: Data Mining, Analyse und Interpretation der Daten; Entwurf des Papiers oder kritische Durchsicht des geistigen Materials; und endgültige Genehmigung dieser Version.
Marta Prat Dot: Data Mining, Analyse und Interpretation der Daten; Entwurf des Papiers oder kritische Durchsicht des intellektuellen Materials; und endgültige Genehmigung dieser Version.
Dolors Soy Muner: Studiendesign und Idee; Entwurf des Papiers oder kritische Durchsicht des intellektuellen Materials; und endgültige Genehmigung dieser Version.
Carmen López Cabezas: Studiendesign und -idee, Data Mining, Analyse und Interpretation der Daten; Entwurf des Papiers oder kritische Durchsicht des intellektuellen Materials; und endgültige Genehmigung dieser Version.
Interessenkonflikte
Die Autoren erklärten, dass es keinerlei Interessenkonflikte gibt.