Introduction
Intensiivihoitoyksiköihin (ICU) otetut potilaat vaativat usein useiden lääkkeiden suonensisäistä antoa. Vasoaktiiviset lääkkeet, kipulääkkeet ja rauhoittavat lääkkeet kuuluvat yleisimmin käytettyihin terapeuttisiin ryhmiin, ja ne annetaan yleensä jatkuvana infuusiona.
Moyenin ym. tekemän systemaattisen katsauksen mukaan lääkkeiden antoprosessiin liittyy teho-osastolla keskimäärin 1,7 virhettä/päivä.1 Toisaalta Merino ym. espanjalaisissa sairaaloiden teho-osastoilla tehdyssä tutkimuksessa raportoimat tiedot ovat hieman paremmat (1,13 lääkitysvirhettä 100 potilasta kohti/vrk).2 Tästä huolimatta lääkitysvirheet ovat yleisiä teho-osastoilla ja vaativat terveydenhuollon tarjoajilta huolellisuutta niiden minimoimiseksi.
Lääkkeiden antovirheet teho-osastoilla johtuvat useista tekijöistä: suuririskisten lääkkeiden (vasoaktiiviset lääkkeet, inotrooppiset lääkkeet, rauhoittavat lääkkeet jne.) käyttö, joita annetaan usein pieninä annoksina niiden suuren lääkevahvuuden vuoksi ja jotka vaativat laimennusta ja etukäteisarviointia ennen niiden antamista. Toinen tekijä on annosten määrääminen eri mittayksiköissä tai kunkin potilaan kohdalla käytettävien lääkkeiden suuri määrä. Vaikka älykkäiden infuusiopumppujen käyttö on merkittävä edistysaskel turvallisuuden kannalta, siihen on liittynyt merkittävä määrä lääkitysvirheitä ohjelmointiongelmien vuoksi.3
Tämän riskitekijöiden yhdistelmä lisää virheiden mahdollisuutta kaikkein haavoittuvimmilla potilailla niiden vakavuuden vuoksi. Kriittisesti sairailla potilailla on usein rajalliset laskimoyhteydet. Tämä tarkoittaa, että eri lääkkeet annetaan samaa antoreittiä käyttäen, mikä lisää riskejä sekoitettaessa keskenään yhteensopimattomia lääkkeitä. Yhteensopimattomien lääkkeiden sekoittaminen on lääkitysvirhe, jolla voi olla potilaalle vakavia seurauksia, kuten terapeuttisia epäonnistumisia, mikroemboliaa tai toksisuutta.4
Kahden lääkkeen Y-kohtainen infuusio edellyttää, että molempien lääkkeiden on oltava fysikaalisesti yhteensopivia.5 Tämä rinnakkaislääkitys toteutuu, kun lääkkeitä sekoitetaan 1:1-suhteessa ja ilman näkyviä yhteensopimattomuuden merkkejä, kuten saostumista tai värin muuttumista. Toisaalta 2 lääkkeen turvallinen yhteiskäyttö samassa laimennusaineessa edellyttää, että seos on kemiallisesti stabiili. Tämä tarkoittaa, että tarvitaan ennakkovahvistus siitä, että jommankumman seoksessa olevan lääkkeen pitoisuudessa ei ole tapahtunut merkittävää muutosta.6
Infuusioliuosten pitoisuuksien vakioiminen on yksi hyödyllisimmistä toimenpiteistä lääkitysvirheiden ehkäisemiseksi teho-osastolla, erityisesti suuririskisten lääkkeiden kohdalla, koska ne voivat aiheuttaa vakavia vaurioita ja koska niissä lääkitysvirheiden esiintyvyys on korkein.
Muuten suositeltava toimenpide lääkkeiden turvallisen annostelemisen kannalta on se, että on saatavissa luotettavaa tietoa lääkkeiden yhteensopivuudesta, kun yleisiä lääkeaineita annostellaan kriittisesti sairaille potilailta. Lääkkeiden yhteensopivuutta koskevia tietoja on kuitenkin niukasti, ja niitä on usein vaikea tulkita käytettävien eri pitoisuuksien, käytettyjen arviointitekniikoita koskevien tietojen puutteen tai lähteiden epäilyttävän teknisen laadun vuoksi. Tietojen puute kahden lääkkeen turvallisesta yhdistelmästä aiheuttaa ongelmia teho-osaston hoitohenkilökunnan päivittäisessä työssä. Kahden yhteensopimattoman molekyylin antamiseen liittyvien komplikaatioiden riskin lisäksi tämä tiedonpuute voi saada sairaanhoitajan etsimään uusia laskimoyhteyksiä lääkkeiden antamiseksi erikseen, mikä lisää infektio- tai tromboemboliakomplikaatioiden riskiä.
Tämän katsauksen tavoitteena on koota yhteen tiedot, jotka on julkaistu teho-osastolla yleisimmin käytettävien lääkkeiden fysikaalisesta ja kemiallisesta yhteensopivuudesta silloin, kun niitä infusoidaan samasta infuusioletkusta Y-paikan kautta. Lisäksi arvioida julkaistujen tietojen laatua ja luoda yhteensopivuuskaavio, jossa on luotettavaa ja ajantasaista tietoa, jotta voidaan parantaa turvallisuutta lääkkeiden antamisessa kriittisesti sairaille potilaille.
MetodologiaHakustrategia
Lääkkeiden fysikaalisesta ja kemiallisesta yhteensopivuudesta tehtiin systemaattinen haku Medline-, Stabilis-, Handbook on Injectable Drugs- ja Micromedex-tietokannoista alkuperäisjulkaisujen, katsausartikkeleiden ja meta-analyysien löytämiseksi. Tapaustutkimukset hylättiin kliinisen lähestymistavan ja fysikaalisen ja kemiallisen stabiilisuuden määritysmenetelmien puuttumisen vuoksi. Vertailukohtana käytettiin Kanjin ym. ja López-Cabezasin ym. 5,7 julkaisemia katsauksia. Haku kohdistui lääkeyhdistelmiin, joista näillä kirjoittajilla ei ollut tietoa tai joista he eivät olleet etsineet tietoa. Tutkimusten julkaisuvuodet olivat 1990-luvulta joulukuuhun 2017, ja mukaan otetut kielet olivat englanti, espanja ja ranska. Hakustrategia koostui siitä, että käytettiin useita kiinnostavaa tietoa kuvaavia termejä, jotka yhdistettiin Boolen operaattorilla ”OR”, jota seurasi tarkennettu haku ”AND”-operaattorilla. Käytettyjä termejä olivat fyysinen yhteensopivuus, lääkkeen stabiilisuus, y-kohta, y-injektio, suonensisäinen lääke sekä kiinnostavien lääkkeiden nimet ja synonyymit.
Katsauksessa käytetyt lääkkeet ovat rutiininomaisesti käytettyjä teho-osastolla annetaan usein jatkuvana infuusiona. Vertailukohtana käytetyt pitoisuudet ovat keskuksessamme7 näille lääkkeille standardoituja pitoisuuksia, ja ne vastaavat useimmissa teho-osastoissa yleisesti käytettyjä pitoisuuksia (taulukko 1). Kaikki tietylle molekyylille eri pitoisuusväleistä löydetyt yhteensopivuustiedot on esitetty taulukossa 2. Kunkin lääkkeen viitehakuprosessin suoritti samanaikaisesti kaksi riippumatonta tutkijaa.
Tutkimuslääkkeet ja konsentraatiot, joita käytettiin viitteenä bibliografisessa haussa.
| Lääke | Vakiopitoisuus | Lääke | Vakiopitoisuus | . |
|---|---|---|---|---|
| Adrenaliini | 40mcg/ml | Isoproterenoli | 4mcg/ml | |
| Amiodaroni | 3.6mg/mL | Ketamiini | 50mg/mL | |
| Argatroban | 1mg/mL | Labetaloli | 2mg/mL | |
| Bikarbonaatti | 1mmol/L | Magnesium. sulfaatti | 15mg/mL | |
| Kalsiumkloridi | 10mg/mL | Meropeneemi | 30mg/ml | |
| Kalsiumglukonaatti | 10mg/ml | Metadoni | 0.2mg/mL | |
| Keftatsidiimi | 24mg/mL | Midatsolaami | 4mg/mL | |
| Cisatrakurium | 2mg/mL | Milrinoni | 0.2mg/ml | |
| Klonidiini | 7.5mcg/ml | N-asetyylikysteiini | 50mg/ml | |
| Morfiinikloridi | 1mg/ml | Naloksoni | 8mcg/mL | |
| Deksmedetomidiini | 4mcg/mL | Nitroglyseriini | 0.2mg/mL | |
| Diltiatseemi | 1mg/mL | Nitroprussidi | 0.2mg/mL | |
| Dobutamiini | 8mg/mL | Noradrenaliini | 0.32mg/mL | |
| Dopamiini | 8mg/mL | Pantopratsoli | 0.32mg/mL | |
| Esomepratsoli | 0.32mg/ml | Piperasilliini-tazobaktaami | 64mg/ml | |
| Fenylefriini | 0.2mg/mL | Kaliumkloridi | 120mEq/L | |
| Fentanyyli | 30mcg/mL | Propofoli | 10mg/mL | |
| Flumatseniili | 40mcg/mL | Remifentaniili. | 20mcg/mL | |
| Furosemidi | 2mg/mL | Somatostatiini | 24mcg/mL | |
| Natriumhepariini | 50IU/mL | Vekuroni | 0.2mg/mL | |
| Insuliini | 1IU/mL | Verapamiili | 0.1mg/mL |
Fysikaalisesti ja kemiallisesti yhteensopivien lääkkeiden yhdistelmät, joiden pitoisuudet ovat alle viitearvon.
| Lääke#1 | Maksimi yhteensopiva pitoisuus | Lääke#2 | Maksimi yhteensopiva pitoisuus |
|---|---|---|---|
| Adrenaliini | 32mcg/ml | Pantopratsoli | 0.8mg/mL |
| 2mcg/mL | Verapamiili | 0.08mg/mL | |
| Amiodaroni | 4mg/mL | Fenylefriini | 0.04mg/mL |
| 6mg/mL | Furosemidi | 1mg/mL | |
| 15mg/mL | Nitroprussidi | 0.3mg/mL | |
| Kalsiumkloridi | 4mg/mL | Dobutamiini | 4mg/mL |
| Kalsiumglukonaatti | 4mg/mL | Tr. | 4mg/mL |
| Keftatsidiimi | 120mg/mL | Dobutamiini | 1mg/mL |
| 120mg/mL | Dopamiini | 0.4mg/mL | |
| 125mg/mL | Ketamiini | 10mg/mL | |
| Dobutamiini | 1mg/mL | Hepariini | 50IU/mL |
| 4mg/mL | Magnesiumsulfaatti | 40mg/mL | |
| 4mg/mL | Kaliumkloridi | 60mEq/L | |
| Dopamiini | 3.2mg/mL | Midatsolaami | 2mg/mL |
| Fentanyyli | 12.5mcg/mL | Remifentaniili | 0.25mg/mL |
| Hepariini | 20IU/mL | Verapamiili | 0.08mg/ml |
| Isoproterenoli | 4mcg/ml | Magnesiumsulfaatti | 1mg/ml |
| 200mcg/mL | Kaliumkloridi | 40mEq/L | |
| 4mcg/mL | Vecuronium | 0.1mg/mL | |
| 10mcg/mL | Verapamiili | 0.08mg/mL | |
| Meropeneemi | 22mg/mL | Kaliumkloridi | 40mEq/L |
| Naloksoni | 0.8mcg/mL | Verapamiili | 0.08mg/mL |
| Nitroglyseriini | 0.1mg/mL | Verapamiili | 0.08mg/mL |
| Nitroprussidi | 0.2mg/mL | Vekuroni | 0.1mg/mL |
| 0.1mg/mL | Verapamiili | 0.08mg/mL | |
| Noradrenaliini | 0.008mg/mL | Verapamiili | 0.08mg/ml |
| Piperasilliini- | |||
| Piperasilliini.tazobactam | 40mg/mL | Dexmedetomidiini | 4mcg/mL |
| 40mg/mL | Remifentaniili | 250mcg/mL | |
| Kaliumin kloridi | 100mEq/L | Remifentaniili | 250mcg/mL |
Se on sopusoinnussa harmaiden laatikoiden kanssa, jotka on määritetty I/C:ksi kuten kuvassa. 2.
Tutkimusten valinta
Viitehakujen jälkeen kaksi riippumatonta arvioijaa arvioi tutkimusten laadun vertaisarviointiprosessin avulla. Tässä katsauksessa noudatettiin asiantuntijoiden lausuntoihin perustuvia laatukriteerejä ja kliinisen käytännön ohjeita8-11:
-
Tutkimuksen toistettavuus: vaikuttavan aineen ja laimentimen kuvaus, tutkimusolosuhteet ja menetelmät.
-
Toteutettujen testien lukumäärä (vähintään kolmena kappaleena).
-
Säilyvyysanalyysin näytteiden ottamiseen kuluneet ajat: suositellaan 5 näytteenottokertaa, mukaan lukien näytteenottoaika 0,
-
Tutkimukset, jotka on tehty seoksen säilyvyyden arvioimiseksi: (a) läpinäkyvyys: näkyvien hiukkasten osalta havainnointi mattamustalla paneelilla, automaattinen hiukkaslaskenta tai turbidimetria; näkymättömien hiukkasten osalta optisen mikroskoopin, spektrofotometrian tai turbidimetrian käyttö; b) värin muuttuminen: silmämääräinen tarkastus tai spektrofotometria; c) kaasunmuodostus: silmämääräinen tarkastus; d) pH-arvo ja e) kemiallinen stabiilisuus: 2 lääkeaineen konsentraatioiden vaihtelujen mittaaminen.
Tulostaulukon luominen
Luotiin taulukko, johon merkittiin kaikki kiinnostuksen kohteena olevien lääkkeiden mahdolliset yhdistelmät. Laatikot nimettiin ”C:llä”, jos yhdistelmä oli yhteensopiva, ”I:llä”, jos se oli yhteensopimaton, ja ”I/C:llä”, jos stabiilius riippui erityisolosuhteista. Lääkeyhdistelmät, joista ei ollut yhteensopivuustietoja, jätettiin merkitsemättä.
TuloksetViitehaku
Viitehakujen suorittaminen
Tunnistettiin yhteensä 48 artikkelia. Kuvassa 1 esitetään valintaprosessi. Katsaukseen sisällytetyistä 29 artikkelista 4 oli kirjoitettu espanjaksi, 3 ranskaksi ja 22 englanniksi. Julkaisuajankohdista 8 artikkelia julkaistiin vuosina 1990-1999, 10 vuosina 2000-2009 ja loput 11 artikkelia vuosina 2010-2017.
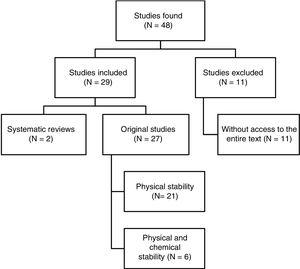
Rakenteinen yhteenveto viitehaun tuloksista.
Löydettyjen tutkimusten laatu
Yksi tutkituista artikkeleista ei täyttänyt kaikkia tässä katsauksessa asetettuja laatukriteereitä. Kuitenkin 93 % papereista kuvasi tutkimuksen olosuhteet ja menetelmät riittävän yksityiskohtaisesti, jotta sen toistettavuus voitiin taata.
Testit suoritettiin kolmena kappaleena vain 26 %:ssa tapauksista. Päinvastoin, 81 % tutkimuksista noudatti suositusta näytteiden ottamisesta ajankohtana 0, vaikka vain 10:ssä otettiin näyte viitenä eri ajankohtana.
Näytteiden stabiilisuuden arvioimiseksi tehtyjen kokeiden osalta kaikissa tutkimuksissa arvioitiin läpinäkyvyyttä, kun taas 93 %:ssa tutkimuksista raportoitiin värin muuttuminen silmämääräisesti. Muita menetelmiä käytettiin 16 tutkimuksessa (59 %) näkymättömien hiukkasten havaitsemiseksi. Tutkimuksista 67 %:ssa arvioitiin kaasunmuodostusta, ja vain 12:ssa mitattiin pH:n ajallisia muutoksia. Vain kuudessa tutkimuksessa arvioitiin seosten kemiallista stabiilisuutta, sillä korkearesoluution nestekromatografia oli menetelmä, jota käytettiin viidessä tutkimuksessa seoksen tehoaineiden pitoisuuksien mittaamiseen.
Taulukossa 3 on yhteenveto tätä osiota koskevista tuloksista.
Yhteenveto julkaistujen julkaisujen laatukriteereistä.
| Laatuindikaattori | Tutkimusten lukumäärä (%) | |
|---|---|---|
| Sateen muodostumisen arviointi | 27 (100) | 12,13,16-40 |
| Värin muutoksen arviointi | 25 (93) | 12,13,16-27,30-40 |
| PH:n muutoksen mittaaminen | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 |
| Kaasunmuodostuksen arviointi | 18 (67) | 12,13,17,19-21,24-26,31,33-40 |
| Asianalyysi tehtiin kolmena kappaleena | 7 (26) | 18,21,22,29,34,35,38 |
| Kuvaus käytetystä menetelmästä (sisältää havaintojen määrän ja tiheyden sekä tutkimusolosuhteet) | 24 (89) | 12,13,17-24,26-33,35-40 |
| Kuvaus kaikkien tutkimuslääkkeiden laimennusaineista | 21 (78) | 13,17-29,33,35-40 |
| Kuvaus tutkimuslääkevalmisteiden materiaalista | 22 (81) | 12,13,17-31,33,36-39 |
| Kemiallinen stabiilisuus | 6 (22) | 16,18,19,22,29,38 |
Tulokset fysikaalisesta ja kemiallisesta yhteensopivuudesta
Valittiin 44 lääkettä, joita käytettiin jatkuvassa perfuusiossa teho-osastolla, mukaan lukien parenteraaliseen ravitsemukseen tarkoitettu liuos, jossa oli ja jossa ei ollut lipidejä, ja 3 beetalaktaamiantibioottia. Näiden yhteensopivuus on esitetty kuvassa 2. Kanjin ym. ja López-Cabezasin ym. tekemistä katsauksista saadut tiedot antoivat yhteensopivuustietoja 393:sta 945:stä mahdollisesta yhdistelmästä.5,7 Systemaattisen katsauksen loppuunsaattamisen jälkeen lisättiin uusia stabiilisuustietoja 82 lääkeyhdistelmästä. Uusista tiedoista ilmeni 29 yhteensopivaa yhdistelmää, 27 yhteensopimatonta yhdistelmää ja 26 yhteensopivaa yhdistelmää erityisolosuhteissa. Näin ollen lopullisessa taulukossa esitetään yhteensopivuustiedot 475:stä 2 lääkkeen 945 mahdollisesta yhdistelmästä (50,3 %). Näistä 366 on yhteensopivia (77,1 %), 80 yhteensopimattomia (16,8 %) ja 29 yhteensopivia erityisolosuhteissa (6,1 %), kuten taulukosta 2 käy ilmi.

Yhteenveto fysikaalisista ja kemiallisista yhteensopivuuksista. C, yhteensopiva; I, yhteensopimaton; I/C, yhteensopiva erityisolosuhteissa. Pistekatkoviivoitetut laatikot osoittavat, että seos on yhteensopiva ainoastaan glykosyloidun seerumin kanssa. Diagonaaliviivoilla varustetut laatikot osoittavat yhteensopivuuden vain fysiologisen seerumin kanssa.
Keskustelu
Lääkkeiden käytön turvallisuuden varmistaminen on yksi tärkeimmistä sitoumuksista, joita terveydenhuollon tarjoajat tekevät potilailleen. Teho-osastolla ja kun otetaan huomioon annettavien suonensisäisesti annettavien lääkkeiden valtava määrä ja potilaiden rajallinen määrä antoreittejä, tämä turvallisuus vaarantuu joskus, koska siihen liittyy riskejä, kun epäyhteensopivia lääkkeitä annetaan samanaikaisesti erityisen haavoittuville potilaille.
Sstabilis 4.0:n kaltaiset online-pohjaiset tietokannat ovat erittäin hyödyllisiä lääkkeiden yhteensopivuutta koskevien tietojen etsimisessä. Lääkkeitä antavan henkilökunnan mielestä taulukot ovat kuitenkin paljon hyödyllisempiä, koska he voivat tarkastella nopeasti tarvitsemiaan tietoja tiettynä ajankohtana. Tämä on erityisen mielenkiintoista kiireellisissä tilanteissa, joissa terveydenhuoltohenkilöstön aiheuttamilla viivytyksillä voi olla seurauksia potilaalle.
Tässä katsauksessa keskityttiin analysoimaan teho-osastolla yleisimmin Y-paikkatietoinfuusiona käytettyjen suonensisäisesti annosteltavien lääkkeiden fysikaalista ja kemiallista yhteensopivuutta ja tiivistämään saadut tiedot kaksoiskirjauskarttaan. Fysikaalisen yhteensopivuuden tutkimukset ovat kaikista yleisimpiä, koska ne on helppo tehdä. Kemialliset yhteensopivuustutkimukset sen sijaan eivät ole, koska ne vaativat kehittyneempiä analyysitekniikoita lääkkeiden alku- ja loppupitoisuuksien määrittämiseksi.
Tästä huolimatta tutkittujen lääkeyhdistelmien määrä on edelleen riittämätön. Kuten kuvasta 2 käy ilmi, emme löytäneet tietoa kaikkien ehdotettujen yhdistelmien fysikaalisesta ja kemiallisesta yhteensopivuudesta; esimerkiksi flumatseniilin ja piperasilliinitatsobaktaamin tapauksessa pystyimme määrittämään stabiilisuuden vain neljällä lääkeaineella, ja molemmissa tapauksissa jäljelle jääneistä 39:stä yhdistelmästä ei jäänyt mitään tietoa.
Vaikka ottaisimmekin huomioon kaikki mahdolliset ehdotetut yhdistelmät ja lisäisimme niihin löydetyt uudet tiedot, meillä olisi edelleen nolla tietoa 470:stä yhdistelmän fysikaalisesta ja kemiallisesta yhteensopivuudesta. Tämä tarkoittaa, että meillä on tietoa saatavilla vain 50,3 %:sta kaikista ehdotetuista mahdollisista yhdistelmistä.
Yhteensopimattomuuden kannalta ongelmallisimpia yhdistelmiä ovat lääkkeet, joiden stabiilisuus liittyy läheisesti pH-arvoväliin; näin on natriumbikarbonaatin, furosemidin tai pantopratsolin kohdalla. Esimerkiksi furosemidi vaatii emäksisen pH:n taatakseen molekyylin stabiilisuuden liuoksessa, minkä vuoksi sekoitus happamien lääkkeiden kanssa (pH
4) aiheuttaa sameutta ja saostumista.12
Lääkkeen epäyhteensopivuuteen liittyvät myös apuaineiden esiintyminen lääkevalmisteessa, konsentraatio ja altistuminen äärimmäisille lämpötiloille tai valoisuudelle.13 Toisinaan tietty lääkeyhdistelmä voi olla stabiili tietyssä laimennusaineessa ja yhteensopimaton toisessa; esimerkiksi dopamiini on yhteensopiva amiodaronin kanssa vain silloin, kun molemmat liuotetaan 5-prosenttiseen glykosylaattiseerumiin, koska jälkimmäinen on epävakaa 0,9-prosenttisessa suolaliuoksessa. Näin ollen, jos tämä muka yhteensopiva sekoitus tehdään fysiologisessa seerumissa, amiodaronin pitoisuus voi pienentyä, jolloin vaarana on terapeuttisen vasteen puuttuminen.
Toisaalta monissa tapauksissa tähän mennessä julkaistujen tutkimusten laatu voi olla parempi. Olisi hyvä, jos tämäntyyppisten tutkimusten laatuvaatimukset olisivat yhtenäisemmät. Esimerkiksi vaikka pH on kriittinen tekijä lääkkeiden stabiilisuuden kannalta liuoksessa, se oli varmistettu vain 12:ssa 27:stä tutkimuksesta. Samoin sameusmittausta tai mikroskopointia – jotka ovat visuaalista havainnointia tarkempia tekniikoita hiukkasten ja värimuutosten havaitsemiseksi – käytetään liian vähän. Viime vuosina useat asiantuntijat ovat julkaisseet ohjeita lääkeaineiden stabiilisuustutkimusten suunnittelua varten.8-11 Voimme vain toivoa, että tämä parantaa tulevaisuudessa tämäntyyppisten tutkimusten yleistä laatua.
Edelliset kirjoittajat ovat julkaisseet katsauksia näistä ominaisuuksista. Esimerkiksi Flamein ym.14 tutkivat tätä ongelmaa vastasyntyneiden teho-osastoilla; Knudsen ym.15 valottivat kipulääkkeiden ja rauhoittavien lääkkeiden yhteensopivuutta. Katsauksemme perustuu Kanjin ym.5 Kanadassa ja López-Cabezasin7 Espanjassa tekemään aiempaan työhön. Sitä on täydennetty uusilla saatavilla olevilla tiedoilla lääkkeistä meidän toimintaympäristössämme ja tiedoilla yleisimmin käytetyistä lääkeainepitoisuuksista.
Kokonaisuudessaan löysimme tietoa 82 uudesta lääkeyhdistelmästä 27 eri viitteestä, mukaan lukien kolmen beetalaktaamiantibiootin (keftatsidiimi, meropeneemi ja piperasilliinitatsobaktaami) yhdistelmät, joita käytetään laajasti teho-osastolla. Viime vuosina on vahvistettu näiden kolmen antibiootin pitkäaikaisen perfuusion antotavan farmakokineettiset edut.16-19
Kriittisesti sairaan potilaan hoidossa käytetään usein perfuusiota tavanomaisia pitoisuuksia suuremmilla lääkepitoisuuksilla. Tässä mielessä emme löytäneet tietoja kaikista lääkeyhdistelmistä, jotka koskevat teho-osastolla käytettäviä korkeita pitoisuuksia (taulukko 1); joissakin tapauksissa saimme kuitenkin tietoa pienemmistä pitoisuuksista kuin tässä katsauksessa ilmoitetut pitoisuudet. Nämä tapaukset on esitetty yhteensopivuuskaaviossa (kuva 2) ehdollisena yhteensopivuutena (I/C), eli että yhdistelmää oli tutkittu vakiopitoisuudesta poikkeavalla pitoisuudella.
Tässä katsauksessa raportoituja stabiilisuustietoja ei voida yleistää koskemaan muita lääkeyhdistelmiä tai kuvatuista poikkeavia pitoisuuksia. Lisäksi annetut tiedot koskevat kahta lääkeyhdistelmää, ja yhteensopimattomuuksia voi esiintyä>2 lääkeyhdistelmää kerrallaan, mikä ei ole erittäin suositeltavaa. Valitut lääkkeet ja pitoisuudet ovat kuitenkin yleisimmin käytettyjä useimpien sairaaloiden aikuisten teho-osastoilla.
Kunnes saamme uusia ja parempia yhteensopivuustutkimuksia, jotka valaisevat tätä kysymystä, tämä katsaus voi olla helppolukuinen päivitys saatavissa olevasta näytöstä teho-osastolla yleisimmin käytettyjen lääkkeiden yhteensopivuudesta. Sen tavoitteena on edistää lääkkeiden turvallista antamista potilaille, jotka voivat kohdata vakavampia seurauksia haurautensa vuoksi.
Tekijöiden osuus
Genís Castells Lao: tutkimuksen suunnittelu ja idea, tiedonhankinta, tietojen analysointi ja tulkinta; paperin luonnos tai henkisen materiaalin kriittinen tarkastelu; ja tämän version lopullinen hyväksyminen.
Montse Rodríguez Reyes: tutkimuksen suunnittelu ja idea, tiedonlouhinta, tietojen analysointi ja tulkinta; paperiluonnos tai henkisen aineiston kriittinen tarkastelu; ja tämän version lopullinen hyväksyminen.
Judit Roura Turet: tiedonlouhinta, tietojen analysointi ja tulkinta; paperiluonnos tai henkisen aineiston kriittinen tarkastelu; ja tämän version lopullinen hyväksyminen.
Marta Prat Dot: tiedonlouhinta, tietojen analyysi ja tulkinta; paperiluonnos tai henkisen aineiston kriittinen tarkastelu; ja tämän version lopullinen hyväksyntä.
Dolors Soy Muner: tutkimuksen suunnittelu ja idea; paperiluonnos tai henkisen aineiston kriittinen tarkastelu; ja tämän version lopullinen hyväksyntä.
Carmen López Cabezas: tutkimuksen suunnittelu ja idea, tiedonhankinta, analyysi ja tulkinta; paperiluonnos tai henkisen materiaalin kriittinen tarkastelu; ja tämän version lopullinen hyväksyntä.
Esintäristiriidat
Tekijät ilmoittivat, että heillä ei ole eturistiriitoja.
Kirjoittajat eivät ilmoittaneet eturistiriitoja.