Introduction
Les mycoses profondes sont des infections peu fréquentes causées par des champignons ; elles se divisent en mycoses sous-cutanées et systémiques.1 Alors que les manifestations cutanées sont toujours présentes dans les mycoses sous-cutanées, ou mycoses d’implantation, comme on les appelle aussi, elles ne sont qu’occasionnellement observées dans les mycoses systémiques. Dans ces cas, la peau est affectée soit directement, par la pénétration du champignon dans le derme, soit indirectement, par une infection qui s’est propagée à partir d’un foyer plus profond. Selon Rezusta et al.2, la majorité des mycoses sous-cutanées et systémiques en Espagne sont importées, à quelques exceptions près (par exemple, la mucormycose). Les données épidémiologiques sur la prévalence et l’incidence des mycoses en Espagne font défaut.
Mycoses sous-cutanées
Les mycoses sous-cutanées comprennent plusieurs entités cliniques causées par l’invasion de la peau et des tissus sous-cutanés par des champignons saprophytes qui vivent dans le sol et la végétation. Cependant, même si les coupures et les plaies sont très fréquentes chez les personnes vivant dans les zones rurales, dans l’ensemble, il y a très peu de cas de mycoses sous-cutanées.1
La voie d’entrée typique du champignon est l’inoculation traumatique par du matériel contaminé tel que des échardes, des épines ou d’autres objets tranchants, ce qui explique pourquoi les mycoses sous-cutanées sont également appelées mycoses d’implantation3.
Bien que les champignons responsables des mycoses sous-cutanées soient taxonomiquement hétérogènes, ils sont unifiés par le fait qu’ils partagent la même voie d’entrée. Chacune de ces infections peut affecter les personnes qui ont voyagé dans des zones endémiques, même des années après leur retour.
Les mycoses sous-cutanées les plus fréquentes sont la sporotrichose, la chromoblastomycose et le mycétome1. D’autres entités moins fréquentes sont la lacaziosis, la phaeohyphomycose, l’hyalohyphomycose et la conidiobolomycose.
La sporotrichose
La sporotrichose est une infection subaiguë ou chronique causée par des champignons dimorphes, dont le plus commun est Sporothrix schenckii.4,5 Ces champignons sont universels, bien qu’ils soient plus fréquents dans les zones tropicales et subtropicales. L’incidence estimée de la sporotrichose en Amérique du Sud se situe entre 48 et 60 cas pour 100000 habitants par an.6,7 Seuls quelques cas autochtones ont été rapportés en Espagne et dans d’autres parties de l’Europe,8 et la majorité des cas dans ces régions sont importés.9
Les agents responsables appartiennent à un complexe d’espèces connu sous le nom de S schenckii,10,11 qui comprend Sporothrix brasiliensis, Sporothrix mexicana, Sporothrix luriei, Sporothrix pallida (anciennement Sporothrix albicans), et Sporothrix schenckii sensu lato (sl.), qui est le plus commun des cinq12.
Après une période d’incubation de 15 à 30 jours, l’inoculation traumatique par Sporothrix spp. entraîne une infection chronique caractérisée par des lésions nodulaires dans le tissu cutané et sous-cutané associées à une lymphangite dans la zone affectée.
Sporothrix spp. vivent dans la végétation, les plantes ou les débris végétaux dans le sol, et les infections sont donc plus fréquentes chez les travailleurs agricoles et les personnes travaillant dans des zones ouvertes. La sporotrichose est considérée comme une maladie professionnelle chez les gardes forestiers, les horticulteurs, les jardiniers et les ouvriers agricoles en général.4,13 L’alcoolisme et le diabète ont également été décrits comme des facteurs de risque. L’immunosuppression, quelle qu’en soit la cause, est également un facteur prédisposant à la maladie disséminée ou systémique.1 La maladie peut également être acquise par la manipulation du champignon en laboratoire. Enfin, il y a eu une épidémie intéressante dans le sud du Brésil où la sporotrichose a été transmise à l’homme par des griffures de chat, ce qui suggère qu’il pourrait s’agir d’une infection zoonotique.14 La plupart des espèces isolées dans ces cas étaient S brasiliensis.
Formes cliniques5
- 1)
La sporotrichose lymphocutanée. Également connue sous le nom de sporotrichose lymphangitique, cette forme clinique représente plus de 75% de tous les cas de sporotrichose.15 Les lésions apparaissent dans les zones exposées, telles que les mains, le visage et les pieds. La maladie commence par un nodule indolore de couleur violette ou noirâtre qui s’érode en un petit ulcère (chancre sporotrichotique) avec des bords gonflés, un centre granulomateux douloureux et un écoulement minimal. Il s’ensuit une lymphangite avec des nodules secondaires le long de la ligne de drainage lymphatique qui peuvent évoluer vers des ulcères ; ce schéma caractéristique est connu sous le nom de propagation sporotrichoïde (Fig. 1).6 L’état de santé général du patient n’est pas affecté.15 L’évolution de la maladie varie selon la réponse immunitaire de l’hôte, la virulence de la souche, la taille de l’inoculum et la profondeur de la lésion.
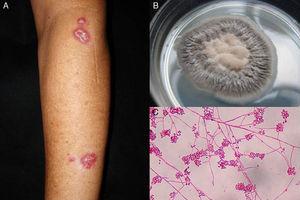 Figure 1.
Figure 1.A, Sporotrichose lymphangitique. B, culture de Sporothrix schenckii. C, Examen microscopique de la culture sur milieu agar Sabouraud dextrose (érythrosine 2%, grossissement original ×40).
(0,21MB).- 2)
Sporotrichose fixée. Cette variante est caractérisée par la présence d’une lésion solitaire. L’infection est limitée et se présente généralement comme une plaque verruqueuse à croissance lente et peu progressive. La sporotrichose fixe n’affecte normalement pas les vaisseaux lymphatiques et est plus fréquente dans les zones endémiques.16
- 3)
Autres formes cliniques:
Sporotrichose ostéoarticulaire. Il s’agit d’une forme disséminée de sporotrichose qui touche les os et les articulations ; c’est la forme la plus fréquente d’atteinte systémique.17
Sporotrichose pulmonaire primaire. Cette variante touche préférentiellement les patients immunodéprimés et s’acquiert par inhalation. Elle mime la tuberculose cavitaire.16
Sporotrichose pulmonaire métastatique. La forme métastatique de la sporotrichose pulmonaire est peu fréquente et n’a été décrite que dans des cas isolés. Elle survient chez les patients immunodéprimés, en particulier ceux qui sont infectés par le virus de l’immunodéficience humaine (VIH) au stade du SIDA.18
Invasion disséminée. La maladie disséminée est rare dans le sporotrichosis, bien que des atteintes méningées et oculaires aient été décrites chez des patients immunodéprimés souffrant de diabète non contrôlé ou d’alcoolisme chronique.
Au Mexique, comme dans d’autres pays d’Amérique latine (où se trouvent les plus grandes séries de cas et la plus grande expérience en matière de sporotrichosis), la sporotrichose lymphocutanée représente 60 à 80 % de tous les cas de sporotrichosis, la sporotrichose cutanée fixe 10 à 30 % et les autres formes cliniques 1 à 2 %.16
La sporotrichose doit être distinguée de la tuberculose, de la leishmaniose, de la tularémie, de la nocardiose cutanée, des infections mycobactériennes non tuberculeuses, du mycétome, de la chromoblastomycose et de la lèpre lépromateuse. Une propagation sporotrichoïde (lymphangitique) peut être observée dans nombre de ces affections, ce qui doit être envisagé dans le diagnostic différentiel.19
Diagnostic
-
Pus (aspiré à partir de nodules). L’examen microscopique direct n’a aucune valeur dans la sporotrichose, car les lésions contiennent très peu de formes de levures. On peut utiliser de la gélose Sabouraud dextrose (SDA) et de la SDA avec des antibiotiques (chloramphénicol et cycloheximide) pour la culture, qui produit des colonies de levures d’abord blanches puis foncées (Fig. 1). La croissance est typiquement rapide (3-5 jours)20 mais 2 semaines sont nécessaires pour identifier le champignon et confirmer le diagnostic.16 Une identification moléculaire par analyse de la réaction en chaîne par polymérase (PCR) est également possible.10,21
-
Histologie. L’examen histologique révèle une réaction granulomateuse mixte non spécifique avec des microabcès neutrophiles. Le champignon se présente sous la forme d’une petite levure en forme de cigare parfois entourée d’un matériel éosinophile rayonnant caractéristique connu sous le nom de corps astéroïde. Bien que les corps astéroïdes puissent aider au diagnostic, ils ne sont pas pathognomoniques16,20, car on les trouve également dans les cellules de la sarcoïdose, de la silicose et de la lacaziose (lobomycose). Les corps astéroïdes extracellulaires, en revanche, sont plus caractéristiques de la sporotrichose. Plusieurs spécimens peuvent être nécessaires pour visualiser les micro-organismes, bien qu’ils soient plus faciles à trouver en cas de maladie disséminée ou viscérale.
Traitement
La sporotrichose peut se résoudre spontanément dans certains cas, comme pendant la grossesse, bien que paradoxalement la dissémination ait également été rapportée chez les femmes enceintes.
-
Solution saturée d’iodure de potassium. Le traitement par l’iodure de potassium, en solution saturée, est débuté à 5 gouttes par repas. Cette dose initiale est ensuite progressivement augmentée à 20 ou 30 gouttes par repas en fonction des niveaux de tolérance. Le traitement doit être maintenu pendant 3 à 4 semaines après la résolution des manifestations cliniques. Le mécanisme d’action est inconnu, mais on pense que l’iodure de potassium agit comme un immunostimulant. Les effets indésirables comprennent un goût métallique dans la bouche, une rhinite, une expectoration, une urticaire, des pétéchies, une éruption bulleuse ou acnéiforme, une vascularite et l’induction d’une hypothyroïdie ou d’une hyperthyroïdie. L’iodure de potassium est contre-indiqué pendant la grossesse.20,22
-
Itraconazole 200mg/j pendant 3 à 6 mois.22 C’est le traitement de première intention recommandé dans la plupart des directives thérapeutiques. Il a tendance à être un peu plus cher que l’iodure de potassium, mais il a moins d’effets indésirables.
-
Autres options . Terbinafine 250-1000mg/j pendant 3 à 6 mois23,24 ; fluconazole 400mg/j pendant 3 à 6 mois22 ; amphotéricine B (désoxycholate) 0.5-1mg/kg/j pour une maladie systémique ou des formulations liposomales ou lipidiques d’amphotéricine B à une dose de 3-5mg/kg/j22 ; chaleur ou thermothérapie locale pendant 2 ou 3 mois22 ou une combinaison des traitements ci-dessus (iodure de potassium avec itraconazole, itraconazole avec terbinafine et terbinafine avec iodure de potassium)25.25 L’ajout d’une thérapie photodynamique avec de l’aminolévulinate de méthyle ou encore mieux du bleu de méthylène 1% intralésionnel (combiné ou non avec l’itraconazole) a donné de bons résultats in vitro et chez 1 patient26.
La chirurgie peut avoir un rôle important dans la sporotrichose ostéoarticulaire.22 Le débridement et l’arthrodèse étaient traditionnellement considérés comme les traitements de choix, mais le remplacement prothétique de l’articulation suivi d’un traitement antifongique à long terme a également été décrit comme une option viable
1.1Chromoblastomycose (Chromomycose)
La chromoblastomycose, également appelée chromomycose, est une infection fongique polymorphe chronique de la peau et des tissus sous-cutanés. Elle est causée par plusieurs espèces de champignons mélanisés ou dématiacés, qui produisent un pigment foncé. Les formes parasites de ces champignons sont appelées cellules fumagoïdes ou muriformes (corps scléreux).27-30
Les espèces les plus courantes à l’origine de la chromoblastomycose sont Fonsecaea pedrosoi, Fonsecaea monophora, Cladophialophora carrionii, Phialophora verrucosa et Rhinocladiella aquaspersa.5,27,28 La plupart des patients ont des antécédents de blessure traumatique impliquant du bois ou de la végétation, et plus de 80 % sont des travailleurs ruraux d’Afrique, d’Asie et d’Amérique du Sud qui ont tendance à marcher pieds nus. Les champignons responsables de la chromoblastomycose ont été trouvés dans le monde entier, bien qu’ils soient plus fréquents dans les pays tropicaux et subtropicaux.27
Formes cliniques
Le champignon pénètre généralement dans la peau par une lésion cutanée, typiquement localisée sur les membres inférieurs.31 Environ 1 ou 2 mois plus tard, l’individu infecté développe une papule qui évolue vers un nodule verruqueux à croissance lente (Fig. 2). L’infection est limitée au tissu sous-cutané et ne s’étend pas aux muscles ou aux os, sauf chez les patients immunodéprimés. Les lésions individuelles peuvent prendre un aspect épais de chou-fleur et la surinfection bactérienne est fréquente. Un lymphœdème secondaire, pouvant évoluer vers un éléphantiasis, et un carcinome spinocellulaire peuvent survenir.27
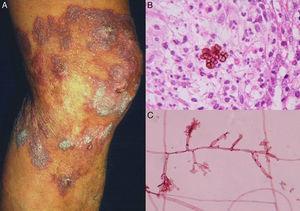 Figure 2.
Figure 2.A, chromoblastomycose nodulaire-verruqueuse. B, Biopsie montrant des cellules fumagoïdes. C, Examen direct de la culture de Fonsecaea pedrosoi (biopsie ; hématoxyline-éosine et érythrosine 2%, grossissement original dans les deux cas ×40).
(0,27MB).Diagnostic
-
Examen direct. L’examen direct des croûtes et des fragments de peau peut révéler des formes parasitaires isolées ou formant des septa caractéristiques (figure 2). Les structures microscopiques observées sont communes à toutes les espèces.27,28
-
Culture. Les champignons responsables de la chromoblastomycose se développent lentement lorsqu’ils sont cultivés sur SDA avec ou sans antibiotiques (chloramphénicol et cycloheximide) ; ils produisent des colonies olivacées ou noires foncées avec une surface veloutée plate et un centre surélevé. La distinction entre les espèces est difficile et repose sur les structures de reproduction et l’identification moléculaire.30 Les techniques de biologie moléculaire (PCR), ciblant en particulier les régions de l’espaceur transcrit interne (ITS) de l’ADN ribosomal (ADNr), sont également utiles.32,33
-
Histologie. L’examen histologique montre une hyperplasie pseudo-épithéliomateuse caractéristique dans l’épiderme et un infiltrat inflammatoire granulomateux mixte avec des cellules géantes contenant des structures fongiques rondes caractéristiques (figure 2) dans le derme27.
Traitement
La chromoblastomycose est extrêmement difficile à traiter et est souvent réfractaire aux diverses options, y compris les traitements non pharmacologiques tels que le curetage, l’électrocoagulation et la cryochirurgie.5 Les antifongiques doivent être maintenus pendant au moins 6 mois, et bien qu’ils puissent produire un résultat clinique favorable, les récidives pendant ou après le traitement sont fréquentes. Le traitement doit être interrompu lorsque toutes les lésions disparaissent27.
Les autres traitements comprennent la résection chirurgicale des petites lésions ; la cryochirurgie locale (en association avec un antifongique pour prévenir la propagation lymphatique) ; l’itraconazole 200-400mg/j seul ou associé à la 5-fluorocitosine 30mg/kg 4 fois par jour pendant 6 mois ; terbinafine 250-500mg/j pendant 12 mois, et en cas d’atteinte systémique amphotéricine B intraveineuse à la dose de 1mg/kg ou formulations liposomales ou lipidiques d’amphotéricine B à la dose de 3-5mg/kg/j.27
Mycétome
Le mycétome est une infection locale chronique causée par plusieurs espèces de champignons et de bactéries. L’infection est appelée actinomycétome lorsqu’elle est causée par des bactéries filamenteuses aérobies et eumycétome lorsqu’elle est causée par des champignons.34 Elle est caractérisée par la formation d’agrégats des micro-organismes responsables dans les abcès. Ces agrégats sont appelés grains ou granules. Les granules peuvent s’écouler par des sinus s’ouvrant sur la peau ou affecter les os adjacents. La maladie progresse par propagation directe, avec très peu de cas de dissémination à des sites distants. Les agents responsables se trouvent généralement dans le sol et ils pénètrent dans l’organisme par des lésions cutanées. La plupart des cas concernent des travailleurs ruraux.
Etiologie
-
Fongiques. Les champignons à l’origine de l’eumycétome produisent des granules blancs ou foncés. Ils sont particulièrement fréquents en Afrique, en Inde et au Mexique. Les granules sombres sont formés par Madurella mycetomatis, Trematosphaeria grisea et Leptosphaeria senegalensis35, tandis que les granules blancs sont formés par Fusarium spp, Acremonium spp et Aspergillus nidulans.
-
Bactéries filamenteuses ou actinomycètes aérobies. Les granules formés par ces espèces sont rouges (Actinomadura pelletieri), blanc-jaune (Actinomadura madurae, Nocardia brasiliensis et Nocardia spp.) ou jaune-brun (Streptomyces somaliensis). Les actinomycètes sont présents dans le monde entier, pas seulement dans les pays tropicaux.36
Formes cliniques
Les caractéristiques cliniques du mycétome causé par des champignons et des actinomycètes sont très similaires. Les lésions sont plus fréquentes sur les pieds, les tibias et les mains. La manifestation clinique la plus précoce est un nodule dur et indolore qui s’étend lentement pour produire des papules et des sinus qui déchargent des granules contenant du liquide sur la surface de la peau.35,36 Le site original de l’infection est déformé par un gonflement local des tissus, la formation de sinus chroniques et une atteinte osseuse tardive (Fig. 3). Les lésions sont rarement douloureuses, sauf aux stades tardifs.
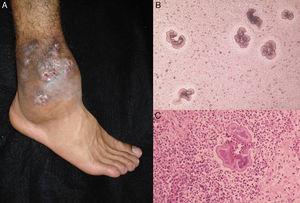 Figure 3.
Figure 3.A, Actinomycetoma du pied. B, granules de Nocardia sp. vus à l’examen direct (KOH, grossissement original ×10). C, Biopsie (hématoxyline-éosine ×40).
(0,27MB).Diagnostic
Les granules de mycétome (Fig. 3) constituent un élément clé du diagnostic et sont généralement retrouvés lors de l’examen des écoulements des sinus ou lors de l’écrasement d’une croûte prélevée sur une lésion. L’examen microscopique montrera si ces granules sont formés de petits actinomycètes ou de filaments mycosiques plus larges. L’identification définitive nécessite une culture, qui est normalement effectuée sur SDA avec ou sans antibiotiques (chloramphénicol et cycloheximide) ; le chloramphénicol seul est préférable dans le cas de champignons hyalins. Les agents peuvent également être identifiés par des tests de biologie moléculaire, en particulier l’analyse PCR utilisant différents marqueurs37 en fonction des agents responsables (par exemple, les régions ITS de l’ADNr, la β-tubuline38 et D1/D2). L’analyse de la séquence partielle du gène de l’ARN ribosomal, en revanche, peut être utilisée pour identifier les espèces de Nocardia et d’Actinomadura.36 Les résultats histologiques sont similaires dans toutes les formes de mycétome, et comprennent un centre inflammatoire riche en cellules polymorphonucléaires (véritables abcès), en cellules épithélioïdes, en cellules géantes et en fibrose. Les granules sont situés au centre de l’inflammation.35,39 Les études d’imagerie, bien que complémentaires, peuvent aider au diagnostic en montrant un gonflement des tissus mous, des lésions ostéolytiques et un épaississement cortical.
Le diagnostic différentiel doit inclure l’ostéomyélite bactérienne, l’ostéomyélite tuberculeuse, l’hidradénite suppurée, le sarcome de Kaposi et la tuberculose cutanée, entre autres.35,39
Traitement
Actinocétome. Le régime de traitement avec la base de preuves la plus solide pour le mycétome nocardique est triméthoprime-sulfaméthoxazole plus diaminodiphénylsulfone (dapsone) pendant 6 mois à 2 ans. L’amoxicilline-acide clavulanique, administrée pendant 6 mois, peut être utilisée pour les cas réfractaires.40-42 Le traitement de choix en cas d’infection étendue et/ou d’atteinte viscérale est l’amikacine associée au triméthoprime-sulfaméthoxazole39 ou au méropénème.43,44 Des rapports isolés ont fait état de résultats positifs avec d’autres agents chez des patients qui ne répondent pas à ces traitements.36,39,45
Eumycétome. Contrairement à l’actinomycétome, où le traitement pharmacologique est associé à de bons résultats, le traitement standard de l’eumycétome est une combinaison de traitement médical et de chirurgie. Des résultats acceptables ont été rapportés pour l’utilisation de triazoles de dernière génération, tels que l’itraconazole et le fluconazole, utilisés seuls ou en association avec la terbinafine. Ces médicaments sont administrés sur une longue période et seulement après avoir épuisé toutes les options chirurgicales.35,45
Phæohyphomycose
La phæohyphomycose est un groupe hétérogène de mycoses causées par des champignons à paroi sombre (dématiacés).46,47 Ces champignons sont présents sous tous les climats, bien qu’ils soient plus fréquents sous les climats tropicaux. On a constaté récemment une augmentation des cas chez les patients immunodéprimés atteints d’une infection par le VIH ou du SIDA, les receveurs de greffes et les patients diabétiques, entre autres.46,48
Les agents causaux les plus courants sont Exophiala spp, Bipolaris spp, Curvularia spp, Pleurophomopsis spp, Phaeoacremonium spp, et Alternaria spp. Les champignons se trouvent principalement dans les débris organiques.
Formes cliniques
-
Phaeohyphomycose sous-cutanée. Suite à un traumatisme local ou à l’inoculation d’un matériel étranger, les patients développent une lésion solitaire à croissance lente (généralement un kyste ou un nodule, ou éventuellement une plaque ou un abcès) normalement située sur les extrémités (Fig. 4).48,49 Le diagnostic différentiel doit inclure les lipomes, les kystes épidermiques ou synoviaux, les fibromes, les kystes à corps étranger et les abcès bactériens.
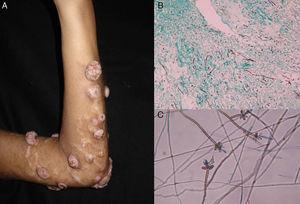 Figure 4.
Figure 4.A, Phaeohyphomycose nodulaire. B, Filaments et levures dans l’échantillon de biopsie (Grocott, grossissement original ×10). C, Examen microscopique de Veronaea botryosa (bleu de coton lactophénol, grossissement original ×40).
(0,22MB). -
Phæohyphomycose systémique ou disséminée. Bien que très rare, la phaeohyphomycose systémique est très grave chez les patients immunodéprimés.50
Diagnostic
La microscopie humide montre des hyphes septés sombres diagnostiques formant des branches ou des chaînes (Fig. 4). La croissance est lente (3-4 semaines) sur SDA et les colonies acquièrent une couleur olivâtre ou brun foncé. L’analyse PCR de marqueurs tels que la β-tubuline et les régions ITS peut être utilisée pour l’identification moléculaire.51,52 La biopsie révèle une paroi de kyste formée de macrophages palissadés avec des hyphes mycosiques.49
Traitement
Le traitement des infections causées par Exophiala spp. est controversé, et une option qui a été proposée est la résection chirurgicale.48 Il n’existe pas non plus de protocole standard pour le traitement des infections à Alternaria.53 La meilleure option pour la phaeohyphomycose semble être une combinaison de traitement antifongique (itraconazole, kétoconazole ou terbinafine) et de chirurgie. Les souches d’Exophiala spp. ont tendance à être résistantes au fluconazole. Les infections disséminées sont traitées avec de l’amphotéricine B.48,49
Hyalohyphomycose
La hyalohyphomycose est causée par des champignons hyalins (Hyphomycètes) qui forment des hyphes septés dans les tissus.47 Cette classification est cependant assez arbitraire car il existe de nombreux types d’Hyphomycètes terrestres et aquatiques. Cependant, seuls quelques organismes peuvent causer des infections, dont la plupart sont opportunistes, chez l’homme.54,55 La plupart des genres impliqués dans l’hyalohyphomycose sont morphologiquement identiques lorsqu’ils sont observés dans des coupes de tissus et ils déclenchent la même réponse pathologique. Les champignons qui provoquent fréquemment des infections ou qui présentent une autre caractéristique particulièrement distinctive sont affectés à une autre catégorie (par exemple, l’aspergillose).
Les agents les plus fréquemment impliqués dans l’hyalohyphomycose sont Aspergillus (fumigatus, niger, flavus), Scopulariopsis spp, Fusarium spp, Acremonium recifei, Paecilomyces spp, Purpureocillum spp, et Neoscytalidium spp.55. Ils sont tous largement distribués dans la nature, et peuvent être trouvés dans n’importe quel type de sol, de bois, ou de matériel végétal en décomposition.56 Ils affectent les individus des deux sexes et à tout âge, et l’immunosuppression n’est pas une condition nécessaire pour l’infection.
Formes cliniques
L’hyalohyphomycose peut être classée comme superficielle, sous-cutanée, ou systémique.
-
Hyalohyphomycose superficielle. Les infections superficielles comprennent la dermatomycose et l’onychomycose. Elles sont fréquentes chez les travailleurs ruraux, les pêcheurs, les patients souffrant de brûlures graves et les nouveau-nés prématurés.57,58
-
Hyalohyphomycose sous-cutanée. L’inoculation traumatique provoque des abcès, des kystes et des lésions tumorales similaires à celles observées dans le mycétome (Fig. 5).56
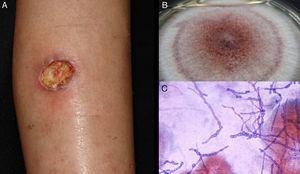 Figure 5.
Figure 5.Un ulcère d’hyalohyphomycose dû à Acremonium sp. B, Culture (milieu dextrose agar de Sabouraud). C, examen direct de l’exsudat (Giemsa, grossissement original ×40).
(0,17MB). -
Hyalohyphomycose systémique. Les infections systémiques, bien que peu fréquentes, sont très graves. Elles touchent les patients immunodéprimés et peuvent être fatales. La propagation hématogène et lymphatique entraîne une atteinte des poumons et du système nerveux central.55,57
Diagnostic
L’identification d’hyphes hyalins septés par examen microscopique de squames cutanées, de fragments d’ongles, de sécrétions ou de fragments fournit un diagnostic présomptif, qui est ensuite confirmé par culture (figure 5). La plupart des champignons se développent sur la SDA sans antibiotiques ni inhibiteurs.47,59 Comme dans les cas décrits ci-dessus, une identification moléculaire est également possible.60
Le diagnostic différentiel doit inclure d’autres dermatomycoses, les kystes épidermiques, l’actinomycétome, l’eumycétome, l’histoplasmose et la cryptococcose.
Traitement
Chez les individus immunocompétents, les traitements de choix sont les triazoles, la terbinafine, ou la chirurgie.61 Lorsque le système immunitaire est compromis, le traitement de première intention est l’amphotéricine B associée à un triazole (itraconazole 200mg/j pendant 6 mois ou fluconazole 150mg deux fois par semaine pendant 6 mois).
Lacaziose (Lobomycose)
La lacaziose, autrefois appelée lobomycose, est une infection fongique granulomateuse chronique de la peau et des tissus sous-cutanés décrite pour la première fois sous le nom de blastomycose chéloïdienne en 1930 par Jorge Lobo à Recife, au Brésil62. Il s’agit d’une infection rare que l’on trouve en Amérique centrale et en Amérique du Sud ; elle est causée par Lacazia loboi,62,63 une levure qui ne peut être cultivée. On pense que la source de l’infection se trouve dans le sol et la végétation. Le champignon pénètre probablement à travers la peau à la suite d’une blessure pénétrante, comme une piqûre d’épine ou une morsure d’insecte.
La lacaziose se caractérise par des lésions chéloïdes aux bords lobulés bien définis dans les zones exposées du corps (fréquemment le visage, les bras ou les jambes). Les lésions s’étendent aux sites contigus, bien que la transmission à des sites distants soit également possible par autoinoculation.
Diagnostic
Le diagnostic est facilité par l’identification de structures fongiques abondantes lors d’un examen direct et de chaînes de cellules rondes diffuses reliées par de petites structures tubulaires dans les échantillons de biopsie62. Les agents causaux peuvent également être identifiés dans les tissus par analyse PCR, en particulier les tests ciblant le fragment d’ADNr 18S.64
Le diagnostic différentiel doit inclure les chéloïdes, la lèpre lépromateuse et la leishmanie anergique.
Traitement
Les antifongiques ne sont pas efficaces dans la lacaziosis et le traitement définitif est la résection chirurgicale.62,63
Zygomycose
La zygomycose est un groupe hétérogène d’infections fongiques causées par des Zygomycètes opportunistes des ordres Mucorales (Rhizopus, Lichtheimia, Mucor et Rhizomucor) et Entomophthorales (Basidiobolus et Conidiobolus).65 Dans cette partie, nous ne parlerons que des champignons Entomophthorales, les Mucorales étant abordées dans la deuxième partie de cette revue, qui s’intéresse aux mycoses systémiques.
L’entomophthoromycose se caractérise par l’apparition d’une masse dure et progressive qui affecte les tissus sous-cutanés. Il existe 2 variantes. La première est causée par Basidiobolus ranarum et est plus fréquente chez les enfants.66 Les lésions apparaissent généralement au niveau des épaules et des ceintures pelviennes, et se présentent comme une cellulite ligneuse à propagation lente. La seconde variante est causée par Conidiobolus coronatus et touche les adultes. L’infection primaire commence dans les turbines inférieures du nez, puis s’étend au centre du visage, provoquant un gonflement induré douloureux et une déformation sévère du nez, des lèvres et des joues65.-68
Conclusion
Nous avons passé en revue les principales caractéristiques des mycoses sous-cutanées et les principales méthodes de diagnostic et de traitement disponibles (tableau 1).
Tableau 1.Résumé des caractéristiques des mycoses sous-cutanées.
Mycoses Agent causal principal Diagnostic Traitement. Sporotrichose Sporothrix schenckii Culture du pus aspiré des nodules ; histologie ; PCR Solution saturée d’iodure de potassium pendant 3 wk ; itraconazole 200mg/j pendant 3-6 mo ; associations Chromoblastomycose Fonsecaea pedrosoi Examen microscopique ; culture ; histologie Très difficile. Itraconazole 200mg/j pendant 6 mo ; terbinafine pendant 12 mo ; amphotéricine B ; combinaisons Mycétome Actinomycètes filamenteux et champignons filamenteux Identification des granules de mycétome ; culture ; histologie ; PCR Antibiotiques pour l’actinomycétome ; antifongiques+chirurgie pour l’eumycétome Phæohyphomycose Exophiala jeanselmei
Alternaria spp.Examen et culture microscopiques ; histologie ; PCR Controversé. Chirurgie+combinaison d’antifongiques Hyalohyphomycose Aspergillus opportuniste (fumigatus, niger, flavus), Fusarium spp, Paecilomyces, etc. Examen microscopique et culture ; PCR Patients immunocompétents : triazoles ; terbinafine ; ciclopirox olamine ; chirurgie
Patients immunodéprimés : amphotéricine B associée à un triazole pendant 6 moLacaziose (lobomycose) Lacazia loboi Examen microscopique ; histologie ; PCR Chirurgie Entomophtoromycose Conidiobolus coronatus
Basidiobolus ranarum.
Examen direct et culture Chirurgie et antifongiques systémiques Abréviation : PCR, réaction en chaîne par polymérase.
Conflits d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
- 2)