Introduction
Les patients admis dans les unités de soins intensifs (USI) nécessitent souvent l’administration IV de plusieurs médicaments. Les médicaments vasoactifs, les analgésiques et les sédatifs font partie des groupes thérapeutiques les plus utilisés et sont généralement administrés en perfusion continue.
Selon l’étude systématique menée par Moyen et al. il y a en moyenne 1,7 erreur/jour associée au processus d’administration des médicaments dans le cadre de l’unité de soins intensifs1. D’autre part, les données rapportées par Merino et al. dans une étude menée auprès d’unités de soins intensifs d’hôpitaux espagnols sont un peu meilleures (1,13 erreur de médication pour 100 patients/jour).2 Malgré cela, les erreurs de médication sont courantes dans les unités de soins intensifs et nécessitent une attention de la part des prestataires de soins pour les minimiser.
Les erreurs d’administration de médicaments dans les USI sont dues à plusieurs facteurs : l’utilisation de médicaments à haut risque (médicaments vasoactifs, inotropes, sédatifs, etc.) souvent administrés à faible dose en raison de leur puissance médicamenteuse élevée, nécessitant une dilution et une évaluation préalable à leur administration. Un autre facteur est la prescription de doses dans différentes unités de mesure ou le nombre élevé de médicaments utilisés chez chaque patient. Bien qu’il s’agisse d’une avancée importante en matière de sécurité, l’utilisation de pompes à perfusion intelligentes a été associée à un nombre important d’erreurs de médication dues à des problèmes de programmation.3
La combinaison de ces facteurs de risque augmente les chances de commettre des erreurs chez les patients les plus vulnérables en raison de leur gravité. Les patients gravement malades ont souvent des accès veineux limités. Cela signifie que différents médicaments sont administrés en utilisant la même voie d’administration, ce qui augmente les risques liés au mélange de médicaments incompatibles. Le mélange de médicaments incompatibles est une erreur médicamenteuse qui peut avoir des conséquences graves pour le patient telles que des échecs thérapeutiques, des micro-embolies ou une toxicité.4
La perfusion en Y de 2 médicaments nécessite que les deux médicaments soient physiquement compatibles.5 Cette coadministration se produit lors du mélange de médicaments dans un rapport 1:1 et en l’absence de signes visibles d’incompatibilité comme une précipitation ou un changement de couleur. D’autre part, pour une coadministration sûre de 2 médicaments dans le même diluant, le mélange doit être chimiquement stable. Cela signifie qu’une confirmation préalable est nécessaire pour s’assurer qu’aucun changement significatif n’a eu lieu dans la concentration de l’un ou l’autre des médicaments présents dans le mélange.6
La normalisation de la concentration des solutions de perfusion est l’une des mesures les plus utiles pour prévenir les erreurs de médication dans le cadre de l’unité de soins intensifs, en particulier pour les médicaments à haut risque en raison de leur potentiel à causer des dommages graves et parce qu’ils ont la plus grande incidence d’erreurs de médication.
Une autre mesure hautement recommandée pour l’administration sûre des médicaments est d’avoir des informations fiables disponibles sur la compatibilité des médicaments lors de l’administration de médicaments courants chez les patients gravement malades. Cependant, les informations sur la compatibilité des médicaments sont rares et, dans de nombreuses occasions, difficiles à interpréter en raison des différentes concentrations utilisées, du manque d’informations sur les techniques d’évaluation utilisées ou de la qualité technique suspecte des sources. Le manque d’informations sur le mélange sûr de deux médicaments crée des problèmes dans le travail quotidien des équipes infirmières des unités de soins intensifs. Ajouté au risque de complications liées à l’administration de 2 molécules incompatibles, ce manque d’information peut obliger l’infirmière à chercher de nouveaux accès veineux pour administrer les médicaments séparément ce qui augmente le risque de complications infectieuses ou thromboemboliques.
Le but de cette revue est de rassembler les informations publiées sur la compatibilité physique et chimique des médicaments les plus couramment utilisés dans une USI lorsqu’ils sont perfusés par une même ligne via un site en Y. De plus, évaluer la qualité des informations publiées et générer un tableau de compatibilité avec des informations fiables et mises à jour afin d’améliorer la sécurité de l’administration de médicaments aux patients gravement malades.
MéthodologieStratégie de recherche
Une recherche systématique sur les bases de données Medline, Stabilis, Handbook on Injectable Drugs et Micromedex a été menée pour identifier les articles originaux, les articles de synthèse et les méta-analyses sur la compatibilité physique et chimique des médicaments. En raison de leur approche clinique et du manque de méthodologie pour déterminer la stabilité physique et chimique, les études de cas ont été écartées. Les revues publiées par Kanji et al. et López-Cabezas et al.5,7 ont été utilisées comme point de référence. La recherche s’est concentrée sur les combinaisons de médicaments sur lesquelles ces auteurs n’avaient aucune information ou n’avaient pas cherché d’information. Les années de publication des études allaient des années 1990 à décembre 2017 et les langues incluses étaient l’anglais, l’espagnol et le français. La stratégie de recherche consistait à utiliser plusieurs termes décrivant les informations d’intérêt pour les combiner avec l’opérateur booléen « OR », suivi d’un affinement de la recherche avec l’opérateur « AND ». Les termes utilisés étaient : compatibilité physique, stabilité du médicament, site y, injection y, médicament intraveineux, plus les noms et synonymes des médicaments d’intérêt.
Les médicaments utilisés dans l’examen sont couramment utilisés dans le cadre des soins intensifs sont souvent administrés par perfusion continue. Les concentrations utilisées comme référence sont celles normalisées dans notre centre7 pour ces médicaments et correspondent à celles couramment utilisées dans la plupart des USI (tableau 1). Toutes les informations sur la compatibilité trouvée pour une certaine molécule sur un intervalle de concentration différent sont présentées dans le tableau 2. Le processus de recherche de référence pour chaque médicament a été mené simultanément par 2 chercheurs indépendants.
Médicaments étudiés et concentrations utilisées comme référence pour la recherche bibliographique.
| Médicament | Concentration standard | Médicament | Concentration standard |
|---|---|---|---|
| Adrénaline | 40mcg/mL | Isoprotérénol | 4mcg/mL |
| Amiodarone | 3.6mg/mL | Kétamine | 50mg/mL |
| Argatroban | 1mg/mL | Labétalol | 2mg/mL |
| Bicarbonate | 1mmol/L | Magnésium sulfate de magnésium | 15mg/mL |
| Chlorure de calcium | 10mg/mL | Méropénem | 30mg/mL |
| Gluconate de calcium | 10mg/mL | Méthadone | 0.2mg/mL |
| Ceftazidime | 24mg/mL | Midazolam | 4mg/mL |
| Cisatracurium | 2mg/mL | Milrinone | 0.2mg/mL |
| Clonidine | 7.5mcg/mL | N-acétylcystéine | 50mg/mL |
| Chlorure de morphine | 1mg/mL | Naloxone | 8mcg/mL |
| Dexmedetomidine | 4mcg/mL | Nitroglycérine | 0.2mg/mL |
| Diltiazem | 1mg/mL | Nitroprussiate | 0,2mg/mL |
| Dobutamine | 8mg/mL | Noradrénaline | 0.32mg/mL |
| Dopamine | 8mg/mL | Pantoprazole | 0,32mg/mL |
| Esoméprazole | 0.32mg/mL | Pipéracilline-tazobactam | 64mg/mL |
| Phényléphrine | 0.2mg/mL | Chlorure de potassium | 120mEq/L |
| Fentanyl | 30mcg/mL | Propofol | 10mg/mL |
| Flumazénil | 40mcg/mL | Remifentanil | 20mcg/mL |
| Furosémide | 2mg/mL | Somatostatine | 24mcg/mL |
| Héparine de sodium | 50IU/mL | Vecuronium | 0.2mg/mL |
| Insuline | 1UI/mL | Vérapamil | 0,1mg/mL |
Combinaisons de médicaments physiquement et chimiquement compatibles avec des concentrations inférieures à la marque de référence.
| Médicament#1 | Concentration maximale compatible | Médicament#2 | Concentration maximale compatible |
|---|---|---|---|
| Adrénaline | 32mcg/mL | Pantoprazole | 0.8mg/mL |
| 2mcg/mL | Vérapamil | 0,08mg/mL | |
| Amiodarone | 4mg/mL | Phényléphrine | 0.04mg/mL |
| 6mg/mL | Furosémide | 1mg/mL | |
| 15mg/mL | Nitroprussiate | 0.3mg/mL | |
| Chlorure de calcium | 4mg/mL | Dobutamine | 4mg/mL |
| Gluconate de calcium | 4mg/mL | Dobutamine | 4mg/mL |
| Ceftazidime | 120mg/mL | Dobutamine | 1mg/mL |
| 120mg/mL | Dopamine | 0.4mg/mL | |
| 125mg/mL | Kétamine | 10mg/mL | |
| Dobutamine | 1mg/mL | Héparine | 50IU/mL |
| 4mg/mL | Sulfate de magnésium | 40mg/mL | |
| 4mg/mL | Chlorure de potassium | 60mEq/L | |
| Dopamine | 3.2mg/mL | Midazolam | 2mg/mL |
| Fentanyl | 12.5mcg/mL | Remifentanil | 0,25mg/mL |
| Héparine | 20UI/mL | Vérapamil | 0.08mg/mL |
| Isoprotérénol | 4mcg/mL | Sulfate de magnésium | 1mg/mL |
| 200mcg/mL | Chlorure de potassium | 40mEq/L | |
| 4mcg/mL | Vécuronium | 0.1mg/mL | |
| 10mcg/mL | Vérapamil | 0.08mg/mL | |
| Méropénem | 22mg/mL | Chlorure de potassium | 40mEq/L |
| Naloxone | 0,8mcg/mL | Vérapamil | 0.08mg/mL |
| Nitroglycérine | 0,1mg/mL | Vérapamil | 0,08mg/mL |
| Nitroprussiate | 0,2mg/mL | Vécuronium | 0.1mg/mL |
| 0,1mg/mL | Vérapamil | 0,08mg/mL | |
| Noradrénaline | 0,008mg/mL | Vérapamil | 0.08mg/mL |
| Pipéracilline-tazobactam | 40mg/mL | Dexmedetomidine | 4mcg/mL |
| 40mg/mL | Remifentanil | 250mcg/mL | |
| Potassium chlorure | 100mEq/L | Remifentanil | 250mcg/mL |
Il est cohérent avec les cases grises spécifiées comme I/C comme indiqué dans la Fig. 2.
Sélection des études
Après la recherche de référence, 2 examinateurs indépendants ont évalué la qualité des études en utilisant un processus d’examen par les pairs. Cette revue a été réalisée selon des critères de qualité basés sur l’opinion d’experts et suivant les directives de pratique clinique8-11:
-
Reproductibilité de l’étude : description du principe actif et du diluant, conditions de l’étude et méthodologie.
-
Nombre d’essais réalisés (au moins en triplicata).
-
Temps écoulé lors de la prise des échantillons dans l’analyse de stabilité : une période de temps de 5 échantillons est recommandée, y compris un temps d’échantillon de 0,
-
Etudes réalisées pour évaluer la stabilité du mélange : (a) transparence : pour les particules visibles, observation avec un panneau noir mat, comptage automatique des particules ou turbidimétrie ; pour les particules subvisibles, utilisation de la microscopie optique, de la spectrophotométrie ou de la turbidimétrie ; (b) changement de couleur : inspection visuelle ou spectrophotométrie ; (c) formation de gaz : inspection visuelle ; (d) pH ; et (e) stabilité chimique : mesure de la variation de la concentration des 2 médicaments.
Création du tableau des résultats
Un tableau a été créé avec toutes les combinaisons possibles des médicaments d’intérêt. Les cases ont été nommées avec un « C » si le mélange était compatible, avec un « I » si incompatible et avec « I/C » si la stabilité dépendait de conditions spéciales. Les combinaisons de médicaments sans données de compatibilité n’ont pas été cochées.
RésultatsPerformance de la recherche de référence
Un total de 48 articles a été identifié. La figure 1 montre le processus de sélection. Sur les 29 articles inclus dans la revue, 4 étaient rédigés en espagnol, 3 en français et 22 en anglais. Concernant les dates de publication, 8 articles ont été publiés entre 1990 et 1999, 10 entre 2000 et 2009, et les 11 articles restants ont été publiés entre 2010 et 2017.
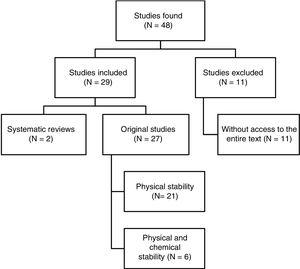
Synthèse structurée des résultats de la recherche de référence.
Qualité des études trouvées
Aucun des articles étudiés ne répondait à tous les critères de qualité établis dans cette revue. Cependant, 93% des articles décrivaient les conditions et la méthodologie de l’étude avec suffisamment de détails pour garantir sa reproductibilité.
Les tests ont été réalisés en triplicata seulement dans 26% des cas. Au contraire, 81% des études ont suivi la recommandation de prélever des échantillons au temps 0, bien que seulement 10 aient obtenu un échantillon en 5 temps différents.
En ce qui concerne les essais réalisés pour évaluer la stabilité des échantillons, toutes les études ont évalué la transparence tandis que 93% des études ont signalé un changement de couleur par inspection visuelle. D’autres méthodes ont été utilisées dans 16 études (59%) pour voir les particules subvisibles. 67% des études ont évalué la formation de gaz, et seulement 12 ont mesuré les changements de pH dans le temps. Seulement 6 études ont évalué la stabilité chimique des mélanges étant la chromatographie liquide à haute résolution la méthode utilisée dans 5 études pour mesurer la concentration des ingrédients actifs du mélange.
Les résultats sur cette section sont résumés dans le tableau 3.
Résumé des critères de qualité des articles publiés.
| Indicateur de qualité | Nombre d’études (%) | |
|---|---|---|
| Évaluation de la formation de précipités | 27 (100) | 12,13,16-40 |
| Evaluation du changement de couleur | 25 (93) | 12,13,16-27,30-40 |
| Mesure du changement de pH | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 |
| Évaluation de la formation de gaz | 18 (67) | 12,13,17,19-21,24-26,31,33-40 |
| Analyse réalisée en trois exemplaires | 7 (26) | 18,21,22,29,34,35,38 |
| Description de la méthodologie utilisée (comprend le nombre et la fréquence des observations et les conditions d’étude) | 24 (89) | 12,13,17-24,26-33,35-40 |
| Description des diluants de tous les médicaments de l’étude | 21 (78) | 13,17-29,33,35-40 |
| Description de la matière des récipients de l’étude | 22 (81) | 12,13,17-31,33,36-39 |
| Stabilité chimique | 6 (22) | 16,18,19,22,29,38 |
Résultats de la compatibilité physique et chimique
Quarante-quatre médicaments utilisés en perfusion continue en milieu de soins intensifs ont été sélectionnés dont une solution de nutrition parentérale avec et sans lipides et 3 antibiotiques de type bêta-lactamines. La compatibilité de ces derniers est présentée dans la figure 2. Les données obtenues par les revues menées par Kanji et al. et López-Cabezas et al. ont fourni des informations sur la compatibilité de 393 des 945 combinaisons possibles.5,7 Après avoir terminé la revue systématique, de nouvelles données sur la stabilité de 82 combinaisons de médicaments ont été ajoutées. Ces nouvelles données ont révélé 29 combinaisons compatibles, 27 combinaisons incompatibles et 26 combinaisons compatibles dans des conditions spécifiques. Par conséquent, le tableau final présente les données de compatibilité de 475 des 945 associations possibles de 2 médicaments (50,3 %). Parmi celles-ci, 366 sont compatibles (77,1%), 80 sont incompatibles (16,8%), et 29 sont compatibles dans des conditions spécifiques (6,1%) comme le montre le tableau 2.

Résumé des compatibilités physiques et chimiques. C, compatible ; I, incompatible ; I/C, compatible dans des conditions particulières. Les cases en pointillés montrent que le mélange est compatible avec le sérum glycosylé uniquement. Les cases avec des lignes diagonales montrent la compatibilité avec le sérum physiologique uniquement.
Discussion
S’assurer que l’utilisation des médicaments est sûre est l’un des principaux engagements pris par les prestataires de soins de santé avec leurs patients. Dans le cadre des soins intensifs et compte tenu de l’énorme quantité de médicaments administrés par voie intraveineuse et du nombre limité de voies d’administration des patients, cette sécurité est parfois compromise en raison des risques encourus lors de la co-administration de médicaments incompatibles chez des patients particulièrement vulnérables.
Les bases de données en ligne comme Stabilis 4.0 sont très utiles pour rechercher des informations sur la compatibilité des médicaments. Cependant, le personnel qui administre les médicaments trouve les fiches beaucoup plus utiles car il peut consulter rapidement les informations dont il a besoin à un moment donné. Ceci est particulièrement intéressant dans les situations d’urgence où tout retard causé par les prestataires de soins peut avoir des conséquences chez le patient.
Cette étude s’est concentrée sur l’analyse de la compatibilité physique et chimique des médicaments IV les plus couramment utilisés par perfusion en Y dans le cadre des soins intensifs et sur la synthèse des informations obtenues dans un tableau à double entrée. Les études de compatibilité physique sont les plus courantes car elles sont faciles à réaliser. Les études de stabilité chimique, en revanche, ne le sont pas car elles nécessitent des techniques analytiques plus sophistiquées pour déterminer la concentration initiale et finale des médicaments.
Malgré cela, le nombre de combinaisons de médicaments étudiées est encore insuffisant. Comme le montre la figure 2, nous n’avons pu trouver aucune information sur la compatibilité physique et chimique de toutes les combinaisons suggérées ; par exemple, dans le cas du flumazénil et de la pipéracilline-tazobactam, nous n’avons pu déterminer la stabilité qu’avec 4 médicaments et, dans les deux cas, les 39 combinaisons restantes sont restées sans information.
Même si nous prenions en considération toutes les combinaisons possibles suggérées et que nous ajoutions les nouvelles données trouvées, nous n’aurions toujours aucune information sur la compatibilité physique et chimique de 470 combinaisons. Cela signifie que nous ne disposons de données que pour 50,3% de toutes les combinaisons possibles suggérées.
Les combinaisons les plus problématiques en matière d’incompatibilité sont les médicaments dont la stabilité est étroitement liée à l’intervalle de pH ; c’est le cas du bicarbonate de sodium, du furosémide ou du pantoprazole. Le furosémide, par exemple, nécessite un pH basique pour garantir la stabilité de la molécule en solution, c’est pourquoi le mélange avec des médicaments acides (pH
4) provoque une turbidité et une précipitation.12
La présence d’adjuvants dans la formulation pharmaceutique, la concentration et l’exposition à des températures extrêmes ou la luminosité sont d’autres facteurs associés à l’incompatibilité des médicaments13. Il arrive qu’une association médicamenteuse donnée soit stable dans un certain diluant et incompatible dans un autre ; par exemple, la dopamine n’est compatible avec l’amiodarone que lorsque les deux sont dissous dans du sérum glycosylé à 5 %, car ce dernier est instable dans des solutions salines à 0,9 %. Ainsi, si ce mélange prétendument compatible est effectué dans du sérum physiologique, une perte de concentration de l’amiodarone peut se produire avec le risque correspondant d’absence de réponse thérapeutique.
D’autre part, dans de nombreux cas, la qualité des études publiées jusqu’à présent peut être meilleure. Il serait bon d’avoir une plus grande uniformité dans les normes de qualité de ce type d’études. Par exemple, même si le pH est un facteur critique dans la stabilité des médicaments en solution, il n’a été vérifié que dans 12 des 27 articles. De même, la turbidimétrie ou la microscopie, techniques plus précises que l’observation visuelle pour la détection des particules et des changements de couleur, sont sous-utilisées. Au cours des dernières années, plusieurs experts ont publié des lignes directrices pour la conception des études de stabilité des médicaments.8-11 Nous ne pouvons qu’espérer que cela améliorera la qualité globale de ce type d’études à l’avenir.
D’anciens auteurs ont publié des revues de ces caractéristiques. Par exemple, Flamein et al.14 ont étudié ce problème dans les unités de soins intensifs néonatals ; Knudsen et al.15 ont fait la lumière sur la compatibilité des analgésiques et des sédatifs. Notre revue est basée sur les travaux antérieurs réalisés par Kanji et al.5 au Canada et López-Cabezas.7 en Espagne. Elle a été complétée par les nouvelles informations disponibles sur les médicaments dans notre contexte et les données sur les concentrations de médicaments les plus utilisées.
Dans l’ensemble, nous avons trouvé des informations sur 82 nouvelles combinaisons de médicaments provenant de 27 références différentes, y compris des combinaisons de 3 antibiotiques bêta-lactamines (ceftazidime, méropénème et pipéracilline-tazobactam) largement utilisées dans le contexte des soins intensifs. Au cours des dernières années, les avantages pharmacocinétiques d’une perfusion prolongée pour l’administration de ces 3 antibiotiques ont été confirmés.16-19
Les perfusions à des concentrations de médicaments supérieures aux concentrations habituelles sont souvent utilisées chez les patients gravement malades. En ce sens, nous n’avons pas pu trouver de données sur toutes les combinaisons de médicaments concernant les concentrations élevées utilisées dans le cadre des soins intensifs (Tableau 1) ; cependant, dans certains cas, nous avons obtenu des informations sur des concentrations plus faibles que celles rapportées dans cette revue. Ces cas sont indiqués sur le tableau de compatibilité (Fig. 2) en tant que compatibilité conditionnée (I/C), c’est-à-dire que l’association a été étudiée à une concentration différente de la concentration standard.
Les données de stabilité rapportées dans cette revue ne peuvent pas être généralisées à d’autres associations de médicaments ou à des concentrations différentes de celles décrites. De plus, les informations fournies concernent 2 associations de médicaments, et des incompatibilités peuvent être présentes avec>2 associations de médicaments à la fois, ce qui est fortement déconseillé. Néanmoins, les médicaments et les concentrations sélectionnés sont les plus largement utilisés dans les unités de soins intensifs pour adultes de la plupart des hôpitaux.
En attendant que de nouvelles et meilleures études de compatibilité fassent la lumière sur cette question, cette revue peut être une mise à jour facile à lire sur les preuves disponibles sur la compatibilité des médicaments les plus couramment utilisés dans les unités de soins intensifs. Son objectif est de contribuer à l’administration sûre des médicaments aux patients qui peuvent faire face à des conséquences de plus grande gravité en raison de leur fragilité.
Contribution des auteurs
Genís Castells Lao : conception et idée de l’étude, exploration des données, analyse et interprétation des données ; ébauche du papier ou révision critique du matériel intellectuel ; et approbation finale de cette version.
Montse Rodríguez Reyes : conception et idée de l’étude, exploration des données, analyse et interprétation des données ; ébauche de papier ou revue critique du matériel intellectuel ; et approbation finale de cette version.
Judit Roura Turet : exploration des données, analyse et interprétation des données ; ébauche de papier ou revue critique du matériel intellectuel ; et approbation finale de cette version.
Marta Prat Dot : exploration des données, analyse et interprétation des données ; ébauche de papier ou revue critique du matériel intellectuel ; et approbation finale de cette version.
Dolors Soy Muner : conception et idée de l’étude ; ébauche de papier ou revue critique du matériel intellectuel ; et approbation finale de cette version.
Carmen López Cabezas : conception et idée de l’étude, exploration des données, analyse et interprétation des données ; ébauche de papier ou revue critique du matériel intellectuel ; et approbation finale de cette version.
Conflits d’intérêts
Les auteurs n’ont déclaré aucun conflit d’intérêts de quelque nature que ce soit.