Introductie
Patiënten die op intensive care units (ICU) worden opgenomen, hebben vaak IV-toediening van verschillende geneesmiddelen nodig. Vasoactieve geneesmiddelen, analgetica en sedativa behoren tot de meest gebruikte therapeutische groepen en worden gewoonlijk in continue infusie toegediend.
Volgens de systematische review van Moyen et al. is er een gemiddelde van 1,7 fouten/dag verbonden aan het proces van medicatietoediening op de IC.1 Aan de andere kant zijn de gegevens van Merino et al. in een studie uitgevoerd onder Spaanse ziekenhuis-ICU’s iets beter (1,13 medicatiefouten per 100 patiënten/dag).2 Desondanks komen medicatiefouten vaak voor op ICU’s en vereisen zorg van zorgverleners om ze te minimaliseren.
Fouten bij de toediening van geneesmiddelen op IC’s zijn te wijten aan verschillende factoren: het gebruik van geneesmiddelen met een hoog risico (vasoactieve geneesmiddelen, inotrope middelen, sedativa, enz.) die vaak in lage doses worden toegediend vanwege hun hoge geneesmiddelsterkte, waardoor verdunning en een voorafgaande beoordeling voor de toediening ervan nodig zijn. Een andere factor is het voorschrijven van doses in verschillende meeteenheden of het grote aantal geneesmiddelen dat bij elke patiënt wordt gebruikt. Hoewel het een belangrijke vooruitgang is op het gebied van de veiligheid, is het gebruik van intelligente infuuspompen in verband gebracht met een groot aantal medicatiefouten als gevolg van programmeringsproblemen.3
De combinatie van deze risicofactoren verhoogt de kans op fouten bij de meest kwetsbare patiënten als gevolg van hun ernst. Kritiek zieke patiënten hebben vaak beperkte veneuze toegangen. Dit betekent dat verschillende geneesmiddelen via dezelfde toedieningsweg worden toegediend, waardoor de risico’s bij het mengen van incompatibele geneesmiddelen toenemen. Het mengen van incompatibele geneesmiddelen is een medicatiefout die ernstige gevolgen voor de patiënt kan hebben, zoals therapeutisch falen, micro-embolie of toxiciteit.4
Voor de Y-site infusie van 2 geneesmiddelen moeten beide geneesmiddelen fysisch compatibel zijn.5 Deze co-toediening vindt plaats bij het mengen van geneesmiddelen in een 1:1 verhouding en bij afwezigheid van zichtbare tekenen van incompatibiliteit zoals neerslag of verandering van kleur. Anderzijds moet voor een veilige gelijktijdige toediening van 2 geneesmiddelen in dezelfde verdunningsvloeistof het mengsel chemisch stabiel zijn. Dit betekent dat vooraf bevestigd moet worden dat er geen significante verandering is opgetreden in de concentratie van een van beide geneesmiddelen in het mengsel.6
Het standaardiseren van de concentratie van infusieoplossingen is een van de nuttigste maatregelen om medicatiefouten in de IC-setting te voorkomen, vooral bij geneesmiddelen met een hoog risico, omdat ze ernstige schade kunnen veroorzaken en omdat ze de hoogste incidentie van medicatiefouten hebben.
Een andere sterk aanbevolen maatregel voor de veilige toediening van geneesmiddelen is het beschikbaar hebben van betrouwbare informatie over de verenigbaarheid van geneesmiddelen bij de toediening van veelgebruikte geneesmiddelen bij ernstig zieke patiënten. Informatie over de verenigbaarheid van geneesmiddelen is echter schaars en in veel gevallen moeilijk te interpreteren vanwege de verschillende gebruikte concentraties, het gebrek aan informatie over de gebruikte beoordelingstechnieken of de verdachte technische kwaliteit van de bronnen. Het gebrek aan informatie over de veilige mix van 2 geneesmiddelen levert problemen op in het dagelijkse werk van IC-verpleegteams. Naast het risico van complicaties die gepaard gaan met de toediening van 2 incompatibele moleculen, kan dit gebrek aan informatie ervoor zorgen dat de verpleegkundige op zoek moet naar nieuwe veneuze toegangen om de geneesmiddelen afzonderlijk toe te dienen, wat het risico op infectieuze of trombo-embolische complicaties verhoogt.
Het doel van deze review is het verzamelen van de gepubliceerde informatie over de fysische en chemische compatibiliteit van de meest gebruikte geneesmiddelen op een IC wanneer ze via dezelfde lijn via een Y-site worden toegediend. Ook om de kwaliteit van de gepubliceerde informatie te beoordelen en een compatibiliteitstabel te genereren met betrouwbare en bijgewerkte informatie om de veiligheid bij het toedienen van geneesmiddelen aan kritisch zieke patiënten te verbeteren.
MethodologieZoekstrategie
Een systematische zoekactie op Medline, Stabilis, Handbook on Injectable Drugs, en Micromedex databases werd uitgevoerd voor het identificeren van originele papers, review artikelen en meta-analyses over de fysische en chemische compatibiliteit van geneesmiddelen. Vanwege hun klinische benadering en gebrek aan methodologie om de fysische en chemische stabiliteit te bepalen, werden casestudies buiten beschouwing gelaten. De reviews gepubliceerd door Kanji et al. en López-Cabezas et al.5,7 werden als referentiepunt gebruikt. Er werd gezocht naar geneesmiddelencombinaties waarover deze auteurs geen informatie hadden of geen informatie hadden opgezocht. De jaren van publicatie van de studies liepen van de jaren 1990 tot december 2017 en de opgenomen talen waren Engels, Spaans en Frans. De zoekstrategie bestond uit het gebruik van meerdere termen die de informatie van belang beschrijven om deze te combineren met de Booleaanse operator “OR” gevolgd door het verfijnen van het zoeken met behulp van de “AND” operator. De gebruikte termen waren fysische compatibiliteit, stabiliteit van het geneesmiddel, y-site, y-injectie, intraveneus geneesmiddel, plus de namen en synoniemen van de geneesmiddelen van belang.
De geneesmiddelen die in de review werden gebruikt, worden routinematig gebruikt in de IC-setting en worden vaak toegediend via continue infusie. De concentraties die als referentie zijn gebruikt, zijn de concentraties die in ons centrum7 voor deze geneesmiddelen zijn gestandaardiseerd en komen overeen met de concentraties die in de meeste ICU’s worden gebruikt (tabel 1). Alle informatie over de compatibiliteit die voor een bepaald molecuul over een ander concentratie-interval is gevonden, staat in tabel 2. Het zoeken naar referenties voor elk geneesmiddel werd gelijktijdig uitgevoerd door 2 onafhankelijke onderzoekers.
Gebruikte geneesmiddelen en concentraties als referentie voor het bibliografisch zoeken.
| Drug | Standaardconcentratie | Drug | Standaardconcentratie |
|---|---|---|---|
| Adrenaline | 40mcg/mL | Isoproterenol | 4mcg/mL |
| Amiodarone | 3.6mg/mL | Ketamine | 50mg/mL |
| Argatroban | 1mg/mL | Labetalol | 2mg/mL |
| Bicarbonaat | 1mmol/L | Magnesium sulfaat | 15mg/mL |
| Calciumchloride | 10mg/mL | Meropenem | 30mg/mL |
| Calciumgluconaat | 10mg/mL | Methadon | 0.2mg/mL |
| Ceftazidime | 24mg/mL | Midazolam | 4mg/mL |
| Cisatracurium | 2mg/mL | Milrinone | 0.2mg/mL |
| Clonidine | 7.5mcg/mL | N-acetylcysteïne | 50mg/mL |
| Morfinechloride | 1mg/mL | Naloxon | 8mcg/mL |
| Dexmedetomidine | 4mcg/mL | Nitroglycerine | 0.2mg/mL |
| Diltiazem | 1mg/mL | Nitroprusside | 0.2mg/mL |
| Dobutamine | 8mg/mL | Noradrenaline | 0.32mg/mL |
| Dopamine | 8mg/mL | Pantoprazol | 0.32mg/mL |
| Esomeprazol | 0.32mg/mL | Piperacillin-tazobactam | 64mg/mL |
| Phenylephrine | 0.2mg/mL | Kaliumchloride | 120mEq/L |
| Fentanyl | 30mcg/mL | Propofol | 10mg/mL |
| Flumazenil | 40mcg/mL | Remifentanil | 20mcg/mL |
| Furosemide | 2mg/mL | Somatostatine | 24mcg/mL |
| Natriumheparine | 50IU/mL | Vecuronium | 0.2mg/mL |
| Insuline | 1IU/mL | Verapamil | 0.1mg/mL |
Combinaties van fysische en chemisch compatibele geneesmiddelen met concentraties onder de referentiemarkering.
| Drug#1 | Maximale verenigbare concentratie | Drug#2 | Maximale verenigbare concentratie |
|---|---|---|---|
| Adrenaline | 32mcg/mL | Pantoprazol | 0.8mg/mL |
| 2mcg/mL | Verapamil | 0.08mg/mL | |
| Amiodarone | 4mg/mL | Phenylephrine | 0.04mg/mL |
| 6mg/mL | Furosemide | 1mg/mL | |
| 15mg/mL | Nitroprusside | 0.3mg/mL | |
| Calciumchloride | 4mg/mL | Dobutamine | 4mg/mL |
| Calciumgluconaat | 4mg/mL | Dobutamine | 4mg/mL |
| Ceftazidime | 120mg/mL | Dobutamine | 1mg/mL |
| 120mg/mL | Dopamine | 0.4mg/mL | |
| 125mg/mL | Ketamine | 10mg/mL | |
| Dobutamine | 1mg/mL | Heparine | 50IU/mL |
| 4mg/mL | Magnesiumsulfaat | 40mg/mL | |
| 4mg/mL | Kaliumchloride | 60mEq/L | |
| Dopamine | 3.2mg/mL | Midazolam | 2mg/mL |
| Fentanyl | 12.5mcg/mL | Remifentanil | 0.25mg/mL |
| Heparine | 20IU/mL | Verapamil | 0.08mg/mL |
| Isoproterenol | 4mcg/mL | Magnesiumsulfaat | 1mg/mL |
| 200mcg/mL | Kaliumchloride | 40mEq/L | |
| 4mcg/mL | Vecuronium | 0.1mg/mL | |
| 10mcg/mL | Verapamil | 0.08mg/mL | |
| Meropenem | 22mg/mL | Kaliumchloride | 40mEq/L |
| Naloxone | 0.8mcg/mL | Verapamil | 0.08mg/mL |
| Nitroglycerine | 0.1mg/mL | Verapamil | 0.08mg/mL |
| Nitroprusside | 0.2mg/mL | Vecuronium | 0.1mg/mL |
| 0.1mg/mL | Verapamil | 0.08mg/mL | |
| Noradrenaline | 0.008mg/mL | Verapamil | 0.08mg/mL |
| Piperacillin-tazobactam | 40mg/mL | Dexmedetomidine | 4mcg/mL |
| 40mg/mL | Remifentanil | 250mcg/mL | |
| Potassium chloride | 100mEq/L | Remifentanil | 250mcg/mL |
Het is consistent met de grijze vakken die zijn gespecificeerd als I/C zoals weergegeven in Fig. 2.
Selectie van studies
Na het zoeken naar referenties beoordeelden 2 onafhankelijke beoordelaars de kwaliteit van de studies aan de hand van een peer-reviewproces. Deze beoordeling werd uitgevoerd aan de hand van kwaliteitscriteria op basis van het advies van deskundigen en volgens de richtlijnen voor klinische praktijken8-11:
-
Reproduceerbaarheid van de studies: beschrijving van werkzame stof en verdunningsmiddel, studieomstandigheden en methodologie.
-
Aantal uitgevoerde tests (ten minste in drievoud).
-
Tijden die verstrijken bij het nemen van de monsters in het stabiliteitsonderzoek: een bemonsteringstijd van vijf keer wordt aanbevolen, met inbegrip van een bemonsteringstijd van 0.
-
Studies die zijn uitgevoerd om de stabiliteit van het mengsel te beoordelen: (a) transparantie: voor zichtbare deeltjes, waarneming met een matzwart paneel, automatische telling van de deeltjes of turbidimetrie; voor subzichtbare deeltjes, gebruik van optische microscopie, spectrofotometrie of turbidimetrie; b) verandering van kleur: visuele inspectie of spectrofotometrie; c) gasvorming: visuele inspectie; d) pH; en e) chemische stabiliteit: meting van de variatie in de concentratie van de 2 geneesmiddelen.
Samenstellen van de resultatenkaart
Er werd een kaart gemaakt met alle mogelijke combinaties van de betrokken geneesmiddelen. De vakjes werden benoemd met een “C” als het mengsel verenigbaar was, met een “I” als het niet verenigbaar was en met “I/C” als de stabiliteit afhing van speciale voorwaarden. De geneesmiddelencombinaties zonder compatibiliteitsgegevens werden niet aangevinkt.
ResultatenUitvoering van referentie-onderzoek
Er werden in totaal 48 papers geïdentificeerd. Fig. 1 toont het selectieproces. Van de 29 artikelen die in de review werden opgenomen, waren er 4 in het Spaans geschreven, 3 in het Frans en 22 in het Engels. Wat de publicatiedatum betreft, werden 8 papers gepubliceerd tussen 1990 en 1999, 10 tussen 2000 en 2009, en de overige 11 papers werden gepubliceerd tussen 2010 en 2017.
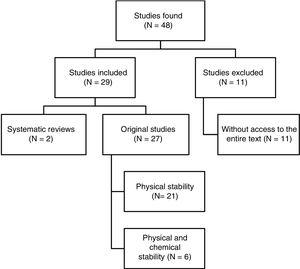
Gestructureerde samenvatting van de resultaten van de referentiezoekactie.
Kwaliteit van de gevonden studies
Geen van de bestudeerde papers voldeed aan alle kwaliteitscriteria die in deze review zijn vastgesteld. In 93% van de artikelen werden echter de omstandigheden en methodologie van het onderzoek voldoende gedetailleerd beschreven om de reproduceerbaarheid ervan te garanderen.
Tests werden slechts in 26% van de gevallen in drievoud uitgevoerd. Integendeel, 81% van de studies volgde de aanbeveling om monsters op tijdstip 0 te nemen, hoewel slechts 10 een monster op 5 verschillende tijdstippen verkregen.
Wat betreft de proeven die werden uitgevoerd om de stabiliteit van de monsters te beoordelen, beoordeelden alle studies de doorzichtigheid, terwijl 93% van de studies een verandering in kleur rapporteerde door visuele inspectie. In 16 studies (59%) werden andere methoden gebruikt om subzichtbare deeltjes te zien. 67% van de studies beoordeelde de gasvorming, en slechts 12 maten pH-veranderingen in de tijd. Slechts 6 studies beoordeelden de chemische stabiliteit van de mengsels, waarbij hoge-resolutie vloeistofchromatografie de in 5 studies gebruikte methode was om de concentratie van de actieve bestanddelen van het mengsel te meten.
De resultaten op dit punt zijn samengevat in tabel 3.
Samenvatting van de kwaliteitscriteria van de gepubliceerde artikelen.
| Kwaliteitsindicator | Aantal studies (%) | |
|---|---|---|
| Beoordeling van de vorming van neerslag | 27 (100) | 12,13,16-40 |
| Beoordeling van kleurverandering | 25 (93) | 12,13,16-27,30-40 |
| Meting van verandering in pH | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 |
| Beoordeling van gasvorming | 18 (67) | 12.,13,17,19-21,24-26,31,33-40 |
| Analyse uitgevoerd in drievoud | 7 (26) | 18,21,22,29,34,35,38 |
| Beschrijving van de gebruikte methodologie (met inbegrip van aantal en frequentie van waarnemingen en studieomstandigheden) | 24 (89) | 12,13,17-24,26-33,35-40 |
| Beschrijving van de verdunners van alle studiegeneesmiddelen | 21 (78) | 13,17-29,33,35-40 |
| Beschrijving van het materiaal van de studieontvangers | 22 (81) | 12,13,17-31,33,36-39 |
| Chemische stabiliteit | 6 (22) | 16,18,19,22,29,38 |
Resultaten van fysische en chemische compatibiliteit
Vierenveertig geneesmiddelen die bij continue perfusie op de IC werden gebruikt, werden geselecteerd, waaronder een oplossing voor parenterale voeding met en zonder lipiden en 3 beta-lactam antibiotica. De compatibiliteit hiervan is weergegeven in fig. 2. De gegevens verkregen door de reviews uitgevoerd door Kanji et al. en López-Cabezas et al. leverden compatibiliteitsinformatie op voor 393 van de 945 mogelijke combinaties.5,7 Na voltooiing van de systematische review werden nieuwe stabiliteitsgegevens voor 82 geneesmiddelencombinaties toegevoegd. De nieuwe bevindingen onthulden 29 verenigbare combinaties, 27 onverenigbare combinaties, en 26 verenigbare combinaties onder specifieke omstandigheden. De definitieve tabel toont daarom de compatibiliteitsgegevens van 475 van de 945 mogelijke combinaties van 2 geneesmiddelen (50,3%). Hiervan zijn er 366 verenigbaar (77,1%), 80 onverenigbaar (16,8%), en 29 verenigbaar in specifieke omstandigheden (6,1%), zoals blijkt uit tabel 2.

Samenvatting van fysische en chemische verenigbaarheid. C, verenigbaar; I, onverenigbaar; I/C, verenigbaar onder speciale omstandigheden. Gestippelde vakjes geven aan dat het mengsel alleen compatibel is met geglycosyleerd serum. Vakjes met diagonale lijnen geven aan dat het mengsel alleen compatibel is met fysiologisch serum.
Discussie
Zorgen dat het gebruik van geneesmiddelen veilig is, is een van de belangrijkste verbintenissen die zorgverleners met hun patiënten aangaan. In de IC-setting en gezien de enorme hoeveelheid IV-geneesmiddelen die worden toegediend en het beperkte aantal toedieningswegen van de patiënten, komt deze veiligheid soms in het gedrang door de risico’s die verbonden zijn aan het gelijktijdig toedienen van incompatibele geneesmiddelen bij bijzonder kwetsbare patiënten.
Online databanken zoals Stabilis 4.0 zijn zeer nuttig om informatie over de compatibiliteit van geneesmiddelen op te zoeken. Het personeel dat de geneesmiddelen toedient, vindt grafieken echter veel nuttiger omdat het snel de informatie kan bekijken die het op een bepaald moment nodig heeft. Dit is vooral interessant in dringende situaties, wanneer elke vertraging die door de zorgverleners wordt veroorzaakt, gevolgen kan hebben voor de patiënt.
Dit onderzoek richtte zich op het analyseren van de fysische en chemische compatibiliteit van de IV-geneesmiddelen die het meest worden gebruikt via Y-site infusie in de IC-setting en het samenvatten van de verkregen informatie in een dubbel ingevoerde grafiek. Fysische compatibiliteitsstudies zijn de meest voorkomende van allemaal omdat ze gemakkelijk uit te voeren zijn. Chemische stabiliteitsstudies zijn dat echter niet, omdat daarvoor meer verfijnde analysetechnieken nodig zijn om de begin- en eindconcentratie van geneesmiddelen te bepalen.
Desondanks is het aantal bestudeerde geneesmiddelencombinaties nog steeds onvoldoende. Zoals uit fig. 2 blijkt, konden wij geen informatie vinden over de fysische en chemische verenigbaarheid van alle voorgestelde combinaties; in het geval van flumazenil en piperacilline-tazobactam bijvoorbeeld konden wij slechts de stabiliteit met 4 geneesmiddelen bepalen en in beide gevallen bleven de 39 resterende combinaties zonder informatie.
Zelfs als wij alle voorgestelde mogelijke combinaties in aanmerking zouden nemen en de nieuw gevonden gegevens zouden toevoegen, zouden wij nog steeds over nul informatie beschikken over de fysische en chemische verenigbaarheid van 470 combinaties. Dit betekent dat we slechts over gegevens beschikken voor 50,3% van alle voorgestelde mogelijke combinaties.
De meest problematische combinaties met betrekking tot onverenigbaarheid zijn geneesmiddelen waarvan de stabiliteit nauw samenhangt met het pH-interval; dit is het geval met natriumbicarbonaat, furosemide of pantoprazol. Furosemide bijvoorbeeld heeft een basische pH nodig om de stabiliteit van de molecule in oplossing te garanderen; daarom veroorzaakt de mix met zure geneesmiddelen (pH
4) troebelheid en precipitatie.12
De aanwezigheid van hulpstoffen in de farmaceutische formulering, de concentratie en de blootstelling aan extreme temperaturen of lichtsterkte zijn andere factoren die in verband worden gebracht met de incompatibiliteit van geneesmiddelen.13 Het komt voor dat een bepaalde combinatie van geneesmiddelen stabiel is in een bepaald verdunningsmiddel en onverenigbaar in een ander; zo is dopamine alleen verenigbaar met amiodaron wanneer beide worden opgelost in geglycosyleerd serum van 5%, omdat dit laatste instabiel is in zoutoplossingen van 0,9%. Wanneer dit zogenaamd compatibele mengsel in fysiologisch serum wordt uitgevoerd, kan er dus een concentratieverlies van amiodaron optreden met het overeenkomstige risico dat de therapeutische respons uitblijft.
Anderzijds kan de kwaliteit van de tot dusver gepubliceerde studies in vele gevallen beter. Het zou goed zijn als er meer uniformiteit zou komen in de kwaliteitsnormen van dit soort studies. Bijvoorbeeld, hoewel de pH een kritische factor is voor de stabiliteit van geneesmiddelen in oplossing, werd deze slechts in 12 van de 27 studies geverifieerd. Ook turbidimetrie of microscopie – nauwkeuriger technieken dan visuele waarneming voor de detectie van deeltjes en kleurveranderingen – worden te weinig gebruikt. De laatste jaren hebben verschillende deskundigen richtsnoeren gepubliceerd voor de opzet van stabiliteitsstudies van geneesmiddelen.8-11 We kunnen alleen maar hopen dat dit de algemene kwaliteit van dit soort studies in de toekomst zal verbeteren.
Voormalige auteurs hebben beoordelingen van deze kenmerken gepubliceerd. Zo hebben Flamein et al.14 dit probleem in neonatale IC’s bestudeerd; Knudsen et al.15 hebben licht geworpen op de verenigbaarheid van analgetica en sedativa. Ons overzicht is gebaseerd op het eerdere werk van Kanji et al.5 in Canada en López-Cabezas.7 in Spanje. Het is aangevuld met de nieuwe informatie die beschikbaar is over geneesmiddelen in onze setting en gegevens over de meest gebruikte concentraties van geneesmiddelen.
In totaal vonden we informatie over 82 nieuwe geneesmiddelencombinaties uit 27 verschillende referenties, waaronder combinaties van 3 beta-lactam antibiotica (ceftazidime, meropenem, en piperacillin-tazobactam) die op grote schaal worden gebruikt in de IC-setting. De laatste jaren zijn de farmacokinetische voordelen van een verlengde perfusieroute voor de toediening van deze 3 antibiotica bevestigd.16-19
Perfusies met geneesmiddelconcentraties die hoger zijn dan de gebruikelijke worden vaak gebruikt bij de kritisch zieke patiënt. In die zin konden wij niet over alle geneesmiddelencombinaties gegevens vinden betreffende de hoge concentraties die in de IC-setting worden gebruikt (tabel 1); in sommige gevallen hebben wij echter wel informatie verkregen over lagere concentraties dan die welke in dit overzicht zijn gerapporteerd. Deze gevallen worden op de compatibiliteitskaart (Fig. 2) weergegeven als geconditioneerde compatibiliteit (I/C), d.w.z. dat de combinatie is onderzocht bij een concentratie die afwijkt van de standaardconcentratie.
De stabiliteitsgegevens die in dit overzicht zijn gerapporteerd, kunnen niet worden gegeneraliseerd naar andere geneesmiddelencombinaties of andere concentraties dan de beschreven combinaties. Ook heeft de verstrekte informatie betrekking op 2 geneesmiddelencombinaties, en er kunnen zich onverenigbaarheden voordoen met>2 geneesmiddelencombinaties tegelijk, wat zeer af te raden is. Niettemin zijn de geselecteerde geneesmiddelen en concentraties de meest gebruikte in de ICU’s voor volwassenen van de meeste ziekenhuizen.
Totdat we nieuwe en betere compatibiliteitsstudies hebben die enig licht werpen op deze kwestie, kan dit overzicht een gemakkelijk leesbare update zijn van het beschikbare bewijs over de compatibiliteit van de meest gebruikte geneesmiddelen in de ICU-setting. Het doel is om bij te dragen aan de veilige toediening van geneesmiddelen aan patiënten die te maken kunnen krijgen met de gevolgen van een grotere ernst als gevolg van hun broosheid.
Bijdrage van de auteurs
Genís Castells Lao: studieopzet en idee, data mining, analyse en interpretatie van gegevens; paper draft of kritische beoordeling van het intellectuele materiaal; en uiteindelijke goedkeuring van deze versie.
Montse Rodríguez Reyes: onderzoeksopzet en -idee, datamining, analyse en interpretatie van gegevens; ontwerppaper of kritische beoordeling van het intellectuele materiaal; en definitieve goedkeuring van deze versie.
Judit Roura Turet: datamining, analyse en interpretatie van gegevens; ontwerppaper of kritische beoordeling van het intellectuele materiaal; en definitieve goedkeuring van deze versie.
Marta Prat Dot: datamining, analyse en interpretatie van gegevens; paper draft of kritische beoordeling van het intellectuele materiaal; en definitieve goedkeuring van deze versie.
Dolors Soy Muner: onderzoeksopzet en idee; paper draft of kritische beoordeling van het intellectuele materiaal; en definitieve goedkeuring van deze versie.
Carmen López Cabezas: studieopzet en idee, datamining, analyse en interpretatie van gegevens; paper draft of kritische beoordeling van het intellectuele materiaal; en definitieve goedkeuring van deze versie.
Belangenconflicten
De auteurs verklaarden dat er geen sprake was van belangenconflicten.