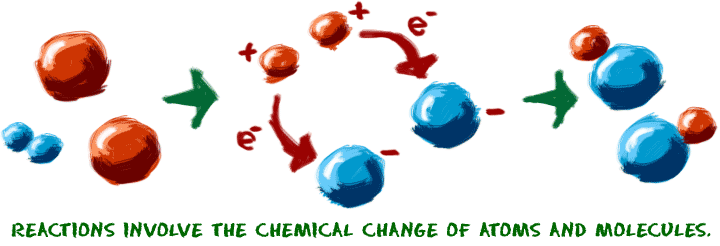
Comencemos con la idea de una reacción química. Las reacciones se producen cuando dos o más moléculas interactúan y las moléculas cambian. Los enlaces entre los átomos se rompen y se crean para formar nuevas moléculas. Eso es todo. ¿Qué moléculas son? ¿Cómo interactúan? ¿Qué ocurre? Las posibilidades son infinitas.
Cuando intentas entender las reacciones químicas, imagina que estás trabajando con los átomos. Imagina que los bloques de construcción están justo delante de ti en la mesa. A veces utilizamos nuestros juguetes de química para ayudarnos a visualizar el movimiento de los átomos. Enchufamos y desenchufamos los pequeños conectores que representan los enlaces químicos. Hay algunos puntos clave que debes conocer sobre las reacciones químicas:
1. Debe producirse un cambio químico. Se empieza con una molécula y se convierte en otra. Los enlaces químicos se hacen o se rompen para crear una nueva molécula. Un ejemplo de reacción química es la oxidación de un cubo de basura de acero. Esa oxidación se produce porque el hierro (Fe) del metal se combina con el oxígeno (O2) de la atmósfera. Los enlaces químicos se crean y se destruyen para finalmente hacer óxido de hierro (Fe2O3).  Cuando un refrigerador o un acondicionador de aire enfrían el aire, no hay ninguna reacción en las moléculas de aire. El cambio de temperatura es un cambio físico. Cuando se derrite un cubito de hielo, es un cambio físico. Cuando pones lejía en la lavadora para limpiar tu ropa, un cambio químico rompe las moléculas de las manchas.
Cuando un refrigerador o un acondicionador de aire enfrían el aire, no hay ninguna reacción en las moléculas de aire. El cambio de temperatura es un cambio físico. Cuando se derrite un cubito de hielo, es un cambio físico. Cuando pones lejía en la lavadora para limpiar tu ropa, un cambio químico rompe las moléculas de las manchas.
2. Una reacción puede incluir átomos, iones, compuestos o moléculas de un solo elemento. Debes recordar que una reacción química puede ocurrir con cualquier cosa, siempre y cuando se produzca un cambio químico. Si pones gas hidrógeno puro (H2) y gas oxígeno puro en una habitación, podrían participar en una reacción para formar agua (H2O). Sin embargo, será en cantidades muy muy pequeñas. Si se añadiera una chispa, esos gases participarían en una violenta reacción química que daría lugar a una enorme explosión (exotérmica). Otra reacción química podría incluir iones de plata (Ag+). Si mezclas una solución con iones de plata con una solución que tiene iones de cloruro (Cl-), se formará un precipitado de cloruro de plata (AgCl) que caerá fuera de la solución.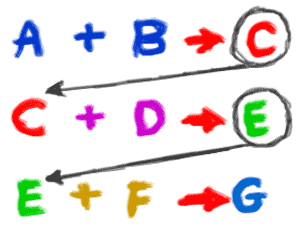 3. Las reacciones individuales a menudo ocurren como parte de una serie mayor de reacciones. Cuando una planta produce azúcares, puede haber hasta una docena de reacciones químicas para pasar por el ciclo de Calvin y finalmente crear (sintetizar) moléculas de glucosa (C6H12O6). El ejemplo de la oxidación que usamos antes sólo te mostró los reactivos originales y los productos finales de la reacción química. Hubo varias reacciones intermedias en las que se crearon y destruyeron enlaces químicos. El ejemplo del cloruro de plata sólo se centró en los iones. En realidad, las dos soluciones se crearon cuando dos sales se disociaron (se dividieron en iones) en el agua.
3. Las reacciones individuales a menudo ocurren como parte de una serie mayor de reacciones. Cuando una planta produce azúcares, puede haber hasta una docena de reacciones químicas para pasar por el ciclo de Calvin y finalmente crear (sintetizar) moléculas de glucosa (C6H12O6). El ejemplo de la oxidación que usamos antes sólo te mostró los reactivos originales y los productos finales de la reacción química. Hubo varias reacciones intermedias en las que se crearon y destruyeron enlaces químicos. El ejemplo del cloruro de plata sólo se centró en los iones. En realidad, las dos soluciones se crearon cuando dos sales se disociaron (se dividieron en iones) en el agua.
Wikipedia: Reacciones químicas
Encyclopedia.com: Chemical Reactions
Rhode Island College: Reactions