Introducción
El análisis de la variabilidad de la frecuencia cardíaca (VFC) proporciona información sobre la regulación autonómica y las interacciones entre los sistemas nerviosos simpático y parasimpático. La VFC describe las variaciones de la frecuencia cardíaca a lo largo del tiempo que se producen de forma natural en estados saludables. Estas variaciones reflejan la capacidad del organismo para ajustarse continuamente a los acontecimientos internos y externos, con el fin de mantener la homeostasis. Curiosamente, Chrousos y Gold (1992, p. 1245) definieron el estrés como un «estado de homeostasis amenazada». Por lo tanto, a lo largo de los años se ha supuesto que una disminución de la VFC refleja un aumento del estrés y el análisis de la VFC ha sido reconocido cada vez más como una de las metodologías para medir el estrés.
Una de las mediciones más sencillas de la VFC (SDNN) cuantifica la desviación estándar de la duración de los intervalos RR normales, es decir, cómo varía el intervalo entre los picos R normales (sinusales) de QRS consecutivos en el electrocardiograma (ECG) con el tiempo. No obstante, a lo largo de los años se han desarrollado numerosas métricas y enfoques matemáticos para el análisis de la VFC con el fin de extraer información cada vez más precisa de la VFC (Shaffer y Ginsberg, 2017).
El análisis de la VFC en el dominio del tiempo se centra en la variación de los intervalos NN (es decir, los intervalos RR normales) a lo largo del tiempo. Además del SDNN, los estudios de VFC examinan con frecuencia el cuadrado medio de las diferencias sucesivas (RMSSD) o el porcentaje de intervalos que difieren del anterior en más de 50 ms (pNN50) o 20 ms (pNN20). Para todas estas métricas de VFC en el dominio del tiempo, los valores más altos reflejan una mayor variabilidad, que es más frecuente en los estados sanos.
El análisis no lineal o geométrico de la VFC puede realizarse trazando los intervalos NN en un gráfico de Poincaré, donde cada intervalo NN se traza en relación con el intervalo NN anterior (Golińska, 2013) y la desviación estándar del grupo principal de puntos de datos se mide en sentido transversal (SD1) o longitudinal (SD2). Se han desarrollado métricas como el índice simpático cardíaco (CSI) y el índice vago cardíaco (CVI) para reflejar las interacciones entre SD1 y SD2 (Toichi et al., 1997). El CSI se comporta de forma opuesta al CVI, por lo que, a diferencia de la mayoría de las demás métricas de la VFC, un CSI más alto se asocia a una menor variabilidad, es decir, a un mayor estrés. Otras métricas geométricas son el índice triangular (TINN) y el índice de VFC. Al igual que el SDNN, estos dos parámetros indican una medida de la variabilidad global durante el periodo de registro. El TINN mide la anchura normalizada de la base del histograma de los intervalos NN (en relación con el valor más alto del histograma NN) y el Índice VFC es una relación entre el número de todos los intervalos NN y el número de intervalos NN en el punto más alto del histograma NN (normalizado a una tasa de muestreo de 128 valores por segundo). En el análisis del dominio de la frecuencia, se analizan las diferentes bandas del espectro de potencia del ECG, así como sus interacciones (entre bandas y en relación con la potencia total). En los adultos, los estudios anteriores han definido cuatro bandas de frecuencia de interés: Frecuencia ultrabaja (ULF), frecuencia muy baja (VLF), frecuencia baja (LF) y frecuencia alta (HF), cada una de las cuales se considera que tiene diferentes orígenes fisiológicos. La ULF se ha asociado a las oscilaciones circadianas de la temperatura corporal central y a la regulación de la renina-angiotensina; la VLF se ha asociado a la regulación a largo plazo de la termorregulación y a los mecanismos hormonales; la LF se ha asociado a una mezcla de actividad simpática y vagal y a la actividad de los barorreceptores y la HF se ha asociado a la actividad vagal (Pomeranz et al., 1985). Sin embargo, la definición y el significado de la ULF y la VLF en los bebés está poco documentada y, por lo tanto, no se incluye en este informe. Aunque las cuantificaciones absolutas de la potencia en las bandas HF y LF pueden aumentar/disminuir, bajo una conductividad cardíaca normal esperamos que LFn y HFn (que son LF y HF normalizadas a la potencia total) se comporten en direcciones opuestas en la mayoría de los casos. Por lo tanto, mientras que se espera que la HFn (que representa la actividad parasimpática) sea mayor cuando el estrés fisiológico es bajo, se espera que la LFn sea mayor cuando el estrés es alto. Estas asociaciones son, sin embargo, controvertidas (von Rosenberg et al., 2017; Adjei et al., 2019) y la interpretación de los hallazgos de LF y HF en escenarios de la vida real requiere precaución.
El análisis de la variabilidad de la frecuencia cardíaca ha sido ampliamente aceptado como un método para medir el deterioro autonómico y cada vez más examinado con respecto a su valor en la estratificación de la enfermedad (Ahmad et al., 2009; Lees et al., 2018; Oliveira et al., 2018). Aunque estudios anteriores han descrito valores normativos de referencia de la VFC para los recién nacidos en los primeros días (Mehta et al., 2002; Longin et al., 2005; Doyle et al., 2009; Makarov et al., 2010; Lucchini et al., 2019), faltan investigaciones sobre la VFC durante las horas iniciales después del nacimiento. Estos estudios han registrado en su mayoría solo unos minutos de ECG durante el primer día o comienzan solo más allá de las 12 h de edad y ninguno ha descrito las tendencias continuas de la VFC durante las primeras 24 h de vida.
Sin embargo, para algunas afecciones, en particular las que se producen debido a complicaciones del nacimiento y que requieren decisiones sensibles al tiempo, como la encefalopatía neonatal, es importante describir los valores normales de referencia de la VFC inmediatamente después del nacimiento y sus tendencias a lo largo de las primeras 24 h. Estas tendencias tempranas pueden proporcionar información valiosa sobre cómo se ha recuperado un bebé de cualquier complicación relacionada con el nacimiento. Nuestro objetivo principal era describir los valores de referencia estándar para las tendencias de la VFC durante las primeras 24 horas de vida posnatal en bebés sanos a término. Como objetivo secundario, investigamos qué características clínicas o factores de riesgo (si los hay) ejercen un mayor impacto en la VFC.
Materiales y métodos
Población de estudio
Reclutamos de forma prospectiva y consecutiva a 150 bebés sanos a término del centro de partos, la sala de partos o la sala postnatal del Queen Charlotte’s and Chelsea Hospital entre agosto de 2017 y enero de 2019. Se incluyeron bebés sanos nacidos a las 36 semanas de edad gestacional o más, tras embarazos no complicados, que nacieron en buenas condiciones con un peso al nacer entre el 9º y el 91º centil. Se excluyeron los bebés que requirieron algún tipo de medicación o fototerapia, si hubo pirexia materna perinatal durante o en las 48 horas siguientes al inicio del parto, si requirieron reanimación en el momento del nacimiento o después del mismo (intubación o compresiones cardíacas o algún fármaco) o si hubo alguna complicación intraparto (hemorragia materna, desprendimiento de la placenta, preeclampsia o prolapso del cordón). Nuestro estudio sólo incluyó a los bebés que se encontraban bien al nacer y, por lo tanto, permanecieron con sus madres en todo momento.
Cuidados intraparto y posparto temprano
Los bebés incluidos en nuestro estudio nacieron en el centro de partos o en la sala de partos, según la preferencia materna. Las mujeres que preferían un parto más natural y menos medicalizado optaron por la atención de las matronas en el centro de partos. Una piscina caliente, aromaterapia, música, óxido nitroso y diversos equipos están disponibles para ayudar a estas mujeres a sobrellevar el dolor del parto. Las mujeres que optaron por la analgesia epidural recibieron atención dirigida por un obstetra en la sala de partos. En ambos entornos, la temperatura de la sala se fijó en 24-25°C. Según las directrices nacionales, los bebés nacidos en buen estado se entregan a la madre inmediatamente después del parto y se colocan sobre su pecho/abdomen para que reciban cuidados piel con piel. Se les puede limpiar suavemente mientras están en el pecho de la madre, y se inicia la alimentación con leche materna o con biberón dentro de las 1 h siguientes al nacimiento.
Adquisición de ECG
Los registros de electrocardiograma se iniciaron lo antes posible después del nacimiento, tras el consentimiento informado por escrito de los padres, que podía obtenerse prenatal o postnatalmente. Este estudio fue aprobado por un Comité Ético Nacional de Investigación (REC17/LO/0956) y por el departamento local de Desarrollo de la Investigación &. Los registros se continuaron durante al menos 6 h, pero podían interrumpirse antes si los padres lo solicitaban o si el bebé era dado de alta. Se utilizó un registrador de ECG portátil de 2 pulgadas (Faros 180, Bittium, Oulu, Finlandia) con configuración torácica de triple electrodo y una frecuencia de muestreo de 500 Hz (Figura 1), que habíamos probado previamente. Una vez completada la grabación, el archivo de ECG se cargó en el software de análisis de VFC CardiscopeTM (Hasiba Medical, Graz, Austria) para el análisis de ECG y VFC.
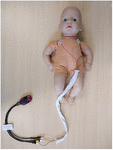
Figura 1. Registrador de ECG portátil y configuración torácica. Se introdujeron tres electrodos de ECG a través de un manguito de alineación para reducir la distancia entre los cables de ECG y evitar los artefactos de inducción magnética en la señal de ECG sin procesar (500 Hz con detección automática del pico R).
Análisis de la VFC
Se calcularon las métricas de variabilidad de la frecuencia cardíaca en los dominios del tiempo (lineal y no lineal) y de la frecuencia para cada segmento de 5 minutos del ECG (ventanas no superpuestas). Se utilizó una validez mínima del QRS del 90%, lo que significa que todos los segmentos de 5 minutos con menos del 90% de QRS consecutivos de buena calidad se excluyeron del análisis. Dada la falta de recomendaciones internacionales para el análisis de la VFC específicamente para los neonatos, nuestros métodos y las métricas elegidas se basaron en una adaptación de las directrices internacionales disponibles (Grupo de Trabajo de la Sociedad Europea de Cardiología y la Sociedad Norteamericana de Estimulación y Electrofisiología, 1996; Schwartz et al., 2002), además de las recomendaciones recientes para la investigación de la VFC (Laborde et al., 2017) y una revisión de los estudios relevantes de la VFC en los neonatos durante los primeros días de vida (Doyle et al., 2009; Goulding et al., 2015; Temko et al., 2015). Las 16 métricas de VFC que elegimos para analizar se basaron en estas referencias. El análisis de frecuencias se realizó con la transformada de Fourier (Periodograma de Welch) y utilizamos series temporales de intervalos RR detrenciados e interpolados (spline cúbico). Basándonos en la bibliografía mencionada, utilizamos una banda LF de 0,04-0,20 Hz y una banda HF de 0,20-2,0 Hz. A continuación, analizamos el LF y el HF normalizados, es decir, la proporción de potencia en esos rangos en relación con la potencia espectral total. La lista de métricas de VFC reportadas en este estudio y su significado se describen en la Tabla 1.

Tabla 1. Métricas de la VFC: abreviaturas y significado.
Análisis estadístico
Utilizamos Stata 15 (StataCorp, Austin, TX, Estados Unidos) para el análisis estadístico. Describimos las tendencias temporales de la VFC con medianas horarias y rangos intercuartílicos y calculamos las medias individuales para las primeras 6 y 24 h de vida. Dado que los registros de ECG podían comenzar y terminar en diferentes momentos, nuestros datos estaban desequilibrados, es decir, no teníamos exactamente el mismo número de mediciones para todos los participantes, los cambios en la VFC a lo largo del tiempo se analizaron con una regresión de efectos mixtos multinivel con covarianza autorregresiva o utilizando pruebas por pares si se comparaban las medias de seis horas. La relevancia de las variables clínicas también se comprobó con una regresión de efectos mixtos multinivel con covarianza autorregresiva y se realizaron comparaciones de subgrupos mediante pruebas de comparación de proporciones/medias para las variables clínicas significativas. Como la mayoría de las tendencias no eran lineales y tenían al menos una deflexión, utilizamos un término cuadrático para la variable temporal en el modelo de regresión. Transformamos logarítmicamente las variables de la VFC que no estaban distribuidas normalmente para garantizar la normalidad de los residuos.
Resultados
Entre septiembre de 2017 y enero de 2019, examinamos a 511 bebés, de los cuales 360 eran elegibles y 151 no. De esos 360 bebés, 201 madres/padres nos solicitaron volver más tarde o en otro momento conveniente, lo que finalmente superó la ventana máxima de reclutamiento o se hizo imposible reclutar debido a que el equipo estaba en uso. De las 159 madres/padres a los que se informó exhaustivamente sobre el estudio, 9 se negaron y 150 dieron su consentimiento informado por escrito. De estos 150 participantes, 7 iniciaron el registro del ECG después de 24 h. Las características de la muestra se recogen en las tablas 2 y 3. En total, obtuvimos 1858 h y 55 min de registro de ECG comenzando a una edad media (IQR) de 2 h 46 min (3 h 6 min), mínimo 1 min después del nacimiento, máximo 52 h 23 min. No todos los bebés comenzaron el registro del ECG al mismo tiempo ni todos los registros duraron lo mismo. La figura 2 presenta el número de registros válidos y de bebés por tiempo.

Tabla 2. Características de la muestra I (variables continuas).

Tabla 3. Características de la muestra II (variables categóricas).
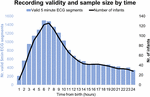
Figura 2. Validez del registro y tamaño de la muestra según el tiempo.
Valores de la RH a lo largo del tiempo
Durante las primeras 6 h de edad postnatal, los valores de la mediana (IQR) fueron RH 122 (15,9), SDNN 27,5 (13,2), RMSSD 18,32 (11,42), SD1 13.6 (7,7), SD2 36,2 (17,8), SDSD 18,8 (11,4), CVI 2,7 (0,4), CSI 2,6 (1,2), pNN20 14,8 (15,2), pNN50 1,7 (2.5) HFn 40,4 (16,9) LFn 57,7 (17,8) Potencia total 751 (835), TINN 226 (144) Índice de VFC 5,9 (2,3) Parseval 0,7 (0,2). Nueve de estas métricas de VFC (incluida la frecuencia cardíaca) cambiaron significativamente con el tiempo (FC p < 0,01; SDNN p = 0,01; SD2 p < 0,01; CSI p < 0,01; HFn p = 0,03; LFn p < 0,01;Potencia total p < 0,01; Índice de VFC p = 0,01; Índice Parseval p = 0,03), ajustado por variables clínicas relevantes. Se observó una variación más pronunciada durante las primeras 6 h de vida postnatal. Sólo la frecuencia cardíaca y la LFn cambiaron entre las 6 y las 12 h de edad y sólo la frecuencia cardíaca cambió entre las 12 y las 18 h de edad (valores p ajustados por Bonferroni: 0,03, < 0,01 y < 0,01, respectivamente). Estas métricas mostraron un aumento de la VFC durante las primeras 6 h, seguido de un ligero descenso hasta las 12 h, momento a partir del cual la VFC se mantuvo estable (Tabla 4). Las tendencias horarias expresadas por la mediana y los rangos intercuartílicos se presentan en la figura 3. Las tendencias de la VFC a lo largo del tiempo se vieron afectadas de forma independiente por la edad gestacional, los movimientos fetales reducidos, la clasificación de la cardiotocografía (CTG), las enfermedades maternas crónicas o inducidas por el embarazo y la aparición de complicaciones en el parto. Examinamos las interdependencias de todas las métricas de VFC con una matriz de correlación (figura 4), en la que destacamos (a) la similitud entre las métricas del dominio temporal y (b) la tendencia a la simetría entre HFn y LFn y CSI y CVI.
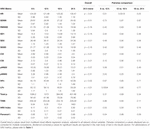
Tabla 4. Medias de VFC de seis horas y comparaciones por pares.
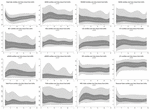 Figura 3. Centiles de VFC durante las primeras 24 h de edad. Áreas de color gris claro: Centiles 5º-25º y centiles 75º-95º. Áreas grises oscuras: Centiles 25-75. La línea blanca central corresponde a la mediana. Los valores p indicados son el resultado de una regresión de efectos mixtos multinivel para medir el cambio en el tiempo. Todos los centiles se suavizan con spline cúbico.
Figura 3. Centiles de VFC durante las primeras 24 h de edad. Áreas de color gris claro: Centiles 5º-25º y centiles 75º-95º. Áreas grises oscuras: Centiles 25-75. La línea blanca central corresponde a la mediana. Los valores p indicados son el resultado de una regresión de efectos mixtos multinivel para medir el cambio en el tiempo. Todos los centiles se suavizan con spline cúbico. 
Figura 4. Matriz de correlación: todas las métricas de VFC. Para las abreviaturas de las métricas de VFC, consulte la Tabla 1. Observamos en particular (a) la concordancia entre RMSSD, SDSD y SD1, que se ha descrito previamente; (b) el comportamiento de las diferentes métricas de VFC en relación con la FC, que pone de relieve la cantidad de información adicional que puede proporcionar el análisis de la VFC; (c) la interdependencia de HFn y LFn y CVI y CSI, lo que pone de relieve la interacción entre las influencias simpáticas y parasimpáticas.
Efecto de los factores clínicos
Además de la edad (tiempo de nacimiento), la regresión univariable de efectos mixtos de varios niveles mostró que las métricas de VFC se veían afectadas por la edad gestacional, los movimientos fetales reducidos, la CTG, la enfermedad materna y las complicaciones del parto. Después de ajustar estas variables, la variación a lo largo del tiempo de las siete métricas de VFC mencionadas siguió siendo estadísticamente significativa. La HFn y el índice de Parseval también mostraron cambios significativos. Aunque la paridad no fue un predictor independiente en el análisis de regresión univariable, en el subgrupo de partos vaginales espontáneos, observamos una tendencia consistente hacia una VFC más alta para las primíparas en relación con las multíparas.
Movimientos fetales reducidos
Los movimientos fetales reducidos se asociaron de forma consistente con valores de VFC más bajos para todas las métricas, excepto para el ISC (que se comporta en la dirección opuesta, es decir, el resultado es concordante). Estas diferencias entre subgrupos sólo fueron estadísticamente significativas para las tendencias del CSI (p = 0,001), el pNN20 (p = 0,045) y el índice de Parseval (p = 0,047). La figura 5 presenta las tendencias de estas tres métricas a lo largo del tiempo, en comparación con la frecuencia cardíaca. Esto es así a pesar de que no hay diferencias significativas entre los subgrupos, aparte de la gravidez media, que no predijo de forma independiente la VFC (Tabla 5). Las asociaciones con el CSI y el pNN20 siguieron siendo significativas tras ajustar por la edad gestacional, el tiempo transcurrido desde el nacimiento, la clasificación CTG, la presencia de enfermedades crónicas maternas o las complicaciones del parto (Tabla 6). El subgrupo con movimientos fetales reducidos tuvo una media de VFC más baja durante las primeras 6 h, aunque estas diferencias no fueron estadísticamente significativas.
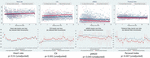
Figura 5. Cambios en la VFC en los bebés cuyas madres informaron de una reducción de los movimientos fetales. Para las abreviaturas de las métricas de VFC, consulte la Tabla 1. Los paneles superiores presentan la dispersión de los datos de VFC a lo largo del tiempo y las líneas de tendencia lineal para la frecuencia cardíaca (comparativa) y las tres métricas de VFC que se asociaron significativamente con los informes maternos de movimientos fetales reducidos. Las líneas rojas representan a los bebés cuyas madres informaron de una reducción de los movimientos fetales y las líneas azules representan a los bebés cuyas madres no lo hicieron. Los paneles inferiores presentan las medias y los intervalos de confianza del 95% para esas métricas.
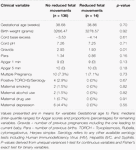
Tabla 5. Comparación de subgrupos: bebés con y sin movimientos fetales reducidos.
 Tabla 6. Correlación no ajustada y ajustada entre las métricas de la VFC y los movimientos fetales reducidos.
Tabla 6. Correlación no ajustada y ajustada entre las métricas de la VFC y los movimientos fetales reducidos. Cardiotocografía
Hubo una asociación significativa entre los hallazgos de la CTG y las tendencias de la VFC a lo largo del tiempo para la CSI (p = 0,03), la LFn (0,01) y la HFn (p = 0,02), que siguió siendo estadísticamente significativa tras ajustar por los movimientos fetales reducidos, la edad gestacional, el tiempo transcurrido desde el nacimiento, la presencia de enfermedades crónicas maternas o inducidas por el embarazo o las complicaciones del parto. No obstante, dado el pequeño número de eventos en cada clasificación de CTG, también comparamos la media de 6 h en estos subgrupos. El ISC en el subgrupo de bradicardia fue significativamente diferente de los grupos «normal», «desaceleración variable» y «otros» (valores p ajustados por Bonferroni: 0,02, 0,03 y 0,04, respectivamente), pero ninguna otra diferencia de grupo fue estadísticamente significativa. La HFn sólo fue diferente entre los subgrupos de «bradicardia» y «desaceleración variable» (p = 0,03) y la LFn no varió entre los diferentes subgrupos de CTG.
Enfermedad crónica materna o inducida por el embarazo
En nuestra muestra, 104 (69%) mujeres no tenían ninguna enfermedad crónica ni inducida por el embarazo, 20 (13%) tenían diabetes mellitus aislada o diabetes gestacional, 7 (3%) tenían enfermedad tiroidea, 1 (0,7%) tenía hipertensión y el resto tenía otras condiciones, incluyendo combinaciones de las anteriores (Tabla 3). Las enfermedades crónicas de la madre o inducidas por el embarazo se asociaron significativamente con las tendencias de la VFC no ajustadas, aunque esto sólo siguió siendo estadísticamente significativo para el Índice de Parseval (p = 0,03) después de ajustar los factores de confusión clínicos. En el análisis binario, los bebés de madres con enfermedades crónicas/del embarazo no tuvieron índices de Parseval diferentes ni durante las primeras 6 horas (p = 0,98) ni durante el periodo de 24 horas (p = 0,29). El grupo de enfermedades con menor Índice de Parseval fue la enfermedad tiroidea.
Eventos durante el parto
Todos los bebés de nuestro estudio nacieron tras embarazos y partos sin complicaciones y nacieron en buenas condiciones. No obstante, hubo 13 nacimientos que presentaron alguno de los siguientes eventos: líquido teñido de meconio (11), cordón cervical circular (1), segunda fase del parto prolongada (1) y distocia de hombros (1, además del meconio). Las tendencias del ISC a lo largo de las 24 horas se asociaron de forma significativa con la presencia de cualquier acontecimiento del parto antes (p = 0,04), pero no después de ajustar los factores de confusión (p = 0,42).
Aunque el modo de parto no predijo de forma independiente los valores de la VFC, los bebés nacidos mediante parto instrumental tuvieron una HFn de 24 horas más baja y un ISC de 24 horas más alto que los bebés nacidos mediante parto vaginal natural. Esto se produjo a pesar de no existir diferencias significativas entre otras variables clínicas relevantes, excepto la puntuación de Apgar a 1 minuto y la multiplicidad de la gestación, que no predijeron de forma independiente la VFC (tabla 7).
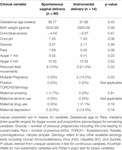
Tabla 7. Comparación de subgrupos: bebés nacidos por parto vaginal normal frente a parto instrumental.
Discusión
Este es el primer estudio que describe las tendencias de la VFC continua postnatal temprana en bebés sanos a término en el periodo postnatal inmediato. La identificación de estos umbrales y tendencias fue importante porque ahora sabemos que el análisis y la interpretación de la VFC en el período postnatal temprano dependen del tiempo, es decir, lo que es normal a las 1-6 h de edad puede no ser normal a las 12-18 h de edad. Esto permitirá a los clínicos e investigadores examinar con mayor precisión las diferencias en la VFC entre bebés sanos y enfermos en el periodo postnatal inmediato. Disponer de valores de referencia precisos para el periodo postnatal inmediato también significa que ahora estamos mejor equipados para desarrollar sistemas de alerta temprana basados en el análisis de la VFC. Existen algunas razones posibles para los cambios que observamos en las primeras 6 h después del nacimiento. Dado que el nacimiento se ha descrito previamente como un acontecimiento estresante para los bebés (Peebles et al., 1994; Aldrich et al., 1996), es posible que la mejora de la VFC en las primeras horas refleje el final del efecto estresante (es decir, el final del nacimiento). Este rebote parasimpático podría producirse porque el sistema nervioso simpático puede suprimir temporalmente la actividad parasimpática, que cesa una vez finalizado el periodo de estrés. Desde otra perspectiva, Reyes-Lagos et al., 2015 informaron de una mayor VFC materna durante el parto que durante el tercer trimestre y Musa et al., 2017 describieron el aumento de la LFn y la HFn por la dilatación cervical durante el parto. Si la VFC fetal sigue a la VFC materna, esto sugeriría en cambio que el nacimiento puede representar un período de VFC particularmente alto que refleja la buena adaptación a los desafíos fisiológicos, en bebés sanos. Por último, también es posible que los cambios en la VFC observados durante las primeras horas sean una expresión parcial de la maduración de la VFC que se produce con la edad (Fyfe et al., 2015).
Hemos revisado los hallazgos de la VFC comunicados en otros estudios neonatales y fetales con la intención de comparar dichos valores con los de nuestro estudio, pero dadas las diferencias en las métricas y en la adquisición y duración de los registros, esto fue muy difícil. Los valores de VFC que observamos en las primeras 6-12 h fueron comparables (ligeramente superiores) a los comunicados por Doyle et al. (2009) en el sueño activo durante las primeras 12 h de vida y por Lucchini et al., 2019 a las 12-84 horas de vida, y más bajos que los comunicados a edades más avanzadas, es decir, 24-168 h (por Mehta et al., 2002; Longin et al., 2005; Makarov et al., 2010). Los bebés de nuestro estudio tenían valores de SDNN durante las primeras 6 h de edad que eran comparables (ligeramente superiores) a los de los fetos a término (Brändle et al., 2015; Schneider et al., 2018), lo cual era de esperar, dada la mayor duración del registro y el aumento de la edad gestacional. Tener una VFC similar antes y después del nacimiento apoya la teoría de que el nacimiento, en bebés sanos, se asocia con una buena estabilidad de la VFC.
Observamos más variabilidad inter-sujeto que dentro del sujeto en todas las métricas de la VFC. Esto subraya que el análisis de la VFC debe interpretarse basándose no sólo en los valores de referencia, sino también teniendo en cuenta los cambios y el progreso en relación con las líneas de base individuales. De hecho, mientras que pudimos observar cambios en la VFC cada hora durante las primeras 6 h de edad, es posible que no hubiéramos podido detectar dicha variación si sólo nos hubiéramos comprometido a analizar un único punto temporal o una media. El seguimiento de estas tendencias puede proporcionar más información sobre la forma en que un bebé se recupera del nacimiento en caso de un parto complicado o de una intervención de emergencia. De hecho, el hecho de que las métricas de la VFC estuvieran significativamente asociadas con la reducción de los movimientos fetales, la CTG anormal, la enfermedad materna crónica o inducida por el embarazo y las complicaciones del parto destaca el valor del análisis de la VFC como una medida del bienestar general.
La asociación entre la VFC y los movimientos fetales ha sido informada previamente por Brändle et al. (2015) utilizando biomagnetografía fetal. En su estudio de evaluación del estado de comportamiento basado en los movimientos, que incluía fetos sanos de 24 a 41 semanas, las métricas de VFC (pero no la Entropía) aumentaban del sueño tranquilo al sueño activo y del sueño activo al estado despierto, para todas las edades gestacionales. De hecho, Nijhuis et al. (1982) ya habían propuesto una clasificación del movimiento fetal basada en la VFC fetal, el movimiento de los ojos y el movimiento del cuerpo.
Autores anteriores han encontrado diferencias en los valores de la VFC a través de diferentes modos de parto. Kozar et al. (2018) informaron de una menor HFn y una mayor LFn en los bebés nacidos por cesárea que en los nacidos por vía vaginal. Es posible que su hallazgo esté relacionado con el uso de tiopental para la anestesia general (AG) en todas sus secciones electivas (Riznyk et al., 2005; Tsuchiya et al., 2006) más que con el modo de parto, mientras que en nuestro estudio no hubo uso de ninguna AG. Nuestra interpretación es que la VFC indicará una diferencia entre los modos de parto si hay una diferencia en el bienestar, por lo tanto, en nuestro estudio, esto se habría asociado con el uso de instrumentos durante el parto debido a una extracción difícil.
Limitaciones
No hemos examinado los estados de sueño de los bebés reclutados durante las primeras 24 h después del nacimiento. Es poco probable que los bebés hayan establecido un ritmo circadiano a las pocas horas de nacer y, en cambio, los recién nacidos suelen seguir ritmos ultradianos (Mirmiran et al., 2003). No obstante, es posible que la tendencia ligeramente descendente que observamos en la segunda mitad de las grabaciones de 24 horas refleje una mayor proporción de bebés durmiendo o en un estado más tranquilo. Hemos incluido en nuestro estudio algunos bebés sanos cuyas madres tenían alguna enfermedad crónica o inducida por el embarazo. Podría argumentarse que la inclusión de estos casos compromete nuestra definición de recién nacido sano y de VFC neonatal sana. El hecho de que no haya habido asociaciones significativas entre ninguna métrica de la VFC y el pH o el exceso de bases o la puntuación de Apgar pone de manifiesto que nuestra muestra era realmente sana, ya que todos los bebés de nuestro estudio nacieron en buenas condiciones y no necesitaron ningún tipo de investigación o tratamiento. Nuestro objetivo era representar todo el espectro de partos que se consideran y se manejan clínicamente como «sanos» desde un punto de vista pragmático (es decir, todos los «de bajo riesgo» y «sin complicaciones»). Por lo tanto, incluir a esos bebés fue un paso importante para abordar las posibles «variaciones de lo normal» y para enriquecer nuestro conjunto de datos. Igualmente, hemos explorado las posibles diferencias en la VFC en varios subgrupos (según variables clínicas como las descritas en la Tabla 2). Es importante aclarar que nuestro estudio no tenía como objetivo ni potencia para abordar en detalle las posibles diferencias a través de esos subgrupos y se necesita precaución para interpretar nuestros resultados. No obstante, creemos que el examen de estas asociaciones será de interés para los equipos sanitarios de atención obstétrica y perinatal/neonatal.
Conclusión
Hemos descrito los valores de referencia postnatales tempranos para las métricas de la VFC en lactantes sanos a término, que no se habían alcanzado previamente. La VFC cambia significativamente durante el primer día de vida, particularmente durante las primeras 6 h, durante las cuales parece exhibir un breve aumento seguido de una normalización. Las correlaciones significativas entre la VFC y las variables clínicas de riesgo apoyan la hipótesis de que la VFC es un buen indicador del bienestar general del bebé y es sensible para captar el estrés relacionado con el nacimiento y controlar su resolución a lo largo del tiempo.
Disponibilidad de los datos
Los datos brutos que apoyan las conclusiones de este manuscrito serán puestos a disposición por los autores, sin reservas indebidas, a cualquier investigador cualificado.
Declaración ética
Este estudio se llevó a cabo de acuerdo con las recomendaciones de la Autoridad de Investigación Sanitaria del Reino Unido y la GCP ICH con el consentimiento informado por escrito de todos los sujetos. Todos los sujetos dieron su consentimiento informado por escrito de acuerdo con la Declaración de Helsinki. El protocolo fue aprobado por el Comité de Ética de Investigación de Chelsea de Londres.
Contribuciones de los autores
VO diseñó el estudio, recogió, analizó e interpretó los datos, escribió el primer borrador y dirigió el desarrollo del manuscrito. WvR contribuido al análisis y la interpretación de los datos y proporcionó insumos críticos para el desarrollo del manuscrito. PM y TA contribuyeron a la interpretación de los datos y proporcionaron aportes críticos para el desarrollo del manuscrito. JM contribuyó al diseño del estudio y a la interpretación de los datos, reclutó a los pacientes y adquirió los datos. VS contribuyó a la gestión del estudio y al reclutamiento. DM supervisó todos los aspectos del análisis y la interpretación de la VFC y realizó aportaciones críticas para la elaboración del manuscrito. ST concibió la idea y diseñó el estudio, supervisó todos los aspectos del estudio y dirigió el desarrollo del manuscrito.
Financiación
VO fue financiado por el NIHR ICA Doctoral Research Fellowship. PM fue financiado por el MRC Doctoral Research Fellowship. Las opiniones expresadas son las del autor(es) y no necesariamente las del NIHR o del Departamento de Salud.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Deseamos agradecer a todos los padres que consintieron la participación de sus bebés en este estudio y al Sr. Paul Basset (estadístico médico) por su apoyo con el análisis estadístico de los datos incluidos en este manuscrito.
Adjei, T., Rosenberg, W., Von, Nakamura, T., y Chanwimalueang, T. (2019). El marco classA : evaluación basada en la VFC de la dinámica del SNS y el PNS sin controversias de LF-HF. Front. Physiol. 10:505. doi: 10.3389/fphys.2019.00505
PubMed Abstract | CrossRef Full Text | Google Scholar
Aldrich, C. J., D’Antona, D., Spencer, J. A. D., Delpy, D. T., Reynolds, E. O. R., y Wyatt, J. S. (1996). Fetal heart rate changes and cerebral oxygenation measured by near-infrared spectroscopy during the first stage of labour. Eur. J. Obstet. Gynecol. Reprod. Biol. 64, 189-195. doi: 10.1016/0301-2115(95)02284-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Brändle, J., Preissl, H., Draganova, R., Ortiz, E., Kagan, K. O., Abele, H., et al. (2015). Los parámetros de variabilidad de la frecuencia cardíaca y el movimiento fetal complementan la detección de estados conductuales fetales mediante magnetografía para monitorizar el desarrollo neurovegetativo. Front. Hum. Neurosci. 9:147. doi: 10.3389/fnhum.2015.00147
PubMed Abstract | CrossRef Full Text | Google Scholar
Chrousos, G., y Gold, P. (1992). Los conceptos de estrés y trastornos del sistema de estrés – visión general de la homeostasis física y conductual. JAMA 267, 1244-1252. doi: 10.1001/jama.267.9.1244
PubMed Abstract | CrossRef Full Text | Google Scholar
Doyle, O. M., Korotchikova, I., Lightbody, G., Marnane, W., Kerins, D., y Boylan, G. B. (2009). Heart rate variability during sleep in healthy term newborns in the early postnatal period. Physiol. Meas. 30, 847-860. doi: 10.1088/0967-3334/30/8/009
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Laborde, S., Mosley, E., y Thayer, J. F. (2017). Variabilidad de la frecuencia cardíaca y tono vagal cardíaco en la investigación psicofisiológica: recomendaciones para la planificación de experimentos, el análisis de datos y el informe de datos. Front. Psychol. 8:1-18. doi: 10.3389/fpsyg.2017.00213
PubMed Abstract | CrossRef Full Text | Google Scholar
Longin, E., Schaible, T., Lenz, T., y König, S. (2005). Variabilidad de la frecuencia cardíaca a corto plazo en neonatos sanos: datos normativos y observaciones fisiológicas. Early Hum. Dev. 81, 663-671. doi: 10.1016/j.earlhumdev.2005.03.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Lucchini, M., Burtchen, N., Fifer, W., y Signorini, M. (2019). Análisis cardiorrespiratorio multiparamétrico en bebés prematuros tardíos, prematuros y a término al nacer. Med. Biol. Eng. Comput. 57, 99-106. doi: 10.1007/s11517-018-1866-4
PubMed Abstract | CrossRef Full Text | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
Mehta, S. K., Super, D. M., Connuck, D., Salvator, A., Singer, L., Fradley, L. G., et al. (2002). Heart rate variability in healthy newborn infants. Am. J. Cardiol. 89, 50-53. doi: 10.1016/S0002-9149(01)02162-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mirmiran, M., Maas, Y. G. H., y Ariagno, R. L. (2003). Desarrollo del sueño fetal y neonatal y los ritmos circadianos. Sleep Med. Rev. 7, 321-334. doi: 10.1053/smrv.2002.0243
CrossRef Full Text | Google Scholar
Musa, S. M., Adam, I., Hassan, N. G., Rayis, D. A., y Lutfi, M. F. (2017). Variabilidad de la frecuencia cardíaca materna durante la primera etapa del parto. Front. Physiol. 8:1-6. doi: 10.3389/fphys.2017.00774
CrossRef Full Text | Google Scholar
Nijhuis, J., Prescht’l, H., y Martin, C. (1982). ¿Existen estados de comportamiento en el feto humano? Early Hum. Dev. 6, 177-195. doi: 10.1016/0378-3782(82)90106-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, V., Martins, R., Liow, N., Teiserskas, J., Von Rosenberg, W., Adjei, T., et al. (2018). Precisión pronóstica del análisis de la variabilidad de la frecuencia cardíaca en la encefalopatía neonatal: una revisión sistemática. Neonatology 115, 59-67. doi: 10.1159/000493002
PubMed Abstract | CrossRef Full Text | Google Scholar
Pomeranz, B., Macaulay, R. J., Caudill, M. A., Kutz, I., Adam, D., Gordon, D., et al. (1985). Assessment of autonomic function in humans by heart rate spectral analysis. Am. J. Physiol. 248, H151-H153. doi: 10.1152/ajpheart.1985.248.1.H151
PubMed Abstract |Ref Full Text | Google Scholar
Reyes-Lagos, J. J., Echeverría-Arjonilla, J. C., Peña-Castillo, M. Á, García-González, M. T., Ortiz-Pedroza Mdel, R., Pacheco-López, G., et al. (2015). Comparación de la variabilidad de la frecuencia cardíaca en mujeres en el tercer trimestre del embarazo y durante el parto de bajo riesgo. Physiol. Behavior. 149, 255-261. doi: 10.1016/j.physbeh.2015.05.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Riznyk, L., Fijałkowska, M., y Przesmycki, K. (2005). Efectos de tiopental y propofol en la variabilidad de la frecuencia cardíaca durante la inducción de anestesia general basada en fentanilo. Pharmacol. Rep. 57, 128-134. doi: 10.1103/PhysRevB.69.052404
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, U., Bode, F., Schmidt, A., Nowack, S., Rudolph, A., Doelcker, E. M., et al. (2018). Hitos de desarrollo del sistema nervioso autónomo revelados a través de la monitorización longitudinal de la variabilidad de la frecuencia cardíaca fetal. PLoS One 13:1-13. doi: 10.1371/journal.pone.0200799
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwartz, P. J., Garson, A., Paul, T., Stramba-Badiale, M., Vetter, V. L., Villain, E., et al. (2002). Guidelines for the interpretation of the neonatal electrocardiogram: a task force of the european society of cardiology. Eur. Heart J. 23, 1329-1344. doi: 10.1053/euhj.2002.3274
PubMed Abstract | CrossRef Full Text | Google Scholar
Shaffer, F., y Ginsberg, J. P. (2017). Una visión general de las métricas y normas de la variabilidad de la frecuencia cardíaca. Front. Public Heal. 5:1-17. doi: 10.3389/fpubh.2017.00258
PubMed Abstract | CrossRef Full Text | Google Scholar
CrossRef Full Text | Google Scholar
Temko, A., Doyle, O., Murray, D., Lightbody, G., Boylan, G., and Marnane, W. (2015). Predictor multimodal del resultado del neurodesarrollo en recién nacidos con encefalopatía hipóxico-isquémica. Comput. Biol. Med. 63, 169-177. doi: 10.1016/j.compbiomed.2015.05.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Toichi, M., Sugiura, T., Murai, T., y Sengoku, A. (1997). A new method of assessing cardiac autonomic function and its comparison with spectral analysis and coefficient of variation of R-R interval. J. Auton. Nerv. Syst. 62, 79-84. doi: 10.1016/S0165-1838(96)00112-9
PubMed Abstract | CrossRef Full Text | Google Scholar
von Rosenberg, W., Chanwimalueang, T., Adjei, T., Jaffer, U., Goverdovsky, V., and Mandic, D. P. (2017). Resolviendo ambigüedades en la relación LF/HF: Gráficos de dispersión LF-HF para la categorización del estrés mental y físico a partir de la VFC. Front. Physiol. 8:360. doi: 10.3389/fphys.2017.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
.