HormonfrigivelseRediger
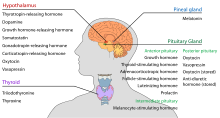
Hypothalamus har en central neuroendokrin funktion, især ved sin kontrol af den forreste hypofyse, som igen regulerer forskellige endokrine kirtler og organer. Releaserende hormoner (også kaldet releasing factors) produceres i hypothalamiske kerner og transporteres derefter langs axoner til enten den mediane eminence eller den bageste hypofyse, hvor de lagres og frigives efter behov.
Forreste hypofyse
I den hypothalamisk-adenohypofyseale akse frigives frigørende hormoner, også kendt som hypofysiotrope eller hypothalamiske hormoner, fra median eminence, en forlængelse af hypothalamus, til det hypofyseale portalsystem, som transporterer dem til den forreste hypofyse, hvor de udøver deres regulerende funktioner på sekretionen af adenohypofyseale hormoner. Disse hypofysiotrope hormoner stimuleres af parvocellulære neurosekretoriske celler, der er placeret i det periventrikulære område af hypothalamus. Efter at de hypofysiotrope hormoner er blevet frigivet i kapillærerne i tredje ventrikel, bevæger de sig gennem det såkaldte hypothalamo-hypofyseportalkredsløb. Når de når frem til deres bestemmelsessted i den forreste hypofyse, binder disse hormoner sig til specifikke receptorer på hypofysecellers overflade. Afhængigt af hvilke celler, der aktiveres ved denne binding, begynder hypofysen enten at udskille eller ophører med at udskille hormoner til resten af blodbanen.
| Sekreteret hormon | Abkortning | Produceret af | Virkning |
|---|---|---|---|
| Thyrotropin-frigivende hormon (Prolaktin-frigivende hormon) |
TRH, TRF, eller PRH | Parvocellulære neurosekretoriske celler i den paraventrikulære kerne | Stimulerer frigivelse af skjoldbruskkirtelstimulerende hormon (TSH) fra forreste hypofyse (primært) Stimulerer frigivelse af prolaktin fra forreste hypofyse |
| Corticotropin-releasing hormone | CRH eller CRF | Parvocellulære neurosekretoriske celler i den paraventrikulære kerne | Stimulerer frigivelse af adrenocorticotropisk hormon (ACTH) fra forreste hypofyse |
| Dopamin (Prolactin-hæmmende hormon) |
DA eller PIH | Dopamin-neuroner i den buede kerne | Hæmmer prolaktinfrigivelse fra forreste hypofyse |
| Vækst-hormon-frigivende hormon | GHRH | Neuroendokrine neuroner i den buede kerne | Stimulerer vækst-hormon (GH) frigivelse fra forreste hypofyse |
| Gonadotropin-frigivende hormon | GnRH eller LHRH | Neuroendokrine celler i det præoptiske område | Stimulerer follikel-stimulerende hormon (FSH) fra forreste hypofyse Stimulerer luteiniserende hormon (LH) fra forreste hypofyse |
| Somatostatin (væksthormon-hæmmende hormon) |
SS, GHIH, eller SRIF | Neuroendokrine celler i den periventrikulære kerne | Hæmmer frigivelse af væksthormon (GH) fra forreste hypofyse Hæmmer (moderat) frigivelse af skjoldbruskkirtelstimulerende hormon (TSH) fra forreste hypofyse |
Andre hormoner, der udskilles fra den mediane eminens, omfatter vasopressin, oxytocin og neurotensin.
Baghypofyse
I den hypothalamisk-neurohypofyseale akse frigives neurohypofysiske hormoner fra den bageste hypofyse, som egentlig er en forlængelse af hypothalamus, til kredsløbet.
| Sekretorisk hormon | Afkortning | Produceret af | Virkning |
|---|---|---|---|
| Oxytocin | OXY eller OXT | Magnocellulære neurosekretoriske celler i den paraventrikulære nucleus og supraoptiske nucleus | Uteruskontraktion Laktation (letdown-refleks) |
| Vasopressin (antidiuretisk hormon) |
ADH eller AVP | Magnocellulære og parvocellulære neurosekretoriske celler i den paraventrikulære nucleus, magnocellulære celler i supraoptisk kerne | Forøgelse af vandgennemtrængeligheden i cellerne i distale tubuli og collecting ductus i nyrerne og muliggør dermed vandreabsorption og udskillelse af koncentreret urin |
Det er også kendt, at hormoner fra hypothalamus-hypofyse-bjørneaksen (HPA) er relateret til visse hudsygdomme og hudens homøostase. Der er beviser for, at hyperaktivitet af HPA-hormoner er forbundet med stressrelaterede hudsygdomme og hudtumorer.
StimuleringRediger
Hypothalamus koordinerer mange hormonelle og adfærdsmæssige cirkadiske rytmer, komplekse mønstre af neuroendokrine udgange, komplekse homøostatiske mekanismer og vigtige adfærdsmønstre. Hypothalamus skal derfor reagere på mange forskellige signaler, hvoraf nogle er genereret eksternt og andre internt. Deltabølgesignalering, der opstår enten i thalamus eller i cortex, påvirker sekretionen af frigivende hormoner; GHRH og prolaktin stimuleres, mens TRH hæmmes.
Hypothalamus reagerer på:
- Lys: dagslængde og fotoperiode til regulering af cirkadiske og sæsonbestemte rytmer
- Olfaktoriske stimuli, herunder feromoner
- Steroider, herunder gonadalsteroider og kortikosteroider
- Neuralt overført information, der især stammer fra hjertet, det enteriske nervesystem (i mave-tarmkanalen) og reproduktionskanalen.
- Autonome input
- Blodbårne stimuli, herunder leptin, ghrelin, angiotensin, insulin, hypofysehormoner, cytokiner, plasmakoncentrationer af glukose og osmolaritet osv.
- Stress
- Invaderer mikroorganismer ved at øge kropstemperaturen og nulstille kroppens termostat opad.
Olfaktoriske stimuliRediger
Olfaktoriske stimuli er vigtige for den seksuelle reproduktion og neuroendokrine funktion hos mange arter. Hvis f.eks. en drægtig mus udsættes for urinen fra en “fremmed” han i en kritisk periode efter samleje, mislykkes drægtigheden (Bruce-effekten). Under samleje danner en hunmus således en præcis “olfaktorisk hukommelse” af sin partner, som varer ved i flere dage. Feromonale signaler hjælper til synkronisering af brunst hos mange arter; hos kvinder kan synkroniseret menstruation også skyldes feromonale signaler, selv om feromonernes rolle hos mennesker er omstridt.
Blodbårne stimuliRediger
Peptidhormoner har vigtig indflydelse på hypothalamus, og for at kunne gøre det skal de passere blod-hjerne-barrieren. Hypothalamus er delvist afgrænset af specialiserede hjerneområder, der mangler en effektiv blod-hjernebarriere; kapillærendothelet på disse steder er fenestreret for at tillade fri passage af selv store proteiner og andre molekyler. Nogle af disse steder er stederne for neurosekretion – neurohypofysen og den mediane eminence. Andre steder er derimod steder, hvor hjernen tager prøver af blodets sammensætning. To af disse steder, SFO (subfornical organ) og OVLT (organum vasculosum of the lamina terminalis), er såkaldte circumventrikulære organer, hvor neuroner er i tæt kontakt med både blod og CSF. Disse strukturer er tæt vaskulariserede og indeholder osmoreceptive og natriumreceptive neuroner, der styrer drikkeriet, vasopressinfrigivelsen, natriumudskillelsen og natriumappetitten. De indeholder også neuroner med receptorer for angiotensin, atrial natriuretisk faktor, endothelin og relaxin, som hver især er vigtige i reguleringen af væske- og elektrolytbalancen. Neuroner i OVLT og SFO projicerer til den supraoptiske kerne og den paraventrikulære kerne og også til de præoptiske hypothalamiske områder. De circumventrikulære organer kan også være det sted, hvor interleukiner virker for at fremkalde både feber og ACTH-sekretion via virkninger på paraventrikulære neuroner.
Det er ikke klart, hvordan alle peptider, der påvirker hypothalamisk aktivitet, får den nødvendige adgang. I tilfælde af prolaktin og leptin er der tegn på aktiv optagelse ved plexus choroidus fra blodet til cerebrospinalvæsken (CSF). Nogle hypofysehormoner har en negativ feedback-indflydelse på den hypothalamiske sekretion; f.eks. giver væksthormon feedback til hypothalamus, men det er uklart, hvordan det kommer ind i hjernen. Der er også tegn på centrale virkninger af prolaktin.
Fund har antydet, at skjoldbruskkirtelhormon (T4) optages af de hypothalamiske gliaceller i infundibular nucleus/median eminence, og at det her omdannes til T3 af type 2 deiodinase (D2). Herefter transporteres T3 ind i de thyrotropinfrigivende hormon (TRH)-producerende neuroner i den paraventrikulære kerne. Der er fundet skjoldbruskkirtelhormonreceptorer i disse neuroner, hvilket indikerer, at de faktisk er følsomme over for T3-stimuli. Desuden udtrykte disse neuroner MCT8, en skjoldbruskkirtelhormontransportør, hvilket understøtter teorien om, at T3 transporteres ind i dem. T3 kunne derefter binde sig til skjoldbruskkirtelhormonreceptoren i disse neuroner og påvirke produktionen af thyrotropin-frigivende hormon og derved regulere produktionen af skjoldbruskkirtelhormon.
Hypothalamus fungerer som en slags termostat for kroppen. Den indstiller en ønsket kropstemperatur og stimulerer enten varmeproduktion og -retention for at hæve blodtemperaturen til en højere indstilling eller sveddannelse og vasodilation for at afkøle blodet til en lavere temperatur. Al feber skyldes en forhøjet indstilling i hypothalamus; forhøjede kropstemperaturer af enhver anden årsag klassificeres som hypertermi. I sjældne tilfælde kan direkte skader på hypothalamus, f.eks. som følge af et slagtilfælde, forårsage feber; dette kaldes undertiden hypothalamisk feber. Det er dog mere almindeligt, at en sådan skade forårsager unormalt lave kropstemperaturer.
SteroiderRediger
Hypothalamus indeholder neuroner, der reagerer kraftigt på steroider og glukokortikoider – (binyrens steroidhormoner, der frigives som reaktion på ACTH). Den indeholder også specialiserede glukosefølsomme neuroner (i den buede kerne og i den ventromediale hypothalamus), som er vigtige for appetitten. Det præoptiske område indeholder termosensitive neuroner; disse er vigtige for TRH-sekretion.
NeuralEdit
Oxytocin-sekretion som reaktion på amning eller vagino-cervikal stimulering medieres af nogle af disse veje; vasopressin-sekretion som reaktion på kardiovaskulære stimuli, der stammer fra kemoreceptorer i carotislegemet og aortabuen, og fra lavtryks-atrievolumenreceptorer, medieres af andre. Hos rotter forårsager stimulering af vagina også prolaktinsekretion, og dette resulterer i pseudo-graviditet efter en infertil parring. Hos kaninen fremkalder coitus en refleks-ovulation. Hos får kan stimulering af livmoderhalsen i nærværelse af høje østrogenniveauer fremkalde moderlig adfærd hos et jomfrufår. Disse virkninger formidles alle af hypothalamus, og informationen overføres hovedsageligt via rygmarvsbaner, der videreformidles i hjernestammen. Stimulering af brystvorterne stimulerer frigivelsen af oxytocin og prolaktin og undertrykker frigivelsen af LH og FSH.
Kardiovaskulære stimuli overføres af vagusnerven. Vagus overfører også en række viscerale informationer, herunder f.eks. signaler, der stammer fra gastrisk distension eller tømning, for at undertrykke eller fremme spisning ved at signalere frigivelse af henholdsvis leptin eller gastrin. Også denne information når hypothalamus via relæer i hjernestammen.
Dertil kommer, at hypothalamus’ funktion reagerer på – og reguleres af – niveauerne af alle tre klassiske monoamin-neurotransmittere, noradrenalin, dopamin og serotonin (5-hydroxytryptamin), i de kanaler, hvorfra den modtager innervation. F.eks. har noradrenerge input fra locus coeruleus vigtige regulerende virkninger på niveauerne af corticotropinfrigivende hormon (CRH).
Kontrol af fødeindtagelseRediger
| Peptider, der øger føden adfærd |
Peptider, der nedsætter fødeadfærd |
|---|---|
| Ghrelin | Leptin |
| Neuropeptid Y | (α,β,γ)-Melanocyt-stimulerende hormoner |
| Agouti-relateret peptid | Cokain- og amfetamin-regulerede transkriptpeptider |
| Orexiner (A,B) | Corticotropin-frigivende hormon |
| Melaninkoncentrerende hormon | Cholecystokininin |
| Galanin | Insulin |
| Glucagon-like peptide 1 |
Den yderste laterale del af den ventromediale kerne i hypothalamus er ansvarlig for kontrollen af fødeindtagelse. Stimulering af dette område medfører øget fødeindtagelse. Bilateral læsion af dette område medfører fuldstændig ophør af fødeindtagelse. De mediale dele af kernen har en kontrollerende virkning på den laterale del. Bilateral læsion af den mediale del af den ventromediale kerne forårsager hyperfagi og fedme hos dyret. Yderligere læsion af den laterale del af den ventromediale kerne hos det samme dyr medfører fuldstændig ophør af fødeindtagelse.
Der er forskellige hypoteser i forbindelse med denne regulering:
- Lipostatisk hypotese: Denne hypotese går ud på, at fedtvævet producerer et humoral signal, der er proportionalt med fedtmængden og virker på hypothalamus for at mindske fødeindtagelsen og øge energiproduktionen. Det har vist sig, at et hormon leptin virker på hypothalamus for at mindske fødeindtagelsen og øge energiproduktionen.
- Gutpeptidhypotese: gastrointestinale hormoner som Grp, glukagoner, CCK og andre hævdes at hæmme fødeindtagelsen. Den mad, der kommer ind i mave-tarmkanalen, udløser frigivelsen af disse hormoner, som virker på hjernen for at frembringe mæthedsfornemmelse. Hjernen indeholder både CCK-A- og CCK-B-receptorer.
- Glukostatisk hypotese: Aktiviteten af mæthedscentret i de ventromediale kerner er sandsynligvis styret af glukoseudnyttelsen i neuronerne. Det er blevet postuleret, at når deres glukoseudnyttelse er lav, og følgelig når den arteriovenøse blodglukoseforskel over dem er lav, falder aktiviteten over neuronerne. Under disse forhold er aktiviteten i ædecentret ukontrolleret, og individet føler sig sulten. Fødeindtagelsen øges hurtigt ved intraventrikulær administration af 2-deoxyglukose og mindsker derfor glukoseudnyttelsen i cellerne.
- Thermostatisk hypotese: Ifølge denne hypotese stimulerer et fald i kropstemperaturen under et givet setpunkt appetitten, mens en stigning over setpunktet hæmmer appetitten.
FrygtbehandlingRediger
Den mediale zone af hypothalamus er en del af et kredsløb, der kontrollerer motiveret adfærd, som f.eks. forsvarsadfærd. Analyser af Fos-mærkning viste, at en række kerner i “adfærdskontrolsøjlen” er vigtige for regulering af udtrykket af medfødt og konditioneret forsvarsadfærd.
Antipredatorisk forsvarsadfærd
Bekæmpelse af et rovdyr (såsom en kat) fremkalder forsvarsadfærd hos forsøgsgnavere, selv når dyret aldrig har været udsat for en kat. I hypothalamus forårsager denne eksponering en stigning i Fos-mærkede celler i den forreste hypothalamiske kerne, den dorsomediale del af den ventromediale kerne og i den ventrolaterale del af den præmammillære kerne (PMDvl). Den præmammillære kerne har en vigtig rolle i udtrykket af forsvarsadfærd over for et rovdyr, da læsioner i denne kerne ophæver forsvarsadfærd som f.eks. frysning og flugt. PMD modulerer ikke forsvarsadfærd i andre situationer, da læsioner af denne kerne havde minimale virkninger på scoringer for frysning efter chok. PMD har vigtige forbindelser til det dorsale periaqueduktale grå, en vigtig struktur i frygtudtryk. Desuden udviser dyrene risikovurderingsadfærd over for det miljø, der tidligere var forbundet med katten. Fos-mærket celleanalyse viste, at PMDvl er den mest aktiverede struktur i hypothalamus, og inaktivering med muscimol forud for eksponering for konteksten ophæver den defensive adfærd. Derfor har hypothalamus, hovedsagelig PMDvl, en vigtig rolle i udtrykket af medfødt og konditioneret defensiv adfærd over for et rovdyr.
Socialt nederlag
Sådan har hypothalamus også en rolle i socialt nederlag: Kerner i den mediale zone er også mobiliseret under et møde med en aggressiv artsfælle. Det besejrede dyr har en stigning i Fos-niveauerne i seksuelt dimorfe strukturer, såsom den mediale præoptiske kerne, den ventrolaterale del af den ventromediale kerne og den ventrale premammilære kerne. Sådanne strukturer er vigtige for andre sociale adfærdsmønstre, såsom seksuel og aggressiv adfærd. Desuden er den præmammillære kerne også mobiliseret, den dorsomediale del, men ikke den ventrolaterale del. Læsioner i denne kerne afskaffer passiv forsvarsadfærd, som f.eks. frysning og “on-the-back”-stilling.