Indledning
Patienter, der indlægges på intensivafdelinger (ICU), har ofte brug for IV-administration af flere lægemidler. Vasoaktive lægemidler, analgetika og sedativa er blandt de mest anvendte terapeutiske grupper og administreres normalt i kontinuerlig infusion.
I henhold til den systematiske gennemgang udført af Moyen et al. er der i gennemsnit 1,7 fejl/dag forbundet med processen for lægemiddeladministration på intensivafdelinger1 . På den anden side er de data, der er rapporteret af Merino et al. i en undersøgelse udført blandt spanske hospitalsintensivafdelinger, lidt bedre (1,13 medicineringsfejl for hver 100 patienter/dag).2 Alligevel er medicineringsfejl almindelige på intensivafdelinger og kræver omsorg fra sundhedspersonalet for at minimere dem.
Fejl ved administration af lægemidler på intensivafdelinger skyldes flere faktorer: Anvendelse af højrisikomedicin (vasoaktive lægemidler, inotrope midler, beroligende midler osv.), der ofte administreres i lave doser på grund af deres høje lægemiddelstyrke, hvilket kræver fortynding og en forudgående vurdering før administrationen. En anden faktor er ordination af doser i forskellige måleenheder eller det store antal lægemidler, der anvendes til hver patient. Selv om det er et vigtigt fremskridt med hensyn til sikkerhed, er brugen af intelligente infusionspumper blevet forbundet med et betydeligt antal eller medicineringsfejl på grund af programmeringsproblemer.3
Kombinationen af disse risikofaktorer øger risikoen for at begå fejl hos de mest sårbare patienter på grund af deres alvorlighed. Kritisk syge patienter har ofte begrænsede venøse adgangsveje. Det betyder, at forskellige lægemidler gives ved hjælp af den samme indgiftsvej, hvilket øger risikoen ved blanding af uforenelige lægemidler. Blanding af inkompatible lægemidler er en medicineringsfejl, der kan have alvorlige konsekvenser for patienten som f.eks. terapeutiske fejl, mikroemboli eller toksicitet.4
Y-site infusion af 2 lægemidler kræver, at begge lægemidler er fysisk kompatible.5 Denne samadministration sker ved blanding af lægemidler i forholdet 1:1 og i fravær af synlige tegn på inkompatibilitet som fældning eller ændring i farve. På den anden side skal blandingen være kemisk stabil for at sikre en sikker samadministration af 2 lægemidler i samme fortyndingsmiddel. Det betyder, at der er behov for en forudgående bekræftelse af, at der ikke er sket nogen væsentlig ændring i koncentrationen af nogen af de lægemidler, der er til stede i blandingen.6
Standardisering af koncentrationen af infusionsopløsninger er en af de mest nyttige foranstaltninger til forebyggelse af medicineringsfejl på intensivafdelingen, især i forbindelse med højrisikomedicin på grund af deres potentiale til at forårsage alvorlig skade, og fordi de har den højeste forekomst af medicineringsfejl.
En anden stærkt anbefalet foranstaltning til sikker administration af lægemidler er at have pålidelige oplysninger til rådighed om lægemiddelkompatibilitet ved administration af almindelige lægemidler til kritisk syge patienter. Oplysninger om lægemiddelkompatibilitet er imidlertid sparsomme og i mange tilfælde vanskelige at fortolke på grund af de forskellige koncentrationer, der anvendes, manglende oplysninger om de anvendte vurderingsteknikker eller kildernes tvivlsomme tekniske kvalitet. Manglen på oplysninger om den sikre blanding af to lægemidler skaber problemer i det daglige arbejde for sygeplejeteams på intensivafdelingen. Ud over risikoen for komplikationer i forbindelse med indgift af 2 inkompatible molekyler kan denne mangel på oplysninger få sygeplejersken til at lede efter nye venøse adgange for at indgive lægemidlerne separat, hvilket øger risikoen for infektiøse eller tromboemboliske komplikationer.
Målet med denne gennemgang er at samle de oplysninger, der er offentliggjort om den fysiske og kemiske kompatibilitet mellem de mest almindeligt anvendte lægemidler på en intensivafdeling, når de infunderes gennem den samme linje via et Y-sted. Desuden at vurdere kvaliteten af de offentliggjorte oplysninger og generere et kompatibilitetsskema med pålidelige og opdaterede oplysninger for at forbedre sikkerheden ved administration af lægemidler til kritisk syge patienter.
MetodologiSøgestrategi
Der blev foretaget en systematisk søgning i databaserne Medline, Stabilis, Handbook on Injectable Drugs og Micromedex med henblik på identifikation af originale artikler, oversigtsartikler og metaanalyser om lægemidlers fysiske og kemiske kompatibilitet. På grund af deres kliniske tilgang og mangel på metodologi til bestemmelse af fysisk og kemisk stabilitet blev casestudier udelukket. De oversigter, der er offentliggjort af Kanji et al. og López-Cabezas et al.5,7 , blev anvendt som referencepunkt. Søgningen fokuserede på lægemiddelkombinationer, som disse forfattere ikke havde oplysninger om eller ikke havde søgt efter oplysninger om. Årene for offentliggørelsen af undersøgelserne gik fra1990’erne til december 2017, og de inkluderede sprog var engelsk, spansk og fransk. Søgestrategien bestod i at bruge flere termer, der beskrev de oplysninger af interesse, for at kombinere dem med den boolske operatør “OR” efterfulgt af en forfinet søgning ved hjælp af operatoren “AND”. De anvendte termer var fysisk kompatibilitet, lægemiddelstabilitet, y-sted, y-injektion, intravenøst lægemiddel samt navne og synonymer for de lægemidler af interesse.
De lægemidler, der blev anvendt i gennemgangen, anvendes rutinemæssigt på intensivafdelingen og administreres ofte ved kontinuerlig infusion. De koncentrationer, der anvendes som reference, er dem, der er standardiseret i vores center7 for disse lægemidler, og de er i overensstemmelse med dem, der almindeligvis anvendes på de fleste intensivafdelinger (tabel 1). Alle oplysninger om kompatibilitet, der er fundet for et bestemt molekyle om et andet koncentrationsinterval, er vist i tabel 2. Referencesøgningsprocessen for hvert lægemiddel blev udført samtidig af 2 uafhængige forskere.
Studiemedicin og koncentrationer, der blev anvendt som reference for den bibliografiske søgning.
| Drug | Standardkoncentration | Drug | Standardkoncentration | |
|---|---|---|---|---|
| Adrenalin | 40mcg/mL | Isoproterenol | 4mcg/mL | |
| Amiodaron | 3.6mg/mL | Ketamin | 50mg/mL | |
| Argatroban | 1mg/mL | Labetalol | 2mg/mL | |
| Bicarbonat | 1mmol/L | Magnesium sulfat | 15mg/mL | |
| Calciumchlorid | 10mg/mL | Meropenem | 30mg/mL | |
| Kalciumgluconat | 10mg/mL | Methadon | 0.2mg/mL | |
| Ceftazidim | 24mg/mL | Midazolam | 4mg/mL | |
| Cisatracurium | 2mg/mL | Milrinon | 0.2mg/mL | |
| Clonidin | 7.5mcg/mL | N-acetylcystein | 50mg/mL | |
| Morfinchlorid | 1mg/mL | Naloxon | 8mcg/mL | |
| Dexmedetomidin | 4mcg/mL | Nitroglycerin | 0.2mg/mL | |
| Diltiazem | 1mg/mL | Nitroprussid | 0.2mg/mL | |
| Dobutamin | 8mg/mL | Noradrenalin | 0.32mg/mL | |
| Dopamin | 8mg/mL | Pantoprazol | 0.32mg/mL | |
| Esomeprazol | 0.32mg/mL | Piperacillin-tazobactam | 64mg/mL | |
| Phenylephrin | 0.2mg/mL | Kaliumklorid | 120mEq/L | |
| Fentanyl | 30mcg/mL | Propofol | 10mg/mL | |
| Flumazenil | 40mcg/mL | Remifentanil | 20mcg/mL | |
| Furosemid | 2mg/mL | Somatostatin | 24mcg/mL | |
| Sodiumheparin | 50IU/mL | Vecuronium | 0.2mg/mL | |
| Insulin | 1 IE/mL | Verapamil | 0,1mg/mL |
Kombinationer af fysisk og kemisk kompatible lægemidler med koncentrationer under referencemærket.
| Drug#1 | Maksimal forenelig koncentration | Maksimal forenelig koncentration | Drug#2 | Maksimal forenelig koncentration |
|---|---|---|---|---|
| Adrenalin | 32mcg/mL | Pantoprazol | 0.8mg/mL | |
| 2mcg/mL | Verapamil | 0.08mg/mL | ||
| Amiodaron | 4mg/mL | Phenylephrin | 0.04mg/mL | |
| 6mg/mL | Furosemid | 1mg/mL | ||
| 15mg/mL | Nitroprussid | 0.3mg/mL | ||
| Calciumchlorid | 4mg/mL | Dobutamin | 4mg/mL | |
| Calciumgluconat | 4mg/mL | Dobutamin | 4mg/mL | |
| Ceftazidim | 120mg/mL | Dobutamin | 1mg/mL | |
| 120mg/mL | Dopamin | 0.4mg/mL | ||
| 125mg/mL | Ketamin | 10mg/mL | ||
| Dobutamin | 1mg/mL | Heparin | 50IU/mL | |
| 4mg/mL | Magnesiumsulfat | 40mg/mL | ||
| 4mg/mL | Kaliumklorid | 60mEq/L | ||
| Dopamin | 3.2mg/mL | Midazolam | 2mg/mL | |
| Fentanyl | 12.5mcg/mL | Remifentanil | 0.25mg/mL | |
| Heparin | 20IU/mL | Verapamil | 0.08mg/mL | |
| Isoproterenol | 4mcg/mL | Magnesiumsulfat | 1mg/mL | |
| 200mcg/mL | Kaliumchlorid | 40mEq/L | ||
| 4mcg/mL | Vecuronium | 0.1mg/mL | ||
| 10mcg/mL | Verapamil | 0.08mg/mL | ||
| Meropenem | 22mg/mL | Kaliumchlorid | 40mEq/L | |
| Naloxon | 0.8mcg/mL | Verapamil | 0.08mg/mL | |
| Nitroglycerin | 0.1mg/mL | Verapamil | 0.08mg/mL | |
| Nitroprussid | 0.2mg/mL | Vecuronium | 0.1mg/mL | |
| 0.1mg/mL | Verapamil | 0.08mg/mL | ||
| Noradrenalin | 0.008mg/mL | Verapamil | 0.08mg/mL | |
| Piperacillin-tazobactam | 40mg/mL | Dexmedetomidin | 4mcg/mL | |
| 40mg/mL | Remifentanil | 250mcg/mL | ||
| Kalium chlorid | 100mEq/L | Remifentanil | 250mcg/mL |
Det er i overensstemmelse med de grå felter angivet som I/C som vist i fig. 2.
Udvælgelse af studier
Efter referencesøgningen vurderede 2 uafhængige reviewere kvaliteten af studierne ved hjælp af en peer-review-proces. Denne gennemgang blev udført efter kvalitetskriterier baseret på ekspertudtalelser og efter retningslinjer for klinisk praksis8-11:
-
Studiernes reproducerbarhed: beskrivelse af aktiv bestanddel og fortyndingsmiddel, undersøgelsesbetingelser og metodologi.
-
Antal af gennemførte forsøg (mindst i tre eksemplarer)
-
Tidsforløb ved udtagning af prøverne i stabilitetsanalysen: Der anbefales en prøvetid på 5 gange, herunder en prøvetid på 0.
-
Studier udført for at vurdere blandingens stabilitet: (a) gennemsigtighed: for synlige partikler: observation med et mat sort panel, automatisk partikeltælling eller turbidimetri; for usynlige partikler: anvendelse af optisk mikroskopi, spektrofotometri eller turbidimetri; b) farveændring: visuel inspektion eller spektrofotometri; c) gasdannelse: visuel inspektion; d) pH; og e) kemisk stabilitet: måling af variationen i koncentrationen af de 2 stoffer.
Oprettelse af resultatdiagram
Der blev udarbejdet et diagram med alle mulige kombinationer af de pågældende lægemidler. Felterne blev navngivet med et “C”, hvis blandingen var kompatibel, med et “I”, hvis den var uforenelig, og med “I/C”, hvis stabiliteten var afhængig af særlige betingelser. Lægemiddelkombinationer uden kompatibilitetsdata blev efterladt uden afkrydsning.
ResultaterResultatet af referencesøgning
I alt blev der identificeret 48 artikler. Fig. 1 viser udvælgelsesprocessen. Ud af de 29 artikler, der blev inkluderet i gennemgangen, var 4 skrevet på spansk, 3 på fransk og 22 på engelsk. Med hensyn til udgivelsesdatoer blev 8 artikler offentliggjort mellem 1990 og 1999, 10 mellem 2000 og 2009, og de resterende 11 artikler blev offentliggjort mellem 2010 og 2017.
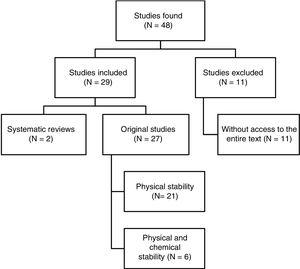
Struktureret resumé af resultaterne af referencesøgningen.
Kvaliteten af de fundne undersøgelser
Ingen af de undersøgte artikler opfyldte alle de kvalitetskriterier, der er fastsat i denne gennemgang. 93 % af artiklerne beskrev dog betingelserne og metodologien for undersøgelsen tilstrækkeligt detaljeret til at garantere dens reproducerbarhed.
Testene blev kun udført i tre eksemplarer i 26 % af tilfældene. Tværtimod fulgte 81 % af undersøgelserne anbefalingen om at tage prøver på tidspunkt 0, selv om kun 10 opnåede en prøve på 5 forskellige tidspunkter.
Med hensyn til de forsøg, der blev udført for at vurdere prøvernes stabilitet, vurderede alle undersøgelser gennemsigtigheden, mens 93 % af undersøgelserne rapporterede en ændring i farven ved visuel inspektion. Andre metoder blev anvendt i 16 undersøgelser (59 %) for at se subsynlige partikler. 67 % af undersøgelserne vurderede gasdannelse, og kun 12 målte pH-ændringer i tid. Kun 6 undersøgelser vurderede blandingernes kemiske stabilitet, idet højopløsningsvæskekromatografi var den metode, der blev anvendt i 5 undersøgelser til at måle koncentrationen af blandingens aktive bestanddele.
Resultaterne vedrørende dette afsnit er sammenfattet i tabel 3.
Resumé af kvalitetskriterierne for de offentliggjorte artikler.
| Kvalitetsindikator | Antal undersøgelser (%) | ||
|---|---|---|---|
| Bedømmelse af udfældningsdannelse | 27 (100) | 12,13,16-40 | |
| Bedømmelse af farveændring | 25 (93) | 12,13,16-27,30-40 | |
| Måling af pH-ændring | 12 (44) | 12,13,16,18,19,22,22,26,27,29,38,39 | |
| Bedømmelse af gasdannelse | 18 (67) | 12,13,17,19-21,24-26,31,33-40 | |
| Analyse udført i tre eksemplarer | 7 (26) | 18,21,22,29,34,35,38 | |
| Beskrivelse af den anvendte metodologi (omfatter antal og hyppighed af observationer og undersøgelsesbetingelser) | 24 (89) | 12,13,17-24,26-33,35-40 | |
| Beskrivelse af fortyndingsmidler for alle undersøgelsens lægemidler | 21 (78) | 13,17-29,33,35-40 | |
| Beskrivelse af undersøgelsesmodtagernes materiale | 22 (81) | 12,13,17-31,33,36-39 | |
| Kemisk stabilitet | 6 (22) | 16,18,19,22,29,38 |
Resultater af fysisk og kemisk kompatibilitet
Fireogfyrre lægemidler, der anvendes i kontinuerlig perfusion på intensivafdelingen, blev udvalgt, herunder en opløsning til parenteral ernæring med og uden lipider og 3 beta-lactam-antibiotika. Kompatibiliteten af disse er vist i fig. 2. De data, der blev indhentet ved de gennemgange, der blev foretaget af Kanji et al. og López-Cabezas et al., gav oplysninger om kompatibilitet for 393 ud af 945 mulige kombinationer.5,7 Efter afslutningen af den systematiske gennemgang blev der tilføjet nye stabilitetsdata for 82 lægemiddelkombinationer. De nye resultater afslørede 29 kompatible kombinationer, 27 uforenelige kombinationer og 26 kompatible kombinationer under specifikke forhold. Den endelige tabel viser derfor kompatibilitetsdata for 475 ud af 945 mulige kombinationer af 2 lægemidler (50,3 %). Heraf er 366 kompatible (77,1 %), 80 er inkompatible (16,8 %) og 29 er kompatible under specifikke forhold (6,1 %), som det fremgår af tabel 2.

Summarum over fysisk og kemisk kompatibilitet. C, kompatibel; I, inkompatibel; I/C, kompatibel under særlige forhold. Stiplede felter viser, at blandingen kun er kompatibel med glykosyleret serum. Kasser med diagonale linjer viser kun kompatibilitet med fysiologisk serum.
Diskussion
At sikre, at brugen af lægemidler er sikker, er en af de vigtigste forpligtelser, som sundhedspersonalet har indgået over for deres patienter. På intensivafdelingen og i betragtning af den enorme mængde af IV-medicin, der administreres, og patienternes begrænsede antal administrationsveje, er denne sikkerhed undertiden kompromitteret på grund af de risici, der er forbundet med samadministration af inkompatible lægemidler til særligt sårbare patienter.
Onlinedatabaser som Stabilis 4.0 er meget nyttige til at søge efter oplysninger om lægemiddelkompatibilitet. Det personale, der administrerer lægemidlerne, finder imidlertid skemaer meget mere nyttige, fordi de hurtigt kan se de oplysninger, de har brug for på et givet tidspunkt. Dette er især interessant i akutte situationer, hvor enhver forsinkelse forårsaget af sundhedspersonalet kan få konsekvenser for patienten.
Denne gennemgang fokuserede på at analysere den fysiske og kemiske kompatibilitet af de IV-medikamenter, der oftest anvendes via Y-site-infusion på intensivafdelingen, og sammenfatte de opnåede oplysninger i et skema med dobbeltindtastning. Fysiske kompatibilitetsundersøgelser er de mest almindelige af alle, fordi de er lette at udføre. Kemiske stabilitetsundersøgelser er det derimod ikke, fordi de kræver mere sofistikerede analyseteknikker til bestemmelse af lægemidlernes start- og slutkoncentration.
På trods af dette er antallet af undersøgte lægemiddelkombinationer stadig utilstrækkeligt. Som det fremgår af fig. 2, kunne vi ikke finde oplysninger om den fysiske og kemiske kompatibilitet for alle de foreslåede kombinationer; for flumazenil og piperacillin-tazobactam kunne vi f.eks. kun bestemme stabiliteten med 4 lægemidler, og i begge tilfælde forblev de 39 resterende kombinationer uden oplysninger.
Selv hvis vi tog alle de foreslåede mulige kombinationer i betragtning og tilføjede de nye fundne data, ville vi stadig have nul oplysninger om den fysiske og kemiske kompatibilitet for 470 kombinationer. Det betyder, at vi kun har data til rådighed for 50,3 % af alle de foreslåede mulige kombinationer.
De mest problematiske kombinationer med hensyn til uforenelighed er lægemidler, hvis stabilitet er tæt knyttet til pH-intervallet; dette er tilfældet med natriumbicarbonat, furosemid eller pantoprazol. Furosemid kræver f.eks. en basisk pH-værdi for at garantere molekylets stabilitet i opløsning, hvorfor blandingen med sure lægemidler (pH
4) forårsager turbiditet og udfældning.12
Forekomsten af hjælpestoffer i den farmaceutiske formulering, koncentrationen og eksponering for ekstreme temperaturer eller lysstyrke er andre faktorer, der er forbundet med lægemiddelinkompatibilitet.13 Der er tilfælde, hvor en given lægemiddelkombination kan være stabil i et bestemt fortyndingsmiddel og uforenelig i et andet; f.eks. er dopamin kun foreneligt med amiodaron, når begge er opløst i glykosyleret serum på 5 %, fordi sidstnævnte er ustabilt i saltvandsløsninger på 0,9 %. Hvis denne angiveligt kompatible blanding udføres i fysiologisk serum, kan der således forekomme et koncentrationstab af amiodaron med den tilsvarende risiko for manglende terapeutisk respons.
På den anden side kan kvaliteten af de hidtil offentliggjorte undersøgelser i mange tilfælde være bedre. Det ville være godt med en større ensartethed i kvalitetsstandarderne for denne type undersøgelser. For eksempel, selv om pH er en kritisk faktor for stabiliteten af lægemidler i opløsning, blev den kun verificeret i 12 af de 27 artikler. På samme måde er turbidimetri eller mikroskopi – mere præcise teknikker end visuel observation til påvisning af partikler og farveændringer – underudnyttet. I løbet af de sidste par år har flere eksperter offentliggjort retningslinjer for udformning af lægemiddelstabilitetsundersøgelser.8-11 Vi kan kun håbe, at dette vil forbedre den generelle kvalitet af denne type undersøgelser i fremtiden.
Forfattere har offentliggjort anmeldelser af disse karakteristika. F.eks. undersøgte Flamein et al.14 dette problem på neonatale intensivafdelinger; Knudsen et al.15 kastede lys over analgetika og sedativa’s kompatibilitet. Vores gennemgang er baseret på det tidligere arbejde udført af Kanji et al.5 i Canada og López-Cabezas.7 i Spanien. Den er blevet suppleret med de nye oplysninger, der er tilgængelige om lægemidler i vores omgivelser, og data om de mest anvendte koncentrationer af lægemidler.
I alt fandt vi oplysninger om 82 nye lægemiddelkombinationer fra 27 forskellige referencer, herunder kombinationer af 3 beta-lactam-antibiotika (ceftazidim, meropenem og piperacillin-tazobactam), der er meget udbredt på intensivafdelinger. I løbet af de sidste par år er de farmakokinetiske fordele ved en forlænget perfusionsvej til administration af disse 3 antibiotika blevet bekræftet.16-19
Perfusioner med lægemiddelkoncentrationer, der overstiger de sædvanlige, anvendes ofte hos den kritisk syge patient. I denne forstand kunne vi ikke finde data om alle lægemiddelkombinationer med hensyn til de høje koncentrationer, der anvendes på intensivafdelingen (tabel 1); i nogle tilfælde fik vi dog oplysninger om lavere koncentrationer end dem, der er rapporteret i denne gennemgang. Disse tilfælde er vist på kompatibilitetsdiagrammet (fig. 2) som betinget kompatibilitet (I/C), dvs. at kombinationen var blevet undersøgt ved en anden koncentration end standardkoncentrationen.
De stabilitetsdata, der er rapporteret i denne gennemgang, kan ikke generaliseres til andre lægemiddelkombinationer eller koncentrationer, der er forskellige fra dem, der er beskrevet. Desuden vedrører oplysningerne 2 lægemiddelkombinationer, og der kan forekomme inkompatibiliteter med>2 lægemiddelkombinationer ad gangen, hvilket i høj grad ikke er tilrådeligt. Ikke desto mindre er de udvalgte lægemidler og koncentrationer de mest anvendte på voksenintensivafdelinger på de fleste hospitaler.
Så længe vi ikke har nye og bedre kompatibilitetsundersøgelser, der kaster lys over dette spørgsmål, kan denne gennemgang være en letlæselig opdatering af den foreliggende dokumentation for kompatibiliteten af de lægemidler, der er mest almindeligt anvendt på intensivafdelinger. Dens mål er at bidrage til sikker administration af lægemidler til patienter, der kan stå over for konsekvenserne af større alvor på grund af deres skrøbelighed.
Autors bidrag
Genís Castells Lao: undersøgelsesdesign og idé, data mining, analyse og fortolkning af data; papirudkast eller kritisk gennemgang af det intellektuelle materiale; og endelig godkendelse af denne version.
Montse Rodríguez Reyes: undersøgelsesdesign og idé, data mining, analyse og fortolkning af data; papirudkast eller kritisk gennemgang af det intellektuelle materiale; og endelig godkendelse af denne version.
Judit Roura Turet: data mining, analyse og fortolkning af data; papirudkast eller kritisk gennemgang af det intellektuelle materiale; og endelig godkendelse af denne version.
Marta Prat Dot: data mining, analyse og fortolkning af data; udkast til papir eller kritisk gennemgang af det intellektuelle materiale; og endelig godkendelse af denne version.
Dolors Soy Muner: undersøgelsesdesign og idé; udkast til papir eller kritisk gennemgang af det intellektuelle materiale; og endelig godkendelse af denne version.
Carmen López Cabezas: undersøgelsesdesign og idé, data mining, analyse og fortolkning af data; udkast til papir eller kritisk gennemgang af det intellektuelle materiale; og endelig godkendelse af denne version.
Interessekonflikter
Forfatterne erklærede ingen interessekonflikter overhovedet.