Introducción
Los pacientes ingresados en las unidades de cuidados intensivos (UCI) suelen requerir la administración intravenosa de varios fármacos. Los fármacos vasoactivos, los analgésicos y los sedantes se encuentran entre los grupos terapéuticos más utilizados y suelen administrarse en infusión continua.
Según la revisión sistemática realizada por Moyen et al. existe una media de 1,7 errores/día asociados al proceso de administración de fármacos en el ámbito de la UCI.1 Por otro lado, los datos reportados por Merino et al. en un estudio realizado entre las UCIs hospitalarias españolas son un poco mejores (1,13 errores de medicación por cada 100 pacientes/día).2 Aun así, los errores de medicación son comunes en las UCIs y requieren el cuidado de los profesionales sanitarios para minimizarlos.
Los errores en la administración de fármacos en las UCI se deben a varios factores: el uso de fármacos de alto riesgo (fármacos vasoactivos, inotrópicos, sedantes, etc.) a menudo administrados en dosis bajas debido a su alta potencia farmacológica, requiriendo una dilución y una valoración previa a su administración. Otro factor es la prescripción de dosis en diferentes unidades de medida o el elevado número de fármacos utilizados con cada paciente. Aunque es un avance importante en materia de seguridad, el uso de bombas de infusión inteligentes se ha asociado a un número importante de errores de medicación por problemas de programación.3
La combinación de estos factores de riesgo aumenta las posibilidades de cometer errores en los pacientes más vulnerables por su gravedad. Los pacientes críticos suelen tener accesos venosos limitados. Esto significa que se administran diferentes fármacos utilizando la misma vía de administración, lo que aumenta los riesgos al mezclar fármacos incompatibles. La mezcla de fármacos incompatibles es un error de medicación que puede tener graves consecuencias para el paciente, como fallos terapéuticos, microembolismo o toxicidad.4
La infusión en Y de 2 fármacos requiere que ambos sean físicamente compatibles.5 Esta coadministración se produce cuando se mezclan fármacos en una proporción 1:1 y en ausencia de signos visibles de incompatibilidad como precipitación o cambio de color. Por otro lado, para la coadministración segura de 2 fármacos en el mismo diluyente, la mezcla debe ser químicamente estable. Esto significa que se necesita una confirmación previa de que no se ha producido ningún cambio significativo en la concentración de ninguno de los fármacos presentes en la mezcla.6
La estandarización de la concentración de las soluciones de infusión es una de las medidas más útiles para prevenir los errores de medicación en el entorno de la UCI, especialmente en los fármacos de alto riesgo debido a su potencial para causar daños graves y porque tienen la mayor incidencia de errores de medicación.
Otra medida muy recomendable para la administración segura de fármacos es disponer de información fiable sobre la compatibilidad de los fármacos cuando se administran fármacos comunes en pacientes críticos. Sin embargo, la información sobre la compatibilidad de los fármacos es escasa y, en muchas ocasiones, difícil de interpretar debido a las diferentes concentraciones utilizadas, a la falta de información sobre las técnicas de evaluación utilizadas o a la sospechosa calidad técnica de las fuentes. La falta de información sobre la mezcla segura de 2 fármacos genera problemas en el trabajo diario de los equipos de enfermería de las UCI. Además del riesgo de complicaciones asociadas a la administración de 2 moléculas incompatibles, esta falta de información puede hacer que la enfermera tenga que buscar nuevos accesos venosos para administrar los fármacos por separado, lo que aumenta el riesgo de complicaciones infecciosas o tromboembólicas.
El objetivo de esta revisión es recopilar la información publicada sobre la compatibilidad física y química de los fármacos más utilizados en una UCI cuando se infunden a través de la misma vía por un sitio en Y. Asimismo, evaluar la calidad de la información publicada y generar una tabla de compatibilidad con información fiable y actualizada para mejorar la seguridad en la administración de fármacos a pacientes críticos.
MetodologíaEstrategia de búsqueda
Se realizó una búsqueda sistemática en las bases de datos Medline, Stabilis, Handbook on Injectable Drugs y Micromedex para la identificación de trabajos originales, artículos de revisión y meta-análisis sobre la compatibilidad física y química de los fármacos. Debido a su enfoque clínico y a la falta de metodología para determinar la estabilidad física y química, se descartaron los estudios de casos. Se utilizaron como referencia las revisiones publicadas por Kanji et al. y López-Cabezas et al.5,7. La búsqueda se centró en las combinaciones de fármacos sobre las que estos autores no tenían información o no la habían buscado. Los años de publicación de los estudios fueron desde la década de 1990 hasta diciembre de 2017 y los idiomas incluidos fueron inglés, español y francés. La estrategia de búsqueda consistió en utilizar múltiples términos que describieran la información de interés para combinarlos con el operador booleano «OR», seguido de una búsqueda refinada con el operador «AND». Los términos utilizados fueron compatibilidad física, estabilidad del fármaco, sitio-y, inyección-y, fármaco intravenoso, además de los nombres y sinónimos de los fármacos de interés.
Los fármacos utilizados en la revisión se emplean de forma rutinaria en el entorno de la UCI y suelen administrarse mediante infusión continua. Las concentraciones utilizadas como referencia son las estandarizadas en nuestro centro7 para estos fármacos y son consistentes con las utilizadas habitualmente en la mayoría de las UCIs (Tabla 1). Toda la información sobre la compatibilidad encontrada para una determinada molécula sobre un intervalo de concentración diferente se muestra en la Tabla 2. El proceso de búsqueda de referencias para cada fármaco fue realizado simultáneamente por 2 investigadores independientes.
Fármacos de estudio y concentraciones utilizadas como referencia para la búsqueda bibliográfica.
| Fármaco | Concentración estándar | Fármaco | Concentración estándar |
|---|---|---|---|
| Adrenalina | 40mcg/mL | Isoproterenol | 4mcg/mL |
| Amiodarona | 3.6mg/mL | Cetamina | 50mg/mL |
| Argatroban | 1mg/mL | Labetalol | 2mg/mL |
| Bicarbonato | 1mmol/L | Magnesio sulfato | 15mg/mL |
| Cloruro de calcio | 10mg/mL | Meropenem | 30mg/mL |
| Gluconato de calcio | 10mg/mL | Metadona | 0.2mg/mL |
| Ceftazidima | 24mg/mL | Midazolam | 4mg/mL |
| Cisatracurio | 2mg/mL | Milrinona | 0.2mg/mL |
| Clonidina | 7.5mcg/mL | N-acetilcisteína | 50mg/mL |
| Cloruro de morfina | 1mg/mL | Naloxona | 8mcg/mL |
| Dexmedetomidina | 4mcg/mL | Nitroglicerina | 0.2mg/mL |
| Diltiazem | 1mg/mL | Nitroprusiato | 0,2mg/mL |
| Dobutamina | 8mg/mL | Noradrenalina | 0.32mg/mL |
| Dopamina | 8mg/mL | Pantoprazol | 0,32mg/mL |
| Esomeprazol | 0.32mg/mL | Piperacilina-tazobactam | 64mg/mL |
| Fenilefrina | 0.2mg/mL | Cloruro de potasio | 120mEq/L |
| Fentanilo | 30mcg/mL | Propofol | 10mg/mL |
| Flumazenil | 40mcg/mL | Remifentanil | 20mcg/mL |
| Furosemida | 2mg/mL | Somatostatina | 24mcg/mL |
| Heparina sódica | 50IU/mL | Vecuronio | 0.2mg/mL |
| Insulina | 1IU/mL | Verapamilo | 0,1mg/mL |
Combinaciones de medicamentos física y químicamente compatibles con concentraciones inferiores a la marca de referencia.
| Fármaco#1 | Máxima concentración compatible | Fármaco#2 | Concentración máxima compatible |
|---|---|---|---|
| Adrenalina | 32mcg/mL | Pantoprazol | 0.8mg/mL |
| 2mcg/mL | Verapamilo | 0,08mg/mL | |
| Amiodarona | 4mg/mL | Fenilefrina | 0.04mg/mL |
| 6mg/mL | Furosemida | 1mg/mL | |
| 15mg/mL | Nitroprusiato | 0.3mg/mL | |
| Cloruro de calcio | 4mg/mL | Dobutamina | 4mg/mL |
| Gluconato de calcio | 4mg/mL | Dobutamina | 4mg/mL |
| Ceftazidima | 120mg/mL | Dobutamina | 1mg/mL |
| 120mg/mL | Dopamina | 0.4mg/mL | |
| 125mg/mL | Ketamina | 10mg/mL | |
| Dobutamina | 1mg/mL | Heparina | 50IU/mL |
| 4mg/mL | Sulfato de magnesio | 40mg/mL | |
| 4mg/mL | Cloruro de potasio | 60mEq/L | |
| Dopamina | 3.2mg/mL | Midazolam | 2mg/mL |
| Fentanilo | 12.5mcg/mL | Remifentanilo | 0,25mg/mL |
| Heparina | 20IU/mL | Verapamilo | 0.08mg/mL |
| Isoproterenol | 4mcg/mL | Sulfato de magnesio | 1mg/mL |
| 200mcg/mL | Cloruro de potasio | 40mEq/L | |
| 4mcg/mL | Vecuronio | 0.1mg/mL | |
| 10mcg/mL | Verapamilo | 0.08mg/mL | |
| Meropenem | 22mg/mL | Cloruro de potasio | 40mEq/L |
| Naloxona | 0,8mcg/mL | Verapamil | 0.08mg/mL |
| Nitroglicerina | 0,1mg/mL | Verapamilo | 0,08mg/mL |
| Nitroprusiato | 0,2mg/mL | Vecuronio | 0.1mg/mL |
| 0,1mg/mL | Verapamilo | 0,08mg/mL | |
| Noradrenalina | 0,008mg/mL | Verapamilo | 0.08mg/mL |
| Piperacilina-tazobactam | 40mg/mL | Dexmedetomidina | 4mcg/mL |
| 40mg/mL | Remifentanilo | 250mcg/mL | |
| Cloruro de potasio cloruro de potasio | 100mEq/L | Remifentanilo | 250mcg/mL |
Es consistente con las cajas grises especificadas como I/C como se muestra en la Fig. 2.
Selección de estudios
Tras la búsqueda de referencias, 2 revisores independientes evaluaron la calidad de los estudios mediante un proceso de revisión por pares. Esta revisión se realizó siguiendo criterios de calidad basados en la opinión de expertos y siguiendo las guías de práctica clínica8-11:
-
Reproducibilidad de los estudios: descripción del principio activo y del diluyente, condiciones del estudio y metodología.
-
Número de pruebas realizadas (al menos por triplicado).
-
Tiempos transcurridos en la toma de muestras en el análisis de estabilidad: se recomienda un período de tiempo de muestreo de 5 veces, incluyendo un tiempo de muestreo de 0,
-
Estudios realizados para evaluar la estabilidad de la mezcla: (a) transparencia: para las partículas visibles, observación con un panel negro mate, recuento automático de partículas o turbidimetría; para las partículas subvisibles, uso de microscopía óptica, espectrofotometría o turbidimetría; b) cambio de color: inspección visual o espectrofotometría; c) formación de gas: inspección visual; d) pH; y e) estabilidad química: medición de la variación de la concentración de los 2 fármacos.
Creación de la tabla de resultados
Se creó una tabla con todas las posibles combinaciones de los fármacos de interés. Las casillas se nombraron con una «C» si la mezcla era compatible, con una «I» si era incompatible y con «I/C» si la estabilidad dependía de condiciones especiales. La combinación de fármacos sin datos de compatibilidad se dejó sin marcar.
ResultadosRealización de la búsqueda de referencias
Se identificaron un total de 48 trabajos. La Fig. 1 muestra el proceso de selección. De los 29 trabajos incluidos en la revisión, 4 estaban escritos en español, 3 en francés y 22 en inglés. En cuanto a las fechas de publicación, 8 trabajos fueron publicados entre 1990 y 1999, 10 entre 2000 y 2009, y los 11 restantes entre 2010 y 2017.
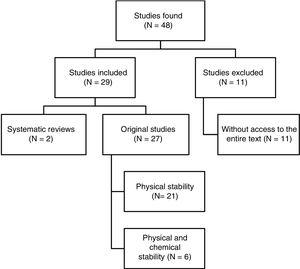
Resumen estructurado de los resultados de la búsqueda de referencias.
Calidad de los estudios encontrados
Ninguno de los trabajos estudiados cumplía todos los criterios de calidad establecidos en esta revisión. Sin embargo, el 93% de los trabajos describieron las condiciones y la metodología del estudio con suficiente detalle para garantizar su reproducibilidad.
Las pruebas se realizaron por triplicado sólo en el 26% de los casos. Por el contrario, el 81% de los estudios siguieron la recomendación de tomar las muestras en el momento 0, aunque sólo 10 obtuvieron una muestra en 5 momentos diferentes.
En cuanto a los ensayos realizados para evaluar la estabilidad de las muestras, todos los estudios evaluaron la transparencia, mientras que el 93% de los estudios informaron de un cambio de color mediante inspección visual. En 16 estudios (59%) se utilizaron otros métodos para ver las partículas subvisibles. El 67% de los estudios evaluaron la formación de gas y sólo 12 midieron los cambios de pH en el tiempo. Sólo 6 estudios evaluaron la estabilidad química de las mezclas siendo la cromatografía líquida de alta resolución el método utilizado en 5 estudios para medir la concentración de los ingredientes activos de la mezcla.
Los resultados sobre este apartado se resumen en la Tabla 3.
Resumen de los criterios de calidad de los trabajos publicados.
| Indicador de calidad | Número de estudios (%) | |
|---|---|---|
| Evaluación de la formación de precipitados | 27 (100) | 12,13,16-40 |
| Evaluación del cambio de color | 25 (93) | 12,13,16-2730-40 |
| Medición del cambio de pH | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 |
| Evaluación de la formación de gas | 18 (67) | 12,13,17,19-21,24-26,31,33-40 |
| Análisis realizados por triplicado | 7 (26) | 18,21,22,29,34,35,38 |
| Descripción de la metodología utilizada (incluye el número y la frecuencia de las observaciones y las condiciones de estudio) | 24 (89) | 12,13,17-24,26-33,35-40 |
| Descripción de los diluyentes de todos los medicamentos del estudio | 21 (78) | 13,17-29,33,35-40 |
| Descripción del material de los recipientes del estudio | 22 (81) | 1213,17-31,33,36-39 |
| Estabilidad química | 6 (22) | 16,18,19,22,29,38 |
Resultados de la compatibilidad física y química
Se seleccionaron 44 fármacos utilizados en perfusión continua en el entorno de la UCI, incluyendo una solución para nutrición parenteral con y sin lípidos y 3 antibióticos betalactámicos. La compatibilidad de los mismos se muestra en la Fig. 2. Los datos obtenidos por las revisiones realizadas por Kanji et al. y López-Cabezas et al. proporcionaron información sobre la compatibilidad de 393 de las 945 combinaciones posibles.5,7 Tras completar la revisión sistemática, se añadieron nuevos datos de estabilidad para 82 combinaciones de fármacos. Los nuevos datos revelaron 29 combinaciones compatibles, 27 incompatibles y 26 compatibles en condiciones específicas. Por tanto, la tabla final muestra los datos de compatibilidad de 475 de las 945 combinaciones posibles de 2 fármacos (50,3%). De ellas, 366 son compatibles (77,1%), 80 son incompatibles (16,8%) y 29 son compatibles en condiciones específicas (6,1%), como se muestra en la Tabla 2.

Resumen de las compatibilidades físicas y químicas. C, compatible; I, incompatible; I/C, compatible en condiciones especiales. Los recuadros punteados muestran que la mezcla es compatible únicamente con el suero glicosilado. Las cajas con líneas diagonales muestran la compatibilidad sólo con suero fisiológico.
Discusión
Asegurarse de que el uso de los fármacos es seguro es uno de los principales compromisos adquiridos por los profesionales sanitarios con sus pacientes. En el ámbito de la UCI y dada la enorme cantidad de fármacos administrados por vía intravenosa y el limitado número de vías de administración de los pacientes, esta seguridad se ve a veces comprometida debido a los riesgos que conlleva la coadministración de fármacos incompatibles en pacientes especialmente vulnerables.
Las bases de datos online como Stabilis 4.0 son muy útiles para buscar información sobre la compatibilidad de los fármacos. Sin embargo, el personal que administra los fármacos encuentra los gráficos mucho más útiles porque puede consultar rápidamente la información que necesita en un momento dado. Esto es especialmente interesante en situaciones de urgencia en las que cualquier retraso provocado por el personal sanitario puede tener consecuencias en el paciente.
Esta revisión se ha centrado en analizar la compatibilidad física y química de los fármacos intravenosos más utilizados mediante infusión en Y en el ámbito de la UCI y en resumir la información obtenida en una tabla de doble entrada. Los estudios de compatibilidad física son los más comunes de todos porque son fáciles de realizar. Los estudios de estabilidad química, sin embargo, no lo son porque requieren técnicas analíticas más sofisticadas para determinar la concentración inicial y final de los fármacos.
A pesar de ello, el número de combinaciones de fármacos estudiadas sigue siendo insuficiente. Como muestra la Fig. 2 no hemos podido encontrar ninguna información sobre la compatibilidad física y química de todas las combinaciones sugeridas; por ejemplo, en el caso del flumazenil y la piperacilina-tazobactam sólo pudimos determinar la estabilidad con 4 fármacos y en ambos casos las 39 combinaciones restantes quedaron sin información.
Incluso si tomáramos en consideración todas las posibles combinaciones sugeridas y añadiéramos los nuevos datos encontrados, seguiríamos teniendo cero información sobre la compatibilidad física y química de 470 combinaciones. Esto significa que sólo disponemos de datos para el 50,3% de todas las posibles combinaciones sugeridas.
Las combinaciones más problemáticas en cuanto a incompatibilidad son los fármacos cuya estabilidad está estrechamente ligada al intervalo de pH; este es el caso del bicarbonato sódico, la furosemida o el pantoprazol. La furosemida, por ejemplo, requiere un pH básico para garantizar la estabilidad de la molécula en solución, por lo que la mezcla con fármacos ácidos (pH
4) provoca turbidez y precipitación.12
La presencia de adyuvantes en la formulación farmacéutica, la concentración y la exposición a temperaturas extremas o la luminosidad son otros factores asociados a la incompatibilidad de los fármacos.13 Hay ocasiones en las que una determinada combinación de fármacos puede ser estable en un determinado diluyente e incompatible en otro; por ejemplo, la dopamina sólo es compatible con la amiodarona cuando ambas se disuelven en suero glucosado al 5% porque esta última es inestable en soluciones salinas al 0,9%. Así, si esta mezcla supuestamente compatible se realiza en suero fisiológico, puede producirse una pérdida de concentración de amiodarona con el correspondiente riesgo de falta de respuesta terapéutica.
Por otro lado, en muchos casos, la calidad de los estudios publicados hasta ahora puede ser mejor. Sería bueno tener una mayor uniformidad en los estándares de calidad de este tipo de estudios. Por ejemplo, aunque el pH es un factor crítico en la estabilidad de los fármacos en solución, sólo se verificó en 12 de los 27 trabajos. Del mismo modo, la turbidimetría o la microscopía -técnicas más precisas que la observación visual para la detección de partículas y cambios de color- están infrautilizadas. En los últimos años, varios expertos han publicado directrices para el diseño de estudios de estabilidad de fármacos.8-11 Sólo podemos esperar que esto mejore la calidad general de este tipo de estudios en el futuro.
Autores anteriores han publicado revisiones de estas características. Por ejemplo, Flamein et al.14 estudiaron este problema en las UCI neonatales; Knudsen et al.15 arrojaron luz sobre la compatibilidad de analgésicos y sedantes. Nuestra revisión se basa en los trabajos previos realizados por Kanji et al.5 en Canadá y López-Cabezas.7 en España. Se ha completado con la nueva información disponible sobre los fármacos en nuestro entorno y con datos sobre las concentraciones de fármacos más utilizadas.
En total, hemos encontrado información sobre 82 nuevas combinaciones de fármacos de 27 referencias diferentes, incluyendo combinaciones de 3 antibióticos betalactámicos (ceftazidima, meropenem y piperacilina-tazobactam) ampliamente utilizadas en el entorno de la UCI. En los últimos años se han confirmado las ventajas farmacocinéticas de una vía de administración de perfusión prolongada de estos 3 antibióticos.16-19
Las perfusiones a concentraciones de fármacos que superan las habituales se utilizan con frecuencia en el paciente crítico. En este sentido, no hemos podido encontrar datos sobre todas las combinaciones de fármacos en cuanto a las altas concentraciones utilizadas en el ámbito de la UCI (Tabla 1); sin embargo, en algunos casos, sí hemos obtenido información sobre concentraciones inferiores a las recogidas en esta revisión. Estos casos se muestran en la tabla de compatibilidad (Fig. 2) como compatibilidad condicionada (I/C), es decir, que la combinación había sido estudiada a una concentración diferente a la estándar.
Los datos de estabilidad comunicados en esta revisión no pueden generalizarse a otras combinaciones de fármacos o concentraciones diferentes a las descritas. Además, la información proporcionada se refiere a 2 combinaciones de fármacos, y puede haber incompatibilidades con>2 combinaciones de fármacos a la vez, lo que es altamente desaconsejable. No obstante, los fármacos y concentraciones seleccionados son los más utilizados en las UCI de adultos de la mayoría de los hospitales.
Hasta que no dispongamos de nuevos y mejores estudios de compatibilidad que arrojen algo de luz sobre esta cuestión, esta revisión puede ser una actualización de fácil lectura sobre la evidencia disponible sobre la compatibilidad de los fármacos más utilizados en el ámbito de las UCI. Su objetivo es contribuir a la administración segura de fármacos a pacientes que pueden enfrentarse a consecuencias de mayor gravedad debido a su fragilidad.
Contribución de los autores
Genís Castells Lao: diseño e idea del estudio, extracción de datos, análisis e interpretación de los mismos; borrador del trabajo o revisión crítica del material intelectual; y aprobación final de esta versión.
Montse Rodríguez Reyes: diseño e idea del estudio, extracción de datos, análisis e interpretación de datos; borrador del papel o revisión crítica del material intelectual; y aprobación final de esta versión.
Judit Roura Turet: extracción de datos, análisis e interpretación de datos; borrador del papel o revisión crítica del material intelectual; y aprobación final de esta versión.
Marta Prat Dot: extracción de datos, análisis e interpretación de datos; borrador del papel o revisión crítica del material intelectual; y aprobación final de esta versión.
Dolors Soy Muner: diseño e idea del estudio; borrador del papel o revisión crítica del material intelectual; y aprobación final de esta versión.
Carmen López Cabezas: diseño e idea del estudio, extracción de datos, análisis e interpretación de los datos; borrador del artículo o revisión crítica del material intelectual; y aprobación final de esta versión.
Conflictos de intereses
Los autores declararon no tener ningún conflicto de intereses.