Introducción
Las micosis profundas son infecciones poco frecuentes causadas por hongos; se dividen en micosis subcutáneas y sistémicas.1 Mientras que las manifestaciones cutáneas siempre se producen en las micosis subcutáneas, o micosis de implantación, como también se conocen, sólo se ven ocasionalmente en las micosis sistémicas. En estos casos, la piel se ve afectada directamente, por la penetración del hongo en la dermis, o indirectamente, por una infección que se ha extendido desde un foco más profundo. Según Rezusta et al2 , la mayoría de las micosis subcutáneas y sistémicas en España son importadas, con algunas excepciones (por ejemplo, la mucormicosis). Faltan datos epidemiológicos sobre la prevalencia e incidencia de las micosis en España.
Micosis subcutáneas
Las micosis subcutáneas comprenden varias entidades clínicas causadas por la invasión de la piel y el tejido subcutáneo por hongos saprofitos que viven en el suelo y la vegetación. Sin embargo, aunque los cortes y las heridas son muy frecuentes en las personas que viven en zonas rurales, en general, hay muy pocos casos de micosis subcutáneas.1
La vía de entrada típica del hongo es la inoculación traumática a través de material contaminado, como astillas, espinas u otros objetos punzantes, lo que explica que las micosis subcutáneas también se denominen micosis de implantación.3
Aunque los hongos responsables de las micosis subcutáneas son taxonómicamente heterogéneos, están unificados por el hecho de que comparten la misma vía de entrada. Cualquiera de estas infecciones puede afectar a personas que han viajado a zonas endémicas, incluso años después de su regreso.
Las micosis subcutáneas más comunes son la esporotricosis, la cromoblastomicosis y el micetoma.1 Otras entidades menos comunes son lacaziosis, feohifomicosis, hialofomicosis y conidiobolomicosis.
Esporotricosis
La esporotricosis es una infección subaguda o crónica causada por hongos dimórficos, el más común de los cuales es Sporothrix schenckii.4,5 Estos hongos son universales, aunque son más comunes en zonas tropicales y subtropicales. La incidencia estimada de la esporotricosis en Sudamérica es de entre 48 y 60 casos por cada 100.000 habitantes al año.6,7 Sólo se han descrito unos pocos casos autóctonos en España y otras partes de Europa,8 y la mayoría de los casos en estas zonas son importados.9
Los agentes causantes pertenecen a un complejo de especies conocido como S schenckii,10,11 que comprende Sporothrix brasiliensis, Sporothrix mexicana, Sporothrix luriei, Sporothrix pallida (antes Sporothrix albicans) y Sporothrix schenckii sensu lato (sl.), que es el más común de los cinco.12
Tras un periodo de incubación de 15 a 30 días, la inoculación traumática por Sporothrix spp. da lugar a una infección crónica caracterizada por lesiones nodulares en el tejido cutáneo y subcutáneo asociadas a linfangitis en la zona afectada.
Sporothrix spp. vive en la vegetación, las plantas o los restos vegetales del suelo, por lo que las infecciones son más frecuentes en los trabajadores agrícolas y en las personas que trabajan en zonas abiertas. La esporotricosis se considera una enfermedad profesional en guardas forestales, horticultores, jardineros y trabajadores agrícolas en general.4,13 El alcoholismo y la diabetes también se han descrito como factores de riesgo. La inmunosupresión, independientemente de la causa, también es un factor que predispone a la enfermedad diseminada o sistémica.1 La enfermedad también puede adquirirse mediante la manipulación del hongo en un entorno de laboratorio. Por último, hubo una interesante epidemia en el sur de Brasil en la que la esporotricosis se transmitió a los humanos a través de los arañazos de los gatos, lo que sugiere que podría ser una infección zoonótica.14 La mayoría de las especies aisladas en estos casos fueron S brasiliensis.
Formas clínicas5
- 1)
Esporotricosis linfocutánea. También conocida como esporotricosis linfangítica, esta forma clínica representa más del 75% de todos los casos de esporotricosis.15 Las lesiones se producen en zonas expuestas, como las manos, la cara y los pies. La enfermedad comienza como un nódulo indoloro de color púrpura o negruzco que se erosiona en una pequeña úlcera (chancro esporotrico) con bordes inflamados, un centro granulomatoso doloroso y una secreción mínima. A continuación se produce una linfangitis con nódulos secundarios a lo largo de la línea de drenaje linfático que pueden progresar hasta convertirse en úlceras; este patrón característico se conoce como propagación esporotrica (Fig. 1).6 El estado de salud general del paciente no se ve afectado.15 El curso de la enfermedad varía según la respuesta inmunitaria del huésped, la virulencia de la cepa, el tamaño del inóculo y la profundidad de la lesión.
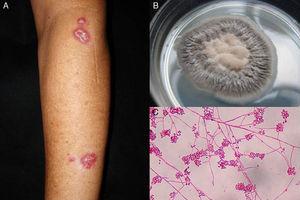 Figura 1.
Figura 1.A, Esporotricosis linfangítica. B, Cultivo de Sporothrix schenckii. C, Examen microscópico del cultivo en medio de agar dextrosa Sabouraud (eritrosina 2%, aumento original ×40).
(0.21MB). - 2)
Esporotricosis fija. Esta variante se caracteriza por la presencia de una lesión solitaria. La infección es limitada y generalmente se presenta como una placa verrugosa de crecimiento lento y menos progresiva. La esporotricosis fija no suele afectar a los vasos linfáticos y es más frecuente en zonas endémicas.16
- 3)
Otras formas clínicas:
Esporotricosis osteoarticular. Se trata de una forma diseminada de esporotricosis que afecta a los huesos y las articulaciones; es la forma más común de afectación sistémica.17
Esporotricosis pulmonar primaria. Esta variante afecta preferentemente a pacientes inmunodeprimidos y se adquiere por inhalación. Se asemeja a la tuberculosis cavitaria.16
Esporotricosis pulmonar metastásica. La forma metastásica de la esporotricosis pulmonar es poco frecuente y sólo se ha descrito en casos aislados. Ocurre en pacientes inmunocomprometidos, especialmente en aquellos con infección por el virus de la inmunodeficiencia humana (VIH) en la fase de SIDA.18
Invasión generalizada. La enfermedad diseminada es rara en la esporotricosis, aunque se ha descrito afectación meníngea y ocular en pacientes inmunodeprimidos con diabetes no controlada o alcoholismo crónico.
En México, al igual que en otros países de América Latina (donde se encuentran las mayores series de casos y la mayor experiencia en esporotricosis), la esporotricosis linfocutánea representa entre el 60% y el 80% de todos los casos de esporotricosis, la esporotricosis cutánea fija entre el 10% y el 30%, y otras formas clínicas entre el 1% y el 2%.16
La esporotricosis debe distinguirse de la tuberculosis, la leishmania, la tularemia, la nocardiosis cutánea, las infecciones por micobacterias no tuberculosas, el micetoma, la cromoblastomicosis y la lepra lepromatosa. En muchas de estas afecciones puede observarse una diseminación esporotricóide (linfangítica), que debe contemplarse en el diagnóstico diferencial.19
Diagnóstico
-
Pus (aspirado de nódulos). El examen microscópico directo no tiene valor en la esporotricosis, ya que las lesiones contienen muy pocas formas de levadura. Para el cultivo se puede utilizar agar dextrosa de Sabouraud (SDA) y SDA con antibióticos (cloranfenicol y cicloheximida), que produce colonias de levadura que inicialmente son blancas y luego se oscurecen (Fig. 1). El crecimiento es característicamente rápido (3-5 días)20 pero se necesitan 2 semanas para identificar el hongo y confirmar el diagnóstico.16 También es posible la identificación molecular mediante el análisis de la reacción en cadena de la polimerasa (PCR).10,21
-
Histología. El examen histológico revela una reacción granulomatosa mixta inespecífica con microabscesos neutrofílicos. El hongo se presenta como una pequeña forma de levadura en forma de cigarro, a veces rodeada de un material eosinofílico radiado característico conocido como cuerpo asteroide. Aunque los cuerpos asteroides pueden ayudar al diagnóstico, no son patognomónicos,16,20 ya que también se encuentran intracelularmente en la sarcoidosis, la silicosis y la lacaziosis (lobomicosis). Sin embargo, los cuerpos asteroides extracelulares son más característicos de la esporotricosis. Pueden ser necesarias varias muestras para visualizar los microorganismos, aunque son más fáciles de encontrar en el caso de la enfermedad diseminada o visceral.
Tratamiento
La esporotricosis puede resolverse espontáneamente en algunos casos, como durante el embarazo, aunque paradójicamente también se ha informado de diseminación en mujeres embarazadas.
-
Solución saturada de yoduro potásico. El tratamiento con yoduro de potasio, como solución saturada, se inicia con 5 gotas por comida. Esta dosis inicial se incrementa gradualmente hasta 20 ó 30 gotas por comida según los niveles de tolerancia. El tratamiento debe mantenerse durante 3 ó 4 semanas tras la resolución de las manifestaciones clínicas. Se desconoce el mecanismo de acción, aunque se cree que el yoduro de potasio actúa como inmunoestimulante. Los efectos adversos incluyen un sabor metálico en la boca, rinitis, expectoración, urticaria, petequias, erupción bullosa o acneiforme, vasculitis e inducción de hipotiroidismo o hipertiroidismo. El yoduro de potasio está contraindicado durante el embarazo.20,22
-
Itraconazol 200mg/d durante 3 a 6 meses.22 Este es el tratamiento de primera línea recomendado en la mayoría de las guías de tratamiento. Suele ser un poco más caro que el yoduro de potasio, pero tiene menos efectos adversos.
-
Otras opciones. Terbinafina 250-1000mg/d durante 3 a 6 meses23,24; fluconazol 400mg/d durante 3 a 6 meses22; anfotericina B (desoxicolato) 0.5-1mg/kg/d para la enfermedad sistémica o formulaciones liposomales o lipídicas de anfotericina B a una dosis de 3-5mg/kg/d22; calor local o termoterapia durante 2 o 3 meses,22 o una combinación de los tratamientos anteriores (yoduro de potasio con itraconazol, itraconazol con terbinafina y terbinafina con yoduro de potasio).25 La adición de terapia fotodinámica con aminolevulinato de metilo o incluso mejor azul de metileno intralesional al 1% (combinado o no con itraconazol) ha producido buenos resultados in vitro y en 1 paciente.26
La cirugía puede tener un papel importante en la esporotricosis osteoarticular.22 El desbridamiento y la artrodesis se consideraban tradicionalmente los tratamientos de elección, pero también se ha descrito que la sustitución de la articulación protésica seguida de un tratamiento antifúngico a largo plazo es una opción viable
1.1Cromoblastomicosis (Cromomicosis)
La cromoblastomicosis, también conocida como cromomicosis, es una infección fúngica polimórfica crónica de la piel y el tejido subcutáneo. Está causada por varias especies de hongos melanizados o dematiáceos, que producen un pigmento oscuro. Las formas parasitarias de estos hongos se denominan células fumagoides o muriformes (cuerpos escleróticos).27-30
Las especies más comunes que causan la cromoblastomicosis son Fonsecaea pedrosoi, Fonsecaea monophora, Cladophialophora carrionii, Phialophora verrucosa y Rhinocladiella aquaspersa.5,27,28 La mayoría de los pacientes tienen antecedentes de una lesión traumática relacionada con la madera o la vegetación, y más del 80% son trabajadores rurales de África, Asia y Sudamérica que suelen caminar descalzos. Los hongos responsables de la cromoblastomicosis se han encontrado en todo el mundo, aunque son más comunes en los países tropicales y subtropicales.27
Formas clínicas
El hongo generalmente penetra en la piel a través de una lesión cutánea, normalmente localizada en las extremidades inferiores.31 Aproximadamente 1 ó 2 meses después, el individuo infectado desarrolla una pápula que progresa hasta convertirse en un nódulo verrugoso de crecimiento lento (Fig. 2). La infección se limita al tejido subcutáneo y no se extiende al músculo ni al hueso, excepto en pacientes inmunodeprimidos. Las lesiones individuales pueden desarrollar un aspecto grueso en forma de coliflor y es frecuente la sobreinfección bacteriana. Puede producirse un linfedema secundario, que puede evolucionar a elefantiasis, y un carcinoma de células escamosas.27
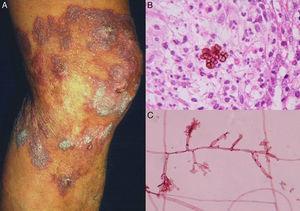
A, Cromoblastomicosis nodular-verrugosa. B, Biopsia que muestra células fumagoides. C, Examen directo del cultivo de Fonsecaea pedrosoi (biopsia; hematoxilina-eosina y eritrosina 2%, aumento original en ambos casos ×40).
Diagnóstico
-
Examen directo. El examen directo de costras y fragmentos de piel puede revelar formas parasitarias que se presentan aisladas o que forman septos característicos (Fig. 2). Las estructuras microscópicas observadas son comunes a todas las especies.27,28
-
Cultivo. Los hongos que causan la cromoblastomicosis crecen lentamente cuando se cultivan en SDA con o sin antibióticos (cloranfenicol y cicloheximida); producen colonias oscuras oliváceas o negras con una superficie plana aterciopelada y un centro elevado. La distinción entre especies es difícil y se basa en las estructuras reproductivas y la identificación molecular.30 También son útiles las técnicas de biología molecular (PCR), en particular las dirigidas a las regiones del espaciador transcrito interno (ITS) del ADN ribosómico (ADNr).32,33
-
Histología. El examen histológico muestra una hiperplasia pseudoepiteliomatosa característica en la epidermis y un infiltrado inflamatorio granulomatoso mixto con células gigantes que contienen estructuras fúngicas redondas características (Fig. 2) en la dermis.27
Tratamiento
La cromoblastomicosis es extremadamente difícil de tratar y suele ser refractaria a diversas opciones, incluidos los tratamientos no farmacológicos como el curetaje, la electrocoagulación y la criocirugía.5 Los antifúngicos deben mantenerse durante al menos 6 meses y, aunque pueden producir un resultado clínico favorable, las recidivas durante o después de la terapia son frecuentes. El tratamiento debe terminarse cuando desaparezcan todas las lesiones.27
Otros tratamientos incluyen la resección quirúrgica de las lesiones pequeñas; criocirugía local (en asociación con un antifúngico para evitar la diseminación linfática); itraconazol 200-400mg/día solo o combinado con 5-fluorocitosina 30mg/kg 4 veces al día durante 6 meses; terbinafina 250-500mg/d durante 12 meses, y en caso de afectación sistémica anfotericina B intravenosa a una dosis de 1mg/kg o formulaciones liposomales o lipídicas de anfotericina B a una dosis de 3-5mg/kg/d.27
Micetoma
El micetoma es una infección local crónica causada por varias especies de hongos y bacterias. La infección se denomina actinomicetoma cuando está causada por bacterias filamentosas aerobias y eumicetoma cuando está causada por hongos.34 Se caracteriza por la formación de agregados de los microorganismos causantes en abscesos. Estos agregados se conocen como granos o gránulos. Los gránulos pueden drenar a través de los senos que se abren en la piel o afectar a los huesos adyacentes. La enfermedad avanza por contagio directo, con muy pocos casos de diseminación a lugares distantes. Los agentes causantes se encuentran generalmente en el suelo y entran en el cuerpo a través de la piel rota. La mayoría de los casos afectan a trabajadores rurales.
Etiología
-
Hongos. Los hongos que causan el eumicetoma producen gránulos blancos u oscuros. Son particularmente comunes en África, India y México. Los gránulos oscuros están formados por Madurella mycetomatis, Trematosphaeria grisea y Leptosphaeria senegalensis,35 mientras que los gránulos blancos están formados por Fusarium spp, Acremonium spp y Aspergillus nidulans.
-
Bacterias filamentosas o actinomicetos aeróbicos. Los gránulos formados por estas especies son de color rojo (Actinomadura pelletieri), blanco-amarillo (Actinomadura madurae, Nocardia brasiliensis y Nocardia spp.) o amarillo-marrón (Streptomyces somaliensis). Los actinomicetos se encuentran en todo el mundo, no sólo en los países tropicales.36
Formas clínicas
Las características clínicas del micetoma causado por hongos y actinomicetos son muy similares. Las lesiones son más comunes en los pies, las espinillas y las manos. La manifestación clínica más temprana es un nódulo duro e indoloro que se extiende lentamente para producir pápulas y senos que descargan líquido que contiene gránulos sobre la superficie de la piel.35,36 El lugar original de la infección se distorsiona por la inflamación del tejido local, la formación de senos crónicos y la afectación ósea tardía (Fig. 3). Las lesiones rara vez son dolorosas, excepto en las fases tardías.
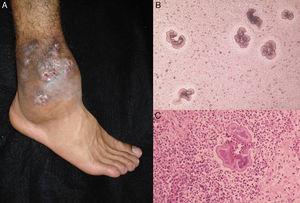
A, Actinomicetoma del pie. B, Gránulos de Nocardia sp. vistos en el examen directo (KOH, aumento original ×10). C, Biopsia (hematoxilina-eosina ×40).
Diagnóstico
Los gránulos del micetoma (Fig. 3) son un hallazgo clave para el diagnóstico y generalmente se encuentran al examinar la secreción de los senos o al aplastar una costra tomada de una lesión. El examen microscópico mostrará si estos gránulos están formados por pequeños actinomicetos o por filamentos micóticos más amplios. La identificación definitiva requiere un cultivo, que normalmente se realiza en SDA con o sin antibióticos (cloranfenicol y cicloheximida); se prefiere el cloranfenicol solo en el caso de los hongos hialinos. Los agentes también pueden identificarse mediante pruebas de biología molecular, en particular el análisis de PCR utilizando diferentes marcadores37 en función de los agentes causantes (por ejemplo, las regiones ITS del ADNr, la β-tubulina38 y la D1/D2). El análisis de la secuencia parcial del gen del ARN ribosómico, por el contrario, puede utilizarse para identificar las especies de Nocardia y Actinomadura.36 Los hallazgos histológicos son similares en todas las formas de micetoma, e incluyen un centro inflamatorio rico en células polimorfonucleares (verdaderos abscesos), células epitelioides, células gigantes y fibrosis. Los gránulos se localizan en el centro de la inflamación.35,39 Los estudios de imagen, aunque complementarios, pueden ayudar al diagnóstico mostrando la inflamación de los tejidos blandos, las lesiones osteolíticas y el engrosamiento cortical.
El diagnóstico diferencial debe incluir la osteomielitis bacteriana, la osteomielitis tuberculosa, la hidradenitis supurativa, el sarcoma de Kaposi y la tuberculosis cutánea, entre otros.35,39
Tratamiento
Actinomicetoma. El régimen de tratamiento con la base de evidencia más sólida para el micetoma nocardial es trimetoprim-sulfametoxazol más diaminodifenil sulfona (dapsona) durante 6 meses a 2 años. Para los casos refractarios puede utilizarse ácido clavulánico-moxicilina, administrado durante 6 meses.40-42 El tratamiento de elección para la infección extensa y/o la afectación visceral es la amikacina combinada con trimetoprim-sulfametoxazol39 o meropenem.43,44 Ha habido informes aislados de resultados satisfactorios con otros agentes en pacientes que no responden a estos tratamientos.36,39,45
Eumicetoma. A diferencia del actinomicetoma, donde el tratamiento farmacológico se asocia a buenos resultados, el tratamiento estándar del eumicetoma es una combinación de tratamiento médico y cirugía. Se han notificado resultados aceptables con el uso de triazoles de última generación, como el itraconazol y el fluconazol utilizados solos o en combinación con la terbinafina. Estos fármacos se administran durante un período prolongado y sólo después de agotar todas las opciones quirúrgicas.35,45
La feohifomicosis
La feohifomicosis es un grupo heterogéneo de micosis causadas por hongos de paredes oscuras (dematiáceos).46,47 Estos hongos se encuentran en todos los climas, aunque son más comunes en los climas tropicales. Recientemente se ha producido un aumento de casos entre pacientes inmunodeprimidos con infección por VIH o SIDA, receptores de trasplantes y pacientes diabéticos, entre otros.46,48
Los agentes causales más comunes son Exophiala spp, Bipolaris spp., Curvularia spp., Pleurophomopsis spp., Phaeoacremonium spp. y Alternaria spp. Los hongos se encuentran principalmente en los restos orgánicos.
Formas clínicas
-
Faeohipomicosis subcutánea. Tras un traumatismo local o la inoculación de material extraño, los pacientes desarrollan una lesión solitaria de crecimiento lento (generalmente un quiste o un nódulo, o posiblemente una placa o un absceso) normalmente localizada en las extremidades (Fig. 4).48,49 El diagnóstico diferencial debe incluir los lipomas, los quistes epidérmicos o sinoviales, los fibromas, los quistes de cuerpo extraño y los abscesos bacterianos.
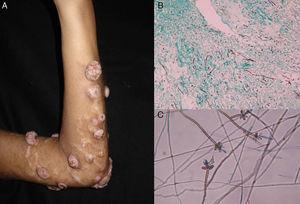 Figura 4.
Figura 4.A, Faeofomicosis nodular. B, Filamentos y levaduras en muestra de biopsia (Grocott, aumento original ×10). C, Examen microscópico de Veronaea botryosa (azul de algodón de lactofenol, aumento original ×40).
(0.22MB). -
Faeofomicosis sistémica o diseminada. Aunque es muy rara, la feohifomicosis sistémica es muy grave en pacientes inmunodeprimidos.50
Diagnóstico
La microscopía de montaje húmedo muestra hifas septadas oscuras de diagnóstico que forman ramas o cadenas (Fig. 4). El crecimiento es lento (3-4 semanas) en SDA y las colonias adquieren un color oliváceo o marrón oscuro. El análisis por PCR de marcadores como la β-tubulina y las regiones ITS puede utilizarse para la identificación molecular.51,52 La biopsia revela una pared de quiste formada por macrófagos en empalizada con hifas micóticas.49
Tratamiento
El tratamiento de las infecciones causadas por Exophiala spp. es controvertido, y una opción que se ha propuesto es la resección quirúrgica.48 Tampoco existen protocolos estándar para el tratamiento de las infecciones por Alternaria.53 La mejor opción para la feohifomicosis parece ser una combinación de terapia antifúngica (itraconazol, ketoconazol o terbinafina) y cirugía. Las cepas de Exophiala spp. tienden a ser resistentes al fluconazol. Las infecciones diseminadas se tratan con anfotericina B.48,49
Hialofomicosis
La hialofomicosis está causada por hongos hialinos (Hyphomycetes) que forman hifas septadas en el tejido.47 Esta clasificación, sin embargo, es bastante arbitraria, ya que hay muchos tipos de Hyphomycetes terrestres y acuáticos. Sin embargo, sólo unos pocos organismos pueden causar infecciones, la mayoría de las cuales son oportunistas, en los seres humanos.54,55 La mayoría de los géneros implicados en la hialofomicosis son morfológicamente idénticos cuando se observan en secciones de tejido y desencadenan la misma respuesta patológica. Los hongos que causan infecciones con frecuencia o tienen otra característica particularmente distintiva se asignan a una categoría diferente (por ejemplo, aspergilosis).
Los agentes más comunes implicados en la hialofomicosis son Aspergillus (fumigatus, niger, flavus), Scopulariopsis spp., Fusarium spp., Acremonium recifei, Paecilomyces spp., Purpureocillum spp. y Neoscytalidium spp.55 Todos ellos están ampliamente distribuidos en la naturaleza y pueden encontrarse en cualquier tipo de suelo, madera o material vegetal en descomposición.56 Afectan a individuos de cualquier sexo y a cualquier edad, y la inmunosupresión no es una condición necesaria para la infección.
Formas clínicas
La hialofomicosis puede clasificarse como superficial, subcutánea o sistémica.
-
Hialofomicosis superficial. Las infecciones superficiales incluyen la dermatomicosis y la onicomicosis. Son frecuentes en trabajadores rurales, pescadores, pacientes con quemaduras graves y neonatos prematuros.57,58
-
Hialofomicosis subcutánea. La inoculación traumática provoca abscesos, quistes y lesiones de tipo tumoral similares a las observadas en el micetoma (Fig. 5).56
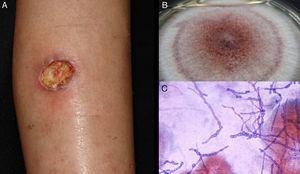 Figura 5.
Figura 5.Úlcera de hialofomicosis por Acremonium sp. B, Cultivo (medio de agar dextrosa Sabouraud). C, Examen directo del exudado (Giemsa, aumento original ×40).
(0.17MB). -
Hialofomicosis sistémica. Las infecciones sistémicas, aunque poco frecuentes, son muy graves. Afectan a pacientes inmunodeprimidos y pueden ser mortales. La diseminación hematógena y linfática conduce a la afectación de los pulmones y el sistema nervioso central.55,57
Diagnóstico
La identificación de hifas hialinas septadas mediante el examen microscópico de escamas de piel, fragmentos de uñas, secreciones o fragmentos proporciona un diagnóstico presuntivo, que luego se confirma mediante cultivo (Fig. 5). La mayoría de los hongos crecen en SDA sin antibióticos ni inhibidores.47,59 Como en los casos descritos anteriormente, también es posible la identificación molecular.60
El diagnóstico diferencial debe incluir otras dermatomicosis, quistes epidérmicos, actinomicetoma, eumicetoma, histoplasmosis y criptococosis.
Tratamiento
En individuos inmunocompetentes, los tratamientos de elección son los triazoles, la terbinafina o la cirugía.61 Cuando el sistema inmunitario está comprometido, el tratamiento de primera línea es la anfotericina B combinada con un triazol (itraconazol 200mg/d durante 6 meses o fluconazol 150mg dos veces por semana durante 6 meses).
Lacaziosis (Lobomicosis)
La lacaziosis, que anteriormente se conocía como lobomicosis, es una infección fúngica granulomatosa crónica de la piel y los tejidos subcutáneos descrita por primera vez con el nombre de blastomicosis queloidea en 1930 por Jorge Lobo en Recife, Brasil.62 Es una infección rara que se encuentra en América Central y del Sur; está causada por Lacazia loboi,62,63 una levadura que no se puede cultivar. Se cree que la fuente de infección está en el suelo y la vegetación. El hongo probablemente entra a través de la piel tras una lesión penetrante, como un pinchazo de espina o una picadura de insecto.
La lacaziosis se caracteriza por lesiones queloides con bordes lobulados bien definidos en zonas expuestas del cuerpo (frecuentemente la cara, los brazos o las piernas). Las lesiones se extienden a sitios contiguos, aunque la transmisión a sitios distantes también es posible a través de la autoinoculación.
Diagnóstico
El diagnóstico se ve facilitado por la identificación de abundantes estructuras fúngicas durante el examen directo y cadenas de células redondas difusas conectadas por pequeñas estructuras tubulares en muestras de biopsia.62 Los agentes causantes también pueden identificarse en el tejido mediante análisis de PCR, en particular ensayos dirigidos al fragmento 18S del ADNr.64
El diagnóstico diferencial debe incluir los queloides, la lepra lepromatosa y la leishmania anérgica.
Tratamiento
Los antifúngicos no son eficaces en la lacaziosis y el tratamiento definitivo es la resección quirúrgica.62,63
Zigomicosis
La zigomicosis es un grupo heterogéneo de infecciones fúngicas causadas por Zigomicetos oportunistas de los órdenes Mucorales (Rhizopus, Lichtheimia, Mucor y Rhizomucor) y Entomophthorales (Basidiobolus y Conidiobolus).65 En esta sección, sólo hablaremos de los hongos Entomophthorales, ya que los Mucorales se abordan en la segunda parte de esta revisión, que se ocupa de las micosis sistémicas.
La Entomophthoromycosis se caracteriza por la aparición de una masa dura y progresiva que afecta a los tejidos subcutáneos. Existen dos variantes. La primera está causada por Basidiobolus ranarum y es más frecuente en los niños.66 Las lesiones suelen aparecer en los hombros y las fajas pélvicas, y se presentan como una celulitis leñosa que se extiende lentamente. La segunda variante está causada por Conidiobolus coronatus y afecta a los adultos. La infección primaria comienza en los cornetes inferiores de la nariz y luego se extiende al centro de la cara, causando una hinchazón indurada dolorosa y una grave deformación de la nariz, los labios y las mejillas.65-68
Conclusión
Hemos revisado las principales características de las micosis subcutáneas y los principales métodos de diagnóstico y tratamiento disponibles (Tabla 1).
Resumen de las características de las micosis subcutáneas.
| Micosis | Agente causante principal | Diagnóstico | Tratamiento |
|---|---|---|---|
| Esporotricosis | Sporothrix schenckii | Cultivo de pus aspirado de nódulos; histología; PCR | Solución saturada de yoduro de potasio durante 3 semanas; itraconazol 200mg/d durante 3-6 meses; combinaciones |
| Cromoblastomicosis | Fonsecaea pedrosoi | Examen microscópico; cultivo; histología | Muy difícil. Itraconazol 200mg/d durante 6 meses; terbinafina durante 12 meses; anfotericina B; combinaciones |
| Micetoma | Aginomicetos filamentosos y hongos filamentosos | Identificación de gránulos de micetoma; cultivo; histología; PCR | Antibióticos para el actinomicetoma; antifúngicos+cirugía para el eumicetoma |
| Fefomicosis | Exophiala jeanselmei Alternaria spp. |
Examen microscópico y cultivo; histología; PCR | Controversial. Cirugía+combinación de antifúngicos |
| Hialofomicosis | Aspergillus oportunistas (fumigatus, niger, flavus), Fusarium spp., Paecilomyces, etc. | Examen microscópico y cultivo; PCR | Pacientes inmunocompetentes: triazoles; terbinafina; ciclopirox olamina; cirugía Pacientes inmunodeprimidos: anfotericina B combinada con un triazol durante 6 meses |
| Lacaziosis (lobomicosis) | Lacazia loboi | Examen microscópico; histología; PCR | Cirugía |
| Entomofthoromycosis | Conidiobolus coronatus Basidiobolus ranarum |
Examen directo y cultivo | Cirugía y antifúngicos sistémicos |
Abordamiento: PCR, reacción en cadena de la polimerasa.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.